醇添加对钴基催化剂费托合成反应的影响
姚芳芳 吴宝山 周利平 高军虎 李 莹 李永旺1,
(1中国科学院山西煤炭化学研究所,煤转化国家重点实验室,太原030001;2中国科学院大学,北京100049;3中国科学院山西煤炭化学研究所,煤炭间接液化国家工程实验室,太原030001;4中科合成油技术有限公司,太原030001)
1 引言
费托(FT)合成反应可将煤、天然气、生物质经合成气转化为液体燃料和高附加值的化学品,具有广泛的应用前景.1,2FT合成反应产物非常复杂,通常包含大量的烷烃、烯烃和少量的醇、醛、酸、酮、酯等含氧化合物,这些产物的生成路径是费托合成反应机理研究的热点之一.3-6一般认为,费托合成反应是个表面链增长单体逐级插入的聚合反应过程.根据单体的不同,人们提出了三种可能的费托合成反应机理:3表面碳化物机理、烯醇机理和CO插入机理.前者能解释烃的生成,但无法解释含氧化合物的生成,后两个机理虽然能够解释所有产物的生成,但缺少足够的实验支持.含氧化合物究竟是费托合成的初级产物还是二次产物,也是讨论的一个焦点.在反应气氛中加入探针分子,即加入模型化合物,是研究反应机理的有效手段.7-9本文以不同碳数的含氧化合物作为探针分子,通过添加实验探索其在费托合成反应中的作用,为反应机理研究提供更多的实验证据.
Emmett等10-12在常压、合成气气氛下,向铁基催化剂上加入14C标记的乙醇、1-丙醇,在烃类产物中检测到所加入醇的完整碳骨架,由此得出加入的醇有链引发作用.同时,他们发现醛和烯酮13,14在一定程度上也可以引发链增长.此后,Tau等15,16在Fe催化剂上进行了同位素标记的正丙醇和异丙醇添加实验,结果与Emmett等的一致.此外他们还发现,添加的乙醇、正戊醇和正己醇不会作为单体插入链增长,只有链引发作用,并且加入的醇主要发生脱水反应生成与添加醇相同碳数的烃.该研究重点在于分析14C标记的同位素添加后14C的去向,未考虑含氧化合物添加对总烃分布的影响.Sarkar等17,18在铁催化剂上通过添加乙酸、乙二醇、2-乙氧基乙醇和1,2-二乙氧基乙烷,结合微观可逆性原理,认为此类添加物均不是费托反应的中间体.
总结上述文献,含氧化合物添加实验多集中于铁基催化剂的研究,钴基催化剂则报道较少.另外,由于分析手段的限制,多数模型化合物添加实验,或是在气相色谱广泛应用之前,或是采用气相色谱在线分析和离线分析相结合的分析方法,很难排除产物取样、存放和分析过程中造成的误差.19,20因此,全产物在线分析已成为发展方向.Dictor和Bell,21Snavely和Subramaniam,22Hou9均提出用一台色谱对费托合成进行全产物在线分析.本文将在前人探索基础上,采用此方法对产物进行分析.
尽管钴基催化剂费托合成产物中含氧化合物含量较少,但从机理角度探讨含氧化合物的反应和生成路径,具有重要的研究价值.由此,本实验采用全产物在线分析方法,在Co/SiO2催化反应体系中进行了乙醇(CH3CH2OH)、正丙醇(CH3(CH2)2OH)、正戊醇(CH3(CH2)4OH)、正己醇(CH3(CH2)5OH)等含氧化合物的添加实验.对比考察醇类在惰性气氛Ar、H2以及合成气气氛下的反应行为,以期获得有关费托合成反应机理的进一步认识.
2 实验部分
2.1 催化剂制备
钴基催化剂采用等体积浸渍法制备.所用SiO2载体由酸性硅溶胶脱水后,在120°C干燥12 h,500°C焙烧5 h得到.用六水合硝酸钴(国药集团化学试剂有限公司,分析纯)配制一定浓度的硝酸钴溶液,等体积浸渍到均匀粒度的SiO2载体上,经120°C干燥12 h,450°C焙烧4 h后,重复上述步骤对催化剂进行二次浸渍,最终得到20Co/SiO2催化剂.SiO2载体和Co/SiO2催化剂的织构性质以及金属钴的质量分数见表1.
2.2 催化剂表征
采用Micromeritics ASAP 2420型物理吸附仪测定载体及催化剂的织构性质.催化剂体相元素组成采用Atom scan 16型电感耦合等离子原子发射光谱(ICP-AES)进行分析.
采用X射线衍射仪(XRD)对催化剂的体相结构进行表征.XRD测试在日本理学(Rigaku)D/max-2500仪上进行,Cu靶Kα(0.154 nm)射线,管电流100 mA,管电压 40 kV,扫描范围2θ=10°-80°,扫描速率4(°)·min-1,扫描步长0.02°.还原态催化剂的制备在石英管反应器中进行,还原结束后,利用注射器向反应管中注射一定量的液化石蜡以防止催化剂氧化,取出研磨后,进行XRD表征.

表1 催化剂的BET和ICP-AES表征结果Table 1 BET and ICP-AES characterization results of the catalysts
漫反射傅里叶变换红外光谱(DRIFTS)实验在德国Bruker公司生产的VERTEX70型红外光谱仪上进行,采用MCT检测器,HARRICK公司的原位高温漫反射池(ZnSe窗片).测量前,催化剂在H2气氛(30 mL·min-1)下400 °C原位还原3 h,然后切换为He气(20 mL·min-1)吹扫并在He气氛下降温至210°C.醇的吸附实验借助鼓泡塔进行.用He(或H2)通过鼓泡塔将乙醇蒸气带入红外池,吸附2 min后,关闭红外反应池气路的进、出口阀,进行红外光谱扫描测量.测试范围为4000-400 cm-1,扫描32次,分辨率为4 cm-1.
2.3 FT合成反应
FT合成反应采用自行设计的固定床微反应器(Φ20 mm×δ4 mm×L390 mm),具体的反应装置及流程见图1.原料气(CO(99.9%,经过脱硫、脱氧、脱羰、脱水剂进行净化),H2(99.999%),Ar(99.999%))分别通过Brooks 5850E型质量流量计计量,混合后进入反应器;液相添加物以双柱塞微量泵(2ZB-1L10,北京卫星制造厂,中国)计量后打入反应器.色谱自动进样阀定时采集支路产物进行尾气分析,为避免产物在管线冷凝,尾气至色谱段全程保温230 °C.
FT合成反应所用催化剂粒径60-80目,装载量0.5 g,以惰性的SiO2作为稀释剂两倍(体积比)于催化剂稀释.在常压,400°C,H2气氛下以120 mL·min-1·g-1(g-1指每克催化剂)还原10 h,然后切换为Ar吹扫并在Ar气氛下降至反应温度,最后切换为反应气氛.待反应达到稳定后,用双柱塞微量泵将醇(乙醇、正丙醇,北京化工厂,分析纯;正戊醇(分析纯)、正己醇,国药集团化学试剂有限公司,进口分装试剂)加入.通过控制反应条件(温度、压力、H2/CO和空速),保证产物以气态通过保温箱进入色谱,实现全产物在线分析.
2.4 产物分析
所有的反应产物均采用Agilent 7890A气相色谱仪在线分析.23该气相色谱采用三阀四柱双通道设计.三阀包括2个六通阀,1个十通阀;四柱分别为DB-Petro毛细柱、Propak Q填充柱、Plot毛细柱和分子筛毛细柱.热导检测器(TCD)通道用于分析H2、Ar、CO、CO2、甲烷、乙烯、乙烷、丙烯和丙烷;氢火焰检测器(FID)通道用于分析C4以上烃类及含氧化合物.Ar作为内标气计算H2、CO的转化率以及产物选择性.本文所用到的相关物理量定义如下:

图1 固定床微型FT合成反应装置流程Fig.1 Schematic diagram of fixed bed micro-reactor for FT synthesis reaction
碳数为i的烃的选择性(以下简称选择性):

碳数为i的烯烃与烷烃的摩尔比(简称烯烷比):


其中,mn表示碳数为n的烃的摩尔分数,α代表链增长因子,取n∈[3,10]区间内数据计算链增长因子α.
3 结果与讨论
3.1 催化剂表征
3.1.1 XRD表征
图2为氧化态和还原态催化剂的XRD谱图.从图中可以看出氧化态催化剂在20°、31°、36°、44°、59°、65°附近出现衍射峰.20°附近可归属为载体SiO2的特征衍射峰;31°、36°、44°、59°、65°附近则呈现Co3O4的特征衍射峰(PDF 42-1467).还原态催化剂在20°、44°附近出现衍射峰.20°附近为载体SiO2的特征衍射峰;44°附近为金属钴的特征峰(PDF 15-0806).可以看出,氧化态催化剂晶相呈现为Co3O4,还原态则为金属Co.在本实验条件下,催化剂已被完全还原为金属Co.金属Co一直被认为是钴基催化剂FT合成反应的活性相.24,25
3.1.2 DRIFTS表征
DRIFTS可用来跟踪检测反应条件下催化剂表面活性中间物种的变化.26为了考察醇在钴基催化剂表面的反应行为,本实验以乙醇为代表进行DRIFTS实验.

图2 氧化态和还原态催化剂的X射线衍射(XRD)谱图Fig.2 X-ray diffraction(XRD)patterns of calcined and reduced catalysts
图3A为He气氛下,Co/SiO2催化剂上添加乙醇后,原位红外吸收峰随时间的变化谱图,各个振动峰的频率及归属列于表2.由图3A(a)可见,乙醇在催化剂上的吸附主要在1060、1239、1390、2900-3000 cm-1附近出现红外吸收峰,分别归属为C―O、O―H、C―H的振动峰.27随着反应时间的增加,C―O振动峰迅速减弱,O―H振动峰逐渐减弱并趋于消失,而在1758和2360 cm-1附近出现新的吸收峰,分别归属为C=O和CO2的伸缩振动峰.27可以看出,随着反应时间的增加,乙醇逐渐被消耗,同时有CO2和其他新物种生成.Yee等28通过原位FTIR研究了乙醇在Pt/CeO2上的吸附,结果表明乙醇活化路径为先形成烷氧基中间体,然后转化成乙醛,再进一步反应生成其他物种.本实验中1758 cm-1附近的C=O伸缩振动峰可能为醛类C=O伸缩振动峰.
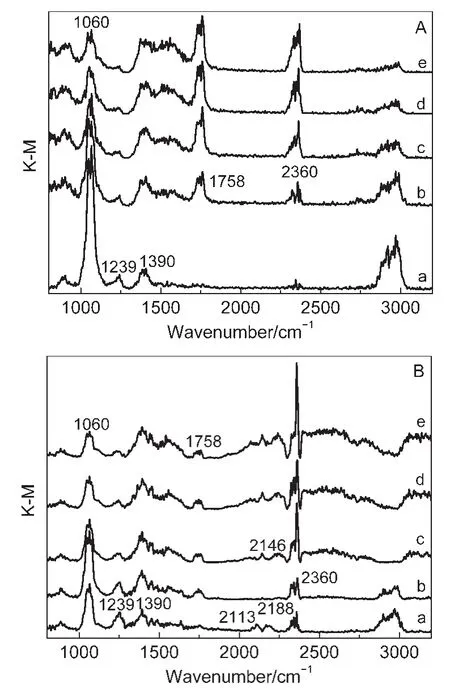
图3 在Co/SiO2催化剂上乙醇随时间变化的原位漫反射傅里叶变换红外光谱图Fig.3 DRIFTS of ethanol reaction as a function of time on Co/SiO2catalyst at 210°C

表2 红外峰的频率及归属Table 2 IR frequencies and assignment
图3B为H2气氛下,Co/SiO2催化剂上乙醇加入后,原位红外吸收峰随时间的变化谱图.与图3A(a)相比,图3B(a)除在 1060、1239、1390、2900-3000 cm-1附近出现C―O、O―H、C―H的振动峰外,在2113、2188 cm-1附近出现了新的红外吸收峰,同时2360 cm-1附近有CO2的红外吸收峰出现.随着反应时间增加,C―O、O―H、C―H的振动吸收峰逐渐减弱,1758 cm-1附近有C=O伸缩振动峰出现;2113、2188 cm-1附近吸收峰迅速消失,2146 cm-1处出现新的吸收峰.根据文献29-31报道,2113、2188 cm-1附近为气态CO分子的C―O振动吸收峰.由此可见,在H2气氛下,除有醛和CO2生成外,还有CO生成.
3.2 C2-C6醇添加实验
微观可逆性原理认为:在同一催化剂表面,含氧化合物生成的基元反应步骤与此含氧化合物分解的反应相一致.通过研究含氧化合物在催化剂上的分解反应,有助于获得关于其形成的信息.
3.2.1 C2-C6醇在惰性气氛下的反应行为
为避免醇加入造成催化剂失活,C2-C6伯醇在惰性气氛(Ar)下反应实验均在高空速(S.V.=198 mL·min-1·g-1)下进行.表3为Ar气氛下,乙醇、正丙醇、正戊醇及正已醇在Co/SiO2催化剂上的反应结果.由表3可以看出,乙醇反应生成的烃类产物主要是CH4(76%左右)、少量C2和C3+烃.正丙醇反应主要生成C2和C3以及少量C4+烃.而较高碳数的醇,正戊醇和正已醇在催化剂上反应分别未检测到C1-C2、C1-C3烃.正戊醇反应产物主要为C4、C5以及少量C6+烃;正已醇反应主要生成C5、C6和极少量C7+烃.此外,由表3还可看出,相同碳数的烃类产物中烯烃的选择性均高于烷烃,而且C2-C6醇反应还有CO生成.在对反应产物进行气相色谱-质谱联用(GC-MS)分析时发现,CnH2n+1OH反应有相同碳数的醛生成.Cn醛的生成再次证明图3A中1758 cm-1附近的红外吸收峰是醛类C=O振动峰.由此可见,惰性气氛下CnH2n+1OH在催化剂表面反应主要产物为CO、Cn-1和Cn烃以及少量C(n+1)+烃;且烯烃的选择性高于相同碳数的烷烃.

表3 Ar气氛下,C2-C6醇在钴基催化剂上的主要反应产物及其生成速率Table 3 Main products and their formation rates of C2-C6alcohols reaction over cobalt-based catalyst in the presence ofAr
3.2.2 C2-C6醇的加氢反应行为
图4为乙醇、正丙醇、正戊醇和正已醇在钴基催化剂上加氢反应产物选择性结果.乙醇加氢反应主要生成CH4(90%左右)和少量C2、C3+烃;正丙醇反应产物则为 CH4、C2、C3和少量 C4+烃.正戊醇反应生成CH4、C4和C5烃,以及少量 C2、C3和 C6+烃;而正已醇加氢反应产物则主要为CH4、C5和C6烃,还有少量
C2-C4、C7+烃.上述结果表明钴基催化剂上CnH2n+1OH加氢反应主要生成CH4、Cn-1和Cn烃.
对比Ar气氛和H2气氛下醇在钴基催化剂上反应结果,可以看出CnH2n+1OH(n=2,3,5,6)加氢反应与在Ar气氛下反应得到类似的产物组成.与在Ar气氛相比,在H2气氛下,除了CH4选择性显著增加外,正戊醇和正已醇加氢反应分别检测到C2、C2-C3烃的生成,这是由于在氢气气氛下,醇反应生成的CO与周围H2气氛形成了较高H2/CO的反应环境.在较高H2/CO条件下,合成气反应生成以甲烷居多的低碳烃.
图3A检测到CO2的红外吸收峰却未检测到CO的吸收峰;而在图3B中,H2气氛下可同时检测到CO和CO2的吸收峰.Jalama等32研究了Co/TiO2上添加乙醇对催化剂活性相的影响,发现大量乙醇加入会使催化剂瞬间氧化.文献报道33氧化钴与水煤气变换(WGS)反应有关,而WGS反应会有CO2生成.结合表3实验结果可以推测,Ar气氛下DRIFTS实验中CO2的出现是由于醇的加入造成金属钴被瞬间氧化,以至于乙醇反应生成的CO发生WGS反应生成CO2;在H2气氛下,金属钴处于氧化-还原的动态平衡中,以至乙醇反应生成的CO,部分发生WGS反应生成CO2,使得同时检测到CO和CO2的吸收峰.
Mavrikakis和Barbeau34对含氧化合物在过渡金属表面的反应机理进行了总结.认为醇和醛可以在第VIII族金属表面吸附形成酰基中间体脱除CO,从而完成脱羰反应.在过渡金属表面,醇和醛均不稳定并且可以相互转化.28,35Chen等36,37认为在钌催化剂上羧酸可被活化形成酰基中间体,进一步发生脱羰或加氢反应.由本文中C2-C6醇在钴基催化剂上于Ar气氛和H2气氛的反应结果以及DRIFTS表征实验,可知C2-C6醇在钴基催化剂上可能的反应路径见图5.首先,醇在催化剂上吸附、活化;然后主要的反应路径有两条:路径1为脱水反应生成与添加的醇相同碳数的烃;路径2先脱氢生成酰基中间体,然后酰基中间体发生脱羰反应,生成比添加醇少一个碳原子的烃中间体和CO(图5中,Rʹ表示比R少一个碳数的烃中间体).经反应路径2生成的CO,在H2分压较高的条件下可以发生反应生成较低碳数的烃;经路径1和2反应生成的烃中间体均可生成烯烃或加氢生成烷烃.对比分析C2-C6伯醇在Ar气氛和H2气氛的反应结果,可知本实验反应条件下醇沿路径2发生脱羰反应的比例高于路径1的脱水反应.

图4 C2-C6醇在钴基催化剂上加氢反应产物选择性Fig.4 Product selectivities of C2-C6alcohol hydrogenation reaction over the cobalt catalyst

图5 醇在钴基催化剂上的反应路径Fig.5 Possible route scheme of alcohols reaction over the cobalt catalyst
3.2.3 C2-C6醇添加对FT合成产物分布的影响
如果合成气气氛下醇的反应路径与图5假设的反应路径相符,伯醇(CnH2n+1OH)的加入主要发生脱羰和脱水反应,那么在合成气气氛中添加CnH2n+1OH后,CnH2n+1OH分解生成的(CH2)n-1和(CH2)n中间体将会消耗FT合成反应的链增长单体进行链增长反应,FT合成产物分布将会发生变化.
本系列不同碳数醇添加实验,均在相同的初始反应条件下单独进行.在固定床微反应器中,切换为合成气后约4 h可达到稳态,待反应达到稳态后将醇加入.本实验所有数据均取自稳态反应结果.
在合成气反应条件下以及不同碳数的醇加入时,FT合成反应CO转化率和产物选择性变化分别列于表4和图6.可以看出,C2-C6醇添加实验均在相近的CO转化率水平上进行;当反应原料中有醇加入时,CO转化率均有所下降.由图6可知,在醇未加入时,链增长因子(α)约为0.788.较低碳数的乙醇、正丙醇的加入,均导致C2烃的选择性明显增加,但对总烃分布的影响不规律.添加正戊醇时,FT合成产物中C1-C3烃选择性降低,C4+选择性增加,其中C4烃增幅最大;正已醇加入时,C1-C3烃选择性降低,C5烃选择性显著增加,C6+烃呈现近似平行增长趋势.由上可知,不同碳数醇的加入均会使CO转化率有所下降;较低碳数醇的加入,FT合成产物分布变化较复杂,而添加较高碳数的醇CnH2n+1OH(n=5,6)时,总烃选择性从Cn-1开始增加,且Cn-1增幅最大.

表4 未添加与添加醇时FT合成反应的CO转化率Table 4 CO conversion during FT synthesis reaction without and with alcohol addition
本实验钴基催化剂上CnH2n+1OH(n=5,6)加入后,C1-Cn-2烃的选择性受到抑制,C(n-1)+烃的选择性明显增加,这是由于添加的醇在催化剂上被活化生成碳数为n-1和n的中间体,这些中间体会消耗催化剂上C1单体从而引发链增长反应.周利平23在铁催化剂上进行了伯醇添加实验,得到与本文类似的实验现象.他支持产物选择性发生变化的原因是加入醇的链引发作用.然而铁基催化剂上CnH2n+1OH加
入时,C1-Cn-1烃的选择性降低,而Cn+烃选择性增加,这是由于醇在钴基和铁基催化剂上被活化生成的中间体不同所致.Fujimoto等38在超临界条件下进行烯烃添加实验时,也发现加入的烯烃会在催化剂表面被活化发生链引发反应而改变产物分布.早期Emmett10-14和Davis15,16等的研究同样支持加入的醇具有链引发作用,但是由于添加的醇大多集中在低碳数段,而没有发现醇的加入可以改变产物分布.

图6 添加C2-C6醇对FT合成产物分布的影响Fig.6 Effect of C2-C6alcohol addition on the product distribution of FT synthesis

图7 C2-C6醇添加对FT合成产物烯烷比(O/P)的影响Fig.7 Effect of C2-C6alcohol addition on the olefin to paraffin ratio(O/P)of FT synthesis products
由图6可以看出,费托合成产物分布的基本规律为甲烷含量最高,C2组分含量较低,从C3开始烃的选择性随碳数增加而下降,在C2处出现拐点.本实验中,低碳数醇的加入对总烃选择性影响不明显,而高碳数醇对产物分布影响显著,可能存在两方面的原因:一是费托合成反应产物碳数越高,产物选择性越低,因此,相同量的不同碳数醇的加入对长链烃的影响要远大于短链烃;另一方面,较低碳数的乙醇、正丙醇加入到FT合成反应体系时,醇被活化生成的烃中间体(主要为C1-C3)处于产物分布的不规律段,以至于添加低碳醇对产物分布影响不规律.另外,与文献报道32相同,CnH2n+1OH(n=2,3,5,6)的加入均会使FT合成产物中烯烷比显著增加,见图7.结合在Ar和H2气氛下醇的反应结果,可知:醇在FT合成过程中的反应路径与空白实验所推测的反应路径一致,主要发生脱羰反应和脱水反应,且脱羰反应起主要作用.可以推测所添加的碳数不同的醇均有链引发作用.
虽然铁和钴均可催化FT合成反应,醇加入后反应路径并不相同,在铁基催化剂上主要发生脱水反应而在钴上则发生脱羰反应,那么钴基费托合成反应中,醇是反应的初级产物还是中间体,有待进一步研究.
4 结论
在固定床微反应器上利用全产物在线的分析方法,在Co/SiO2催化剂上,通过对比考察C2-C6醇(CnH2n+1OH:n=2,3,5,6)分别在Ar、H2以及合成气气氛中的反应行为,研究表明:在费托合成反应条件下,CnH2n+1OH在Co基催化剂上主要反应路径有两条,脱羰生成比添加醇少一个碳数的烃中间体和脱水生成相同碳数的烃.这两种路径生成的中间体在催化剂上均会发生链引发从而生成更多的长链烃.醇类在FT合成催化剂上的反应是一个复杂的过程,有待进一步研究.
致谢:本论文工作得到中科合成油技术有限公司在设备和资金方面的大力支持,在此表示感谢.
(1) Hao,X.;Dong,G.;Yang,Y.;Xu,Y.;Li,Y.Chem.Eng.Technol.2007,30(9),1157.
(2)Xiang,H.W.;Tang,H.Q.;Li,Y.W.J.Fuel.Chem.Technol.2001,29,289.[相宏伟,唐宏青,李永旺.燃料化学学报,2001,29,289.]
(3)Van Der Laan,G.P.;Beenackers,A.A.C.M.Cat.Rev.1999,41(3-4),255.doi:10.1081/CR-100101170
(4) Rofer-DePoorter,C.K.Chem.Rev.1981,81(5),447.doi:10.1021/cr00045a002
(5) van Dijk,H.A.J.The Fischer-Tropsch Synthesis:A Mechanistic Study Using Transient Isotopic Tracing;Eindhoven:Technische Universiteit Eindhoven,2001.
(6) Gao,H.Y.;Chen,J.G.;Xiang,H.W.;Yang,J.L.;Li,Y.W.;Sun,Y.H.Chin.J.Catal.2001,22,133.[高海燕,陈建刚,相宏伟,杨继礼,李永旺,孙予罕.催化学报,2001,22,133.]
(7) Sage,V.;Burke,N.Catal.Today2011,178(1),137.doi:10.1016/j.cattod.2011.09.013
(8)Turner,M.L.;Marsih,N.;Mann,B.E.;Quyoum,R.;Long,H.C.;Maitlis,P.M.J.Am.Chem.Soc.2002,124(35),10456.doi:10.1021/ja026280v
(9) Hou,L.Fischer-Tropsch Studies withAcetylenic Compounds as Probes.Ph.D.Dissertation,University of Pittsburgh,Pittsburgh,2005.
(10)Kummer,J.T.;Emmett,P.H.J.Am.Chem.Soc.1953,75(21),5177.doi:10.1021/ja01117a008
(11) Hall,W.K.;Kokes,R.J.;Emmett,P.H.J.Am.Chem.Soc.1957,79(12),2983.doi:10.1021/ja01569a001
(12)Hall,W.K.;Kokes,R.J.;Emmett,P.H.J.Am.Chem.Soc.1960,82(5),1027.doi:10.1021/ja01490a005
(13) Blyholder,G.;Emmett,P.H.J.Phys.Chem.1959,63(6),962.doi:10.1021/j150576a044
(14) Blyholder,G.;Emmett,P.H.J.Phys.Chem.1960,64(4),470.doi:10.1021/j100833a023
(15)Tau,L.M.;Dabbagh,H.A.;Halasz,J.;Davis,B.H.J.Mol.Catal.1992,71(1),37.doi:10.1016/0304-5102(92)80006-3
(16)Tau,L.M.;Dabbagh,H.A.;Davis,B.H.Energy Fuels1991,5(1),174.doi:10.1021/ef00025a030
(17) Sarkar,A.;Keogh,R.;Bao,S.;Davis,B.Catal.Lett.2008,120(1-2),25.doi:10.1007/s10562-007-9261-z
(18) Sarkar,A.;Keogh,R.A.;Bao,S.;Davis,B.H.Appl.Catal.A:Gen.2008,341(1-2),146.
(19) Fan,G.X.Analysis of Fischer-Tropsch Synthesis Cold Trap Oils.MS Dissertation,Institute of Coal Chemistry,Chinese Academy of Science,Shanxi,2007.[樊改仙.F-T合成油相产物的分析研究[D].山西:中国科学院山西煤炭化学研究所,2007.]
(20) Gao,J.;Wu,B.;Zhou,L.;Yang,Y.;Hao,X.;Xu,J.;Xu,Y.;Li,Y.Ind.Eng.Chem.Res.2012,51(36),11618.doi:10.1021/ie201671g
(21) Dictor,R.A.;Bell,A.T.Ind.Eng.Chem.Fundam.1984,23(2),252.doi:10.1021/i100014a019
(22)Snavely,K.;Subramaniam,B.Ind.Eng.Chem.Res.1997,36(10),4413.doi:10.1021/ie9702791
(23) Zhou,L.P.Kinetic Study of the Fischer-Tropsch Synthesis over an Industrial Iron-based Catalyst.Ph.D.Dissertation,Institute of Coal Chemistry,ChineseAcademy of Science,Taiyuan,2011.[周利平.工业铁基催化剂F-T合成动力学研究[D].太原:中国科学院山西煤炭化学研究所,2011.]
(24)Zhang,Q.H.;Kang,J.C.;Wang,Y.ChemCatChem2010,2,1030.
(25)Khodakov,A.Y.;Chu,W.;Fongarland,P.Chem.Rev.2007,107(5),1692.doi:10.1021/cr050972v
(26) Xin,Q.In situ Techniques in Catalysis Research,1st ed.;Peking University Press:Beijing,1993.[辛 勤.催化研究中的原位技术.第一版.北京:北京大学出版社,1993.]
(27) Weng,S.F.Fourier Transform Infrared Spectroscopy Analysis,2nd ed.;Chemical Industry Press:Beijing,2010.[翁诗甫.傅里叶变换红外光谱分析.第二版.北京:化学工业出版社,2010.]
(28) Yee,A.;Morrison,S.J.;Idriss,H.J.Catal.2000,191(1),30.doi:10.1006/jcat.1999.2765
(29) Zhang,J.L.;Ren,J.;Chen,J.G.;Sun,Y.H.Acta Phys.-Chim.Sin.2002,18,260.[张俊岭,任 杰,陈建刚,孙予罕.物理化学学报,2002,18,260.]doi:10.3866/PKU.WHXB20020314
(30) Szegedi,Á.;Popova,M.;Mavrodinova,V.;Minchev,C.Appl.Catal.A:General2008,338(1-2),44.
(31) Prieto,G.;Martínez,A.;Concepción,P.;Moreno-Tost,R.J.Catal.2009,266(1),129.doi:10.1016/j.jcat.2009.06.001
(32) Jalama,K.;Coville,N.J.;Hildebrandt,D.;Glasser,D.;Jewell,L.L.Fuel2007,86(1-2),73.
(33) Zhou,W.Deactivation Studies of Co-Based Catalysts for Fischer-Tropsch Synthesis in Fixed-Bed Reactor.Ph.D.Dissertation,Institute of Coal Chemistry,ChineseAcademy of Science,Taiyuan,2005.[周 玮.钴基催化剂在固定床Fischer-Tropsch合成反应中的失活行为研究[D].太原:中国科学院山西煤炭化学研究所,2005.]
(34)Mavrikakis,M.;Barteau,M.A.J.Mol.Catal.A:Chem.1998,131(1-3),135.
(35) Cheng,J.;Hu,P.;Ellis,P.;French,S.;Kelly,G.;Lok,C.M.J.Phys.Chem.C2008,112(25),9464.doi:10.1021/jp802242t
(36) Chen,L.;Zhu,Y.;Zheng,H.;Zhang,C.;Zhang,B.;Li,Y.J.Mol.Catal.A:Chem.2011,351,217.doi:10.1016/j.molcata.2011.10.015
(37) Chen,L.;Zhu,Y.;Zheng,H.;Zhang,C.;Li,Y.Appl.Catal.A:General2012,411-412,95.
(38)Liu,X.;Li,X.;Fujimoto,K.Catal.Commun.2007,8(9),1329.doi:10.1016/j.catcom.2006.12.002

