椭球形金纳米棒作为癌细胞靶向探针的研究
李爱华,高斌,贺克武,程继新,肖卫华
最近报道球形的金纳米颗粒(gold nanorods,GNRs)对肿瘤细胞放疗具有一定的增敏作用[1-3],可以利用金纳米探针靶向结合肿瘤细胞,联合125I粒子的放射活性杀死肿瘤细胞,以减少125I粒子植入所需的处方剂量,同时可达到完全适形、均匀杀伤肿瘤细胞,并保护正常细胞免受放射线损伤。金纳米棒联合125I粒子组织间植入治疗肿瘤,将会为临床防治肿瘤开辟一条新的途径。本文报道选用二氧化硅作为壳材,制备椭球形二氧化硅包覆的金纳米棒(GNRs@SiO2)。
1 材料与方法
1.1 叶酸耦联GNRs@SiO2的合成与表征
1.1.1 GNRs@SiO2的制备采用诱导晶种生长法,按参考文献[4],在反应溶液中加入一定量的GNRs晶种,在表面活性剂分子作用下,GNRs定向生长为具有一定轴比的金纳米棒。取10 ml制备好的金纳米棒溶液以1.2×104g离心2次,弃上清液,然后将底物超声分散在10 ml超纯水中。滴加氨水,调溶液pH值为10。然后向瓶中加入10 mmol/L正硅酸乙酯的乙醇溶液2 ml,剧烈磁力搅拌24 h。将二氧化硅包覆的金纳米棒进行离心收集,先后用去离子水和无水乙醇各洗2次。最后,将制备好的纳米复合材料超声分散在无水乙醇中。
1.1.2 GNRs@SiO2的表面氨基化在制备好的GNRs@SiO2乙醇溶液中,加入氨基丙基三甲氧基硅烷(3-APTS)乙醇溶液后混匀,80℃恒温磁力搅拌反应4 h。收集溶液,先后用无水乙醇和去离子水各离心洗涤2次,每次15 min,弃上清液,将所得底物超声分散在超纯水中。
1.1.3 叶酸耦联GNRs@SiO2先将N-羟基丁二酰亚胺(NHS)0.1 mg、二氯乙烷(EDC)2 mg以及0.2 mg叶酸加入500μl去离子水中混匀避光旋转反应1 h,将叶酸的羧基活化后,加入制备好的GNRs@SiO2-NH2水溶液20 ml,避光旋转反应24 h。以1×104g离心洗涤2次,每次15 min,收集溶液,弃上清液。将底物叶酸耦联的GNRs@SiO2(GNRs@SiO2-FA)超声分散在5 ml超纯水中备用。
1.1.4 表征用透射电镜观察所制备GNRs的大小、形态和结构;用可见紫外吸收光谱检测二氧化硅包覆前后金纳米棒光学性质的变化以及叶酸偶联二氧化硅包覆后的金纳米棒(GNRs@SiO2-FA)的紫外吸收图谱。
1.2 GNRs@SiO2-FA的生物相容性检测
采用HepG2肝癌细胞株(购自上海细胞库),将细胞在加有10%小牛血清RPMI 1640培养液中培养至合适时间。取对数生长期细胞(长满皿底面积约80%时),消化后调节细胞浓度为5 000个/ml,以100μl/孔的密度接种于96孔板,培养24 h后,弃培养液,加入含有不同浓度(金元素浓度为25×10-6,12.5×10-6,5×10-6,2.5×10-6,0.5×10-6)GNRs@SiO2-FA的RPMI 1640培养液100μl。细胞继续在37℃培养箱中孵育24、48 h后,分别加入5 mg/ml MTT 20μl,继续培养4 h,终止培养,吸去孔内培养液。每孔加入二甲基亚砜(DMSO)100μl,置于摇床上低速振荡15 min,使结晶物充分溶解,在酶标仪490 nm波长吸光度处测量各孔的吸光值。同时设置调零孔(培养基、MTT、DMSO),对照孔(细胞、培养基、MTT、DMSO),每组设5个复孔。实验重复3次,取平均值分析。细胞存活率=(实验组吸光强度均值/阴性对照吸光强度均值)×100%。
1.3 透射电镜观察GNRs@SiO2-FA进入细胞过程
取对数生长期的HepG2细胞,在培养瓶中培养,在37℃、5%CO2条件下,培养24 h。将培养瓶中的培养基吸出,用PBS缓冲液洗3次。实验组加入RPMI 1640培养液9 ml和GNRs@SiO2-FA溶液1 ml,对照组加入10 ml RPMI 1640培养液,培育1、4、12、24 h后终止培养,胰酶消化收集细胞,将细胞混悬液放入50 ml离心管离心(1 000 g)6 min,将细胞团聚物重溶于PBS液,移至2 ml Ep管中,离心(800 g)4 min,弃上清液。加入1.5 ml的2.5%戊乙醛前固定,4℃下1%锇酸后固定2 h,乙醇-丙酮梯度脱水,环氧树脂包埋,超薄切片,透射电镜下观察、照椎。
1.4 荧光染料罗丹明标记
将罗丹明异硫氰酸酯(RBITC)溶于乙醇中,加入氨基化的GNRs@SiO2-FA溶液中,混合溶液pH值调至9.0,RBITC与GNRs@SiO2-FA表面的氨基基团室温下反应,12 h后离心洗涤3次,将纳米颗粒重悬于无水乙醇中,即得到罗丹明标记的GNRs@SiO2-FA。
1.5 激光共聚焦显微镜成像
将灭菌处理的盖玻片放入6孔板中,用含10%小牛血清的RPMI 1640培养液将对数生长期的HepG2细胞浓度调节至5×104个孔,接种在6孔板中,37℃、5%CO2下培养24 h,加入罗丹明标记的GNRs@SiO2-FA共培养2 h,以未加罗丹明标记的GNRs@SiO2-FA作为对照。移出培养液.用RPMI 1640培养液冲洗细胞3次,室温下用细胞固定液固定细胞10 min,再用PBS液冲洗。在载玻片上滴加1滴抗荧光淬灭的封片液,盖上盖玻片封片,用莱卡激光共聚焦显微镜成像(CLSM,德国,双光子系统)。
2 结果
2.1 表征
通过透射电镜表征,可观察到制备出的二氧化硅包覆的金纳米棒(GNRs@SiO2)呈椭球形(图1)。金纳米棒呈棒状位于中心,二氧化硅包覆于其表面。
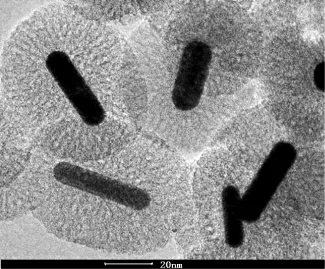
图1电镜下椭球形SiO2包覆GNRs
图2 是金纳米棒和GNRs@Si O2以及GNRs@Si O2-FA的紫外吸收图谱,可见金纳米棒有2个特征吸收峰,分别位于516 nm和712 nm处;而包覆椭球形二氧化硅后的金纳米棒(GNRs@SiO2)的2个特征吸收峰位于516 nm和714 nm处。通过紫外吸收图谱检测发现,二氧化硅包覆金纳米棒前后的特征吸收峰位置基本没有改变,表明二氧化硅壳层对金纳米棒进行表面修饰以后,光学特性没有改变。
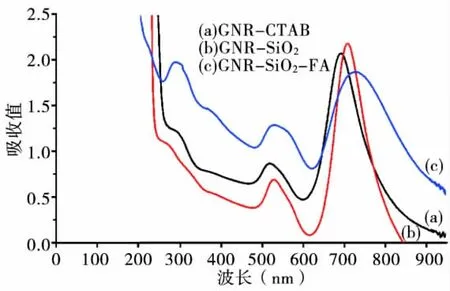
图2 GNRs、GNRs@SiO2和GNRs@SiO2-FA的紫外吸收图谱
同时可见,叶酸偶联二氧化硅包覆的金纳米棒(GNRs@SiO2-FA)吸收峰除了金纳米棒的特征吸收峰外,在282 nm处出现了1个新的吸收峰,这与叶酸的吸收峰位置一致。
2.2 二氧化硅包覆的金纳米棒的生物相容性检测
图3是不同浓度GNRs@SiO2-FA对HepG2细胞的毒性测定结果,可见细胞存活率均大于87%,毒性为0~1级,属于对细胞的无毒范畴。说明在一定浓度范围内表面修饰的纳米探针对HepG2细胞体外培养生物安全性较好。

图3 不同浓度GNRs@SiO2-FA对HepG2细胞毒性测定
2.3 细胞摄取GNRs@SiO2-FA过程
电镜下可见GNRs@SiO2-FA能以纳米颗粒形式通过细胞吞噬方式进入细胞。同时发现进入细胞后,GNRs@SiO2-FA椭球型形状没有遭到破坏。细胞吞噬GNRs@SiO2-FA的速度较快,在与细胞接触1 h后,观察到已有GNRs@SiO2-FA与细胞膜接触,细胞伸出伪足;4 h后,有更多的GNRs@SiO2-FA与细胞膜接触,并有膜样结构的吞噬泡形成,细胞质中有少量的GNRs@SiO2-FA;12 h后,见细胞质内大量GNRs@SiO2-FA,部分靠近细胞核边缘,细胞核内未见GNRs@Si O2-FA。24 h后,有的GNRs@Si O2-FA已与细胞核膜接触,但GNRs@SiO2-FA依然主要存在于细胞质内,细胞核内未见GNRs@Si O2-FA。见图4。
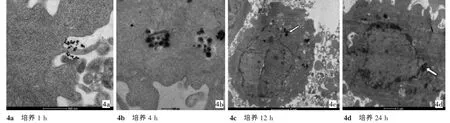
图4 GNRs@SiO2-FA与HepG2细胞培养不同时间的电镜下所见
3.4 激光共聚焦显微镜成像
用激光共聚焦显微镜荧光检测GNRs@SiO2-FA的细胞摄取过程,可见经过RBITC修饰的GNRs@SiO2-FA发射543 nm的红色荧光,细胞照片结果表明,GNRs@SiO2-FA可携带荧光探针进入细胞内,同时发现GNRs@SiO2-FA在HepG2细胞质内分布较多,而其在细胞核内分布较少,见图5。
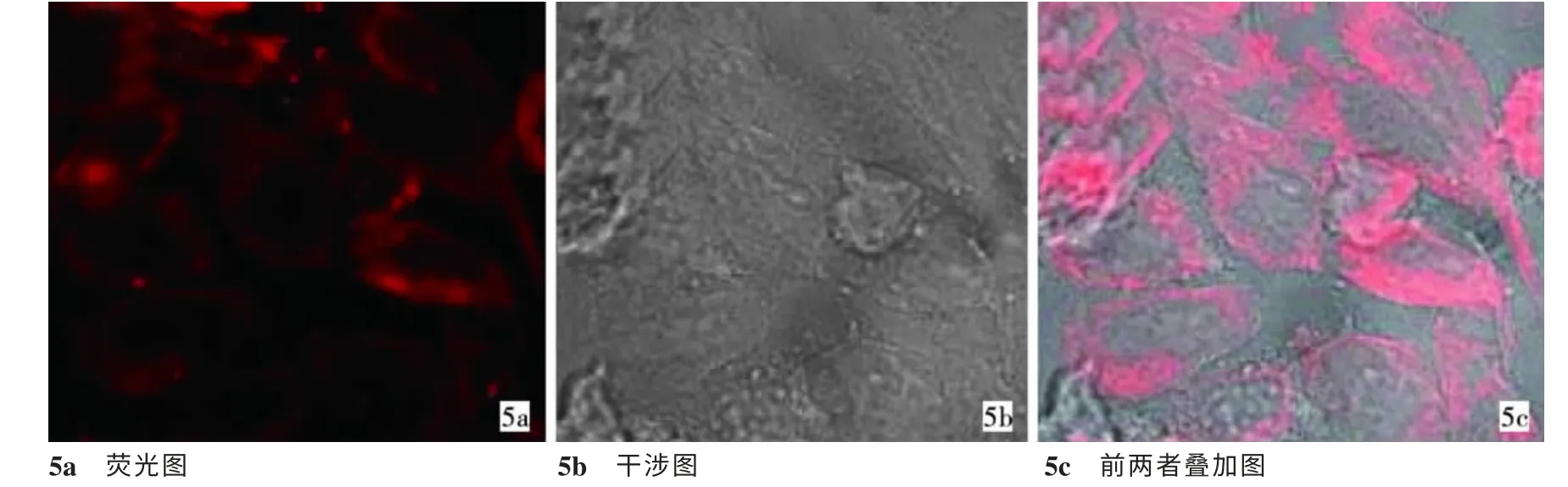
图5 GNRs@SiO2-FA细胞摄取的激光共聚焦显微镜成像
3 讨论
金纳米棒是一种棒状的GNR,具有独特的光学特性,在可见光区和近红外区,具有横向和纵向表面等离子体共振峰(SPR)[5-6],金纳米棒还具有较好的生物适应性,表面容易被抗体、生物素、寡核苷酸、酶等探针分子功能化[7-8]。金纳米棒可吸收近红外激光并转化为热能释放到局部环境,这种光热效应在疾病的治疗中具有重要的应用价值。文献报道金纳米的周围温度在纳秒范围内可达到1 000℃[9]。
晶种生长法是金纳米棒合成最广的一种方法。此方法需用大量表面活性剂十六烷基三甲基溴化铵(CTAB)覆盖在金纳米棒的表面维持金纳米棒的稳定,而CTAB具有较强的生物毒性[10]。另外,由于CTAB吸附双层分子的存在,金纳米棒表面很难与其他生物分子相结合[11],这就限制了金纳米棒在生物医学领域的应用。因此,寻求一种较好的金纳米棒表面化学修饰方法,将为金纳米棒在生物医学领域的应用开辟更好的发展前景。
纳米二氧化硅无毒性,生物相容性较好,具有优良的透光性,对包覆后的金纳米棒光吸收性能影响较小[12-13]。叶酸在肿瘤细胞膜表面高度表达,而在绝大多数正常组织中几乎不表达[14],所以叶酸作为靶向配体可与叶酸受体过度表达的癌细胞结合。如何将叶酸与金纳米棒结合是目前国内外研究的热点问题。本研究选用二氧化硅作为壳材,制备椭球形二氧化硅包覆的金纳米棒(GNRs@SiO2)。并用硅烷耦联剂和二氧化硅耦联,使其表面带有大量氨基,将叶酸联接到二氧化硅包覆的金纳米棒(GNRs@SiO2-FA),用RBITC与GNRs@SiO2-FA表面的氨基基团反应,得到罗丹明标记的GNRs@SiO2-FA。所制备的材料有良好的生物相容性,解决了传统的金纳米棒合成过程中因使用稳定剂而产生的细胞毒性[15-16]。应用激光共聚焦显微镜观察,发现金纳米棒能够运载荧光染料进入细胞。
本文成功地制备出一种椭球形核-壳结构二氧化硅包覆的金纳米复合材料,提高了金纳米棒的稳定性和分散性,细胞安全性实验证明,表面修饰后的金纳米棒有良好的生物相容性,透射电镜图像观察到金纳米颗粒以细胞吞噬的方式进入细胞的过程;激光共聚焦显微镜图像表明,GNRs@SiO2-FA能携带荧光探针进入细胞内,可用于负载荧光染料对细胞进行成像。GNRs@SiO2-FA可作为荧光试剂或其他生物标记物的载体,广泛应用于疾病诊断或治疗,特别是能与叶酸高表达的癌细胞靶向结合,使其在肿瘤的125I粒子介入治疗方面有很好的发展前景。
[1]Zhang X,Xing JZ,Chen J,et al.Enhanced radiation sensitivity in prostate Cancer by gold-nanoparticles[J].Clin Invest Med,2008,31:E160-E167.
[2]Liu C,Wang CH,Chien CC,et al.Enhanced x-ray irradiationinduced cancer cell damage by gold nanoparticles treated by a new synthesis method of polyethylene glycol modification[J].Nanotechnology,2008:19:295104.
[3]Yang DP,Cui DX.Advances and prospects of Gold nanorods[J].Chem Asian J,2008,3:2010-2022.
[4]Pan B.End-to-end self-assembly and colorimetric characterization of gold nanorods and nanospheres via oligonucleotide hybridization[J].Nanotechnology,2005,16:1776-1780.
[5]Eustis S,E1-Sayed MA.Why gold nano-particles are more preciousthan pretty gold:noble metalsurface plasmon resonance and its enhancement of the radiative and nonradiative properties of nanocrystals of different shapes[J].Chem Soc Rev,2006,35:209-217.
[6]Liz-Marzán LM.Tailoring surface plasmons through themorphology and assembly of metal nanoparticles[J].Langmuir,2006,22:32-41.
[7]Tong L,Wei Q,Wei A,et al.Gold nanorods as contrast agents for biological imaging:optical properties,surface conjugation and photothermal effects[J].Photochem Photobiol,2009,85:21-32.
[8]马占芳,田乐,邸静,等.基于金纳米棒的生物检测、细胞成像和癌症的光热治疗[J].化学进展,2009,21:134-142.
[9]Huettmann G.Model system for investigating laser-induced subcellular microeffects[J].2001.
[10]Connor EE,Mwamuka J,Gole A,et al.Gold nanoparticles are taken up by human cells but do not cause acute cytotoxicity[J].Small,2005,1:325-327.
[11]Mirska D,Schirmer K,Fnari SS,et al.Colloids surf[J].B,2005,40:51-59.
[12]Chen ZL,Sun Y,Huang P,et al.Studies on preparation of photosensitizer loaded magnetic silica nanoparticles and their Anti-Tumor effects for targeting photodynamic therapy[J].Nanoscale Res Lett,2009,4:400-408.
[13]Xie C.Preparation of a novel amino functionalized fluoresceindoped silica nanoparticle for pH probe[J].Nano Biomed Eng,2009,1:37.
[14]田慧,张奇,项光亚,等.叶酸受体介导的肿瘤靶向治疗研究进展[J].中国临床药理学杂志,2006,22:227-229.
[15]Wang CG,Chen Y,Wang TT,et al.Gold nanorods embedded silica particles as Raman label for immunoassay[J].Adv Funct Mater,2008,18:355-361.
[16]Wang CG,Ma ZF,Wang TT,et al.Synthesis,assembly,and biofunctionalization of silica-coated Gold nanorods for colorimetric biosensing[J].Adv Funct Mater,2006,16:1673-1678.