血清CA125、溶血磷脂酸联合检测诊断卵巢上皮性癌的临床价值
闫洪超,韩正祥,许 君,于 楠,仝建业
(徐州医学院附属医院,江苏徐州221002)
卵巢上皮性癌(EOC)是女性三大恶性肿瘤之一,因其早期诊断困难,治疗效果不佳,故其病死率居妇科恶性肿瘤首位,严重威胁妇女的健康。由于EOC发病隐匿,大部分患者出现明显临床症状时已进入癌症中晚期,因此,早期诊断EOC是指导临床早期确定有效治疗方案的关键[1]。目前,CA125在EOC的早期诊断方面应用最广泛,但其敏感性和特异性相对较低[2]。近年研究发现,溶血磷脂酸(LPA)与卵巢癌的发生、发展密切相关[3]。为探讨血清CA125、LPA联合检测早期诊断EOC的临床价值,我们对EOC患者进行了血清CA125、LPA检测,并与交界性卵巢肿瘤、卵巢上皮性良性肿瘤患者及健康妇女进行比较。现报告如下。
1 资料与方法
1.1 临床资料 选择2011年1月~2013年3月在我院接受治疗的EOC患者59例(卵巢癌组),年龄26~73岁,其中浆液性囊腺癌39例、黏液性囊腺癌20例;交界性卵巢肿瘤患者19例(交界组),年龄27~69岁;卵巢上皮性良性肿瘤患者51例(良性组),年龄18~68岁。各组术前均未接受过激素类药物、放疗或化疗,均于术后经病理检查确诊。另选52例体检健康者作为对照组,年龄20~67岁。
1.2 方法
1.2.1 检测方法 各组术前(对照组查体时)均抽取空腹静脉血4 mL,l h内分离血清并置于-80℃保存,采用酶联免疫吸附试验检测其血清LPA,严格按美国Quidel公司提供的LPA试剂盒说明书操作。采用放射免疫分析法检测血清CA125,严格按美国雅培生物公司提供的试剂盒说明书操作。
1.2.2 统计学方法 采用SPSS13.0统计软件,计量资料用¯x±s表示,组间比较采用方差分析;计数资料用百分比表示,率的比较用χ2检验。P≤0.05为差异有统计学意义。
2 结果
2.1 各组血清CA125、LPA比较 卵巢癌组的血清CA125、LPA水平均明显高于交界组,交界组高于良性组及对照组(P均<0.05)。良性组与对照组比较无统计学差异 (P均>0.05)。见表1。
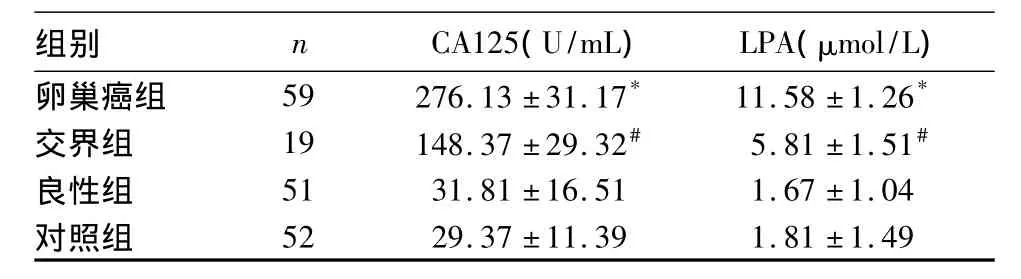
表1 各组血清CA125、LPA比较(¯x±s)
2.2 CA125、LPA单检及联合检测诊断EOC的敏感性和特异性 CA125诊断EOC的敏感性和特异性分别为 69.49%(41/59)、64.71%(33/51),LPA诊断EOC的敏感性和特异性分别为83.05%(49/59)、80.39%(41/51),CA125、LPA 联合检测的敏感性和特异性分别为为 91.52%(54/59)、88.23%(45/51)。
3 讨论
CA125是一种大分子量糖蛋白,是20世纪70年代发现的EOC细胞表达的一种癌抗原,约90%的EOC过表达CA125。CA125作为肿瘤标志物用于卵巢癌已有近30余年的历史,是卵巢癌生物标记物中发现最早、研究最明确的肿瘤标记物,并参与EOC 的筛查、疗效评价及疾病监测等[4,5]。血清CA125检测最初用于EOC诊断,之后扩展到治疗反应评价、预后评估与复发监测及筛查等。CA125在各种体腔源性上皮细胞中都有表达,分布于胸膜、心包、腹膜、子宫内膜、生殖道和羊膜等间皮组织细胞表面;除卵巢恶性肿瘤表达CA125外,子宫内膜异位、早期妊娠、炎症、子宫肌瘤、肾功能障碍及肝脏疾病等都伴有血清CA125表达升高,故其在早期卵巢癌诊断中的特异性和敏感性都不高[6,7]。因此,寻找能替代CA125的新的卵巢癌标志物对于卵巢癌筛查和诊断具有重要意义。
LPA是具有细胞间信号传导作用的脂类小分子物质,其通过G蛋白受体介导的多种信号传导通路发挥多种生物效应。LPA是近年来发现的具有生长因子样活性的脂质分子,它作为细胞间的多功能磷脂信使,通过G蛋白受体介导的多种信号途径发挥生物学效应,可诱导多种细胞发生增生性和形态学改变[8~11]。正常人血清LPA很低,卵巢癌患者的腹水及血清水平明显升高。因LPA能增强卵巢癌细胞的黏附、迁移和浸润,是卵巢癌的潜在标志物和治疗靶点,故有望成为卵巢癌早期诊断及卵巢肿瘤术前良恶性的鉴别指标之一[12,13]。鉴于目前诊断EOC尚无敏感度和特异性均很高的单一指标,故联合检测越来越为国内外学者所关注。本研究显示,EOC患者的血清CA125、LPA明显高于交界性卵巢肿瘤患者,交界性卵巢肿瘤患者明显高于卵巢上皮性良性肿瘤患者及健康妇女,故二者联合检测诊断EOC具有较好的临床价值。本研究结果显示,CA125诊断EOC的敏感性和特异性分别为69.49%、64.71%,LPA 诊断 EOC 的敏感性和特异性分别为83.05%、80.39%,两者联合检测的敏感性和特异性分别为91.52%、88.23%;表明联合检测CA125、LPA可提高诊断EOC的敏感性和特异性,说明二者联合检测在提高EOC检出率及辨别肿物良恶性方面具有较高的临床价值,为及时诊断或早期筛查提供了新的方向。
综上所述,除血清CA125外,血清LPA可能成为临床诊断EOC的重要生物学指标,且二者联合检测对早期诊断EOC具有较高的临床价值,可能是早期诊断EOC的最佳联合检测指标之一。
[1]Pignata S,Cannella L,Leopardo D,et al.Chemotherapy in epithelial ovarian cancer[J].Cancer Lett,2011,303(2):73-83.
[2]Alexandre J,Brown C,Coeffic D,et al.CA-125 can be part of the tumour evaluation criteria in ovarian cancer trials:experience of the GCIG CALYPSO trial[J].Br J Cancer,2012,106(4):633-637.
[3]Goldsmith ZG,Ha JH,Jayaraman M,et al.Lysophosphatidic acid stimulates the proliferation of ovarian cancer cells via the gep protooncogene Gα(12)[J].Genes Cancer,2011,2(5):563-575.
[4]Lutz AM,Willmann JK,Drescher CW,et al.Early diagnosis of ovarian carcinoma:is a solution in sight[J].Radiology,2011,259(2):329-345.
[5]Grisham RN,Berek J,Pfisterer J,et al.Abagovomab:an anti-idiotypic CA-125 targeted immunotherapeutic agent for ovarian cancer[J].Immunotherapy,2011,3(2):153-162.
[6]Verheijen RH,Cibula D,Zola P,et al.Council of the european society of gynaecologic oncology.Cancer antigen 125:lost to follow-up:a european society of gynaecological oncology consensus statement[J].Int JGynecol Cancer,2012,22(1):170-174.
[7]van Nagell JR Jr,Pavlik EJ.Ovarian cancer screening[J].Clin Obstet Gynecol,2012,55(1):43-51.
[8]Pradère JP,Gonzalez J,Klein J,et al.Lysophosphatidic acid and renal fibrosis[J].Biochim Biophys Acta,2008,1781(9):582-587.
[9]Rivera R,Chun J.Biological effects of lysophospholipids[J].Rev Physiol Biochem Pharmacol,2008,160(1):25-46.
[10]Mutoh T,Chun J.Lysophospholipid activation of G protein-coupled receptors[J].Subcell Biochem,2008,49(2):269-297.
[11] Noguchi K,Herr D,Mutoh T,et al.Lysophosphatidic acid(LPA)and its receptors[J].Curr Opin Pharmacol,2009,9(1):15-23.
[12]Pua TL,Wang FQ,Fishman DA.Roles of LPA in ovarian cancer development and progression[J].Future Oncol,2009,5(10):1659-1673.
[13] Sedláková I,Vávrová J,Tošner J,et al.Lysophosphatidic acid(LPA)-a perspective marker in ovarian cancer[J].Tumour Biol,2011,32(2):311-316.

