SSc-PF小鼠肺组织和外周血中Th2细胞水平、IL-10表达变化及意义
李 宇,张建全,钟小宁,雷 玲,谢佳峻
(广西医科大学第一附属医院,南宁530021)
系统性硬化病(SSc)是一种病因不明,以局限性或弥漫性皮肤增厚和纤维化为特征,可影响内脏包括心、肺和消化道器官的全身性疾病。其49.4%~90.0%的患者会出现肺纤维化(PF),在各种结缔组织中发生率最高,也是病死率增加的一个重要原因[1]。目前,对SSc-PF起始和持续的发病机制仍未完全清楚,尚无有效措施预防或逆转疾病的进程。Th2细胞是重要的促纤维化细胞,以分泌IL-4、IL-10为特征,可促进成纤维细胞活化、增生,最终导致特发性PF形成[2]。2012年 5~12月,我们观察了SSc-PF小鼠肺组织及外周血Th2细胞水平和IL-10表达变化,并探讨其意义。
1 材料与方法
1.1 材料 实验动物:雌性 BALB/c小鼠30只,SPF级,6周龄,体质量20 g,由广西医科大学实验动物中心提供,正常饲养。药品与试剂:注射用盐酸博莱霉素(BLM,日本化药株式会社生产,批号491240,15 mg/支),羟脯氨酸(HYP)测试盒(南京建成生物工程研究所),小鼠ELISA检测试剂盒(武汉博士德生物工程有限公司),DNA纯化试剂盒(上海生工生物工程技术服务有限公司),Trizol试剂(美国Invitrogen公司),逆转录试剂盒(加拿大MBI Fermentas公司),PCR试剂和引物(日本TaKaRa公司)。
1.2 方法
1.2.1 分组与造模 将小鼠分成3组,A组10只小鼠背部中央区皮下注射PBS作为对照,20只采用BLM皮下局部注射法[3]建立SSc模型,根据PF半定量评分将模型组分为B组(PF≥3分)11只和C组(PF<3分)9只。
1.2.2 标本采集 小鼠通过眶后动脉放血处死,收集外周血1.0 mL,以4 000 r/min 离心 15 min,吸取上层血清,用于检测血清IL-10。用肝素抗凝管收集小鼠外周血1.5 mL,PBS重悬,用于分离得到外周血单个核细胞(PBMC)。剪下小鼠背部无毛皮肤并分成2份,一份用于检测羟脯氨酸(HPY)含量,一份投入10%中性甲醛溶液中固定、脱水、石蜡包埋,制成4μm厚切片进行病理观察。打开小鼠胸腔,取出左肺上叶迅速移至-80℃冰箱保存,用于荧光定量PCR检测;左肺下叶分2份,一份用10%中性甲醛溶液固定、脱水、石蜡包埋,制成4μm厚的切片进行病理观察,另一份用于检测HYP的含量。右肺用于提取单个核细胞(MC)。
1.2.3 皮肤、肺部炎症及纤维化观察 皮肤及肺组织切片做Masson和HE染色,用病理图像分析仪系统软件测量皮肤厚度[4]。皮肤和肺部炎症评分:0分没有,1分少许,2分轻度,3分中度,4分重度。由2位病理科医生随机选取左下肺组织切片区域进行单独阅片,观察非重复的10个视野,放大200倍,进行Ashcroft半定量PF评分。
1.2.4 HYP测定 采用样本碱水解法,精确称取肺组织和皮肤50 mg放入试管中;加入水解液1 mL,混匀,95 ℃水浴 30 min,调整 pH 6.0 ~6.8;加入适量活性炭,充分混匀,离心,取1 mL进行检测;在波长550 nm处检测吸光度(A)值,然后换算成HYP含量(μg/mg)。
1.2.5 肺组织及外周血Th2细胞检测 取出右肺,根据参考文献[5]提取肺组织中的MC。PBMC采用Ficoll-泛影钠不连续密度梯度离心法分离得到。采用美国BD公司四色荧光流式细胞仪检测CD+4IL-4+Th2细胞,Cell Quest流式分析软件进行分析。
1.2.6 肺组织IL-10 mRNA检测 采用荧光定量PCR法。取小鼠左肺下叶肺组织100 mg,用Trizol法提取总RNA进行逆转录反应。胶回收纯化DNA片段作为标准品,β-肌动蛋白作为内参照,SYBR绿色Ⅰ核酸凝胶染料进行荧光定量PCR检测。各引物序列:β-肌动蛋白上游引物为 5'-ATCCACGAAACTACCTTCAA-3',下游引物为5'-CCAAATTGTATTGCAGATGTTCCAC-3',扩增产物 200 bp;反应条件:94 ℃ 20 s,57.5 ℃ 30 s,72 ℃ 31 s,40 个循环;IL-10上游引物为5'-CCATGGCCCAGAAATCAAGG-3',下游引物为5'-TCTTCACCTGCTCCACTGCC-3',扩增产物129 bp;反应条件:95℃ 30 s,58℃ 30 s,72℃ 30 s,40个循环。采用标准曲线法计算mRNA相对表达量,将IL-10 mRNA与β-肌动蛋白mRNA相对表达量的比值为其mRNA表达量校正值,经均一化处理后得出其相对量。所有样本均设置3个复孔。
1.2.7 外周血IL-10检测 采用ELISA法,操作按试剂盒说明书进行。
1.2.8 统计学方法 采用SPSS13.0统计软件。正态分布的计量资料用¯x±s表示,组间比较采用方差、秩和和t检验分析;相关性检验用Spearman相关分析法。P≤0.05为差异有统计学意义。
2 结果
2.1 皮肤和肺组织病理观察 A组小鼠背部注射部位皮肤和肺组织结构完整,无明显的炎症细胞浸润和胶原纤维增生;B、C组小鼠皮肤明显增厚,胶原纤维明显增生,附属器萎缩及大量炎症细胞浸润;见插页Ⅰ图2。B组肺部结构明显破坏,可见大量淋巴细胞为主的炎症细胞浸润,并且有肺泡、肺间质及支气管壁中度以上纤维性增厚或者有纤维束的形成;C组肺部结构无明显破坏,肺泡、肺间质及支气管壁无或仅有少量纤维性增厚。各组小鼠皮肤、肺部病理及HYP水平比较,见表1。
表1 各组小鼠皮肤、肺部病理及HYP水平比较±s)

表1 各组小鼠皮肤、肺部病理及HYP水平比较±s)
注:与 A 组比较,*P <0.01;与 C 组比较,#P <0.01
组别 n 皮肤厚度(μm)炎症评分(分)HYP(μg/mg)皮肤 肺部A 组 10 40.77 ±12.66 0.40 ±0.52 0.40 ±0.52 0.60 ±0.7皮肤 肺部PF评分(分)0 1.45 ±0.40 0.38 ±0.16 B 组 11 97.87 ±22.02* 2.82 ±0.75* 2.36 ±0.81*# 4.00 ±1.41*# 3.07 ±1.26* 0.64 ±0.08*#C 组 9 91.73 ±15.33* 2.44 ±0.73* 1.33 ±0.50* 1.50 ±0.76* 2.43 ±0.61*0.45 ±0.08
2.2 各组小鼠外周血、肺组织中Th2细胞比例和IL-10水平比较 见表2。
表2 各组小鼠外周血、肺组织中Th2细胞比例和 IL-10 水平比较( ±s)
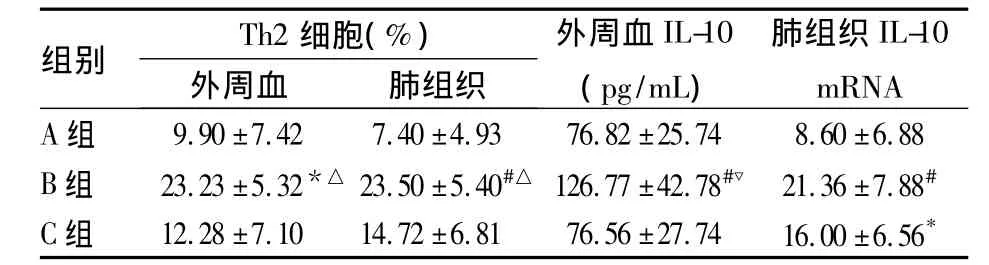
表2 各组小鼠外周血、肺组织中Th2细胞比例和 IL-10 水平比较( ±s)
注:与 A 组比较,*P <0.05,#P <0.01;与 C 组比较△P <0.05,▽ P <0.01
组别 Th2细胞(%)肺组织IL-10外周血 肺组织外周血IL-10(pg/mL)mRNA A组9.90 ±7.42 7.40 ±4.93 76.82 ±25.74 8.60 ±6.88 B 组 23.23 ±5.32*△ 23.50 ±5.40#△ 126.77 ±42.78#▽ 21.36 ±7.88#C 组 12.28 ±7.10 14.72 ±6.81 76.56 ±27.74 16.00 ±6.56*
2.3 各指标的相关关系 PF、肺部炎症评分与皮肤厚度、炎症评分呈正相关(r分别为0.687、0.791,P均<0.05),外周血、肺部Th2细胞与肺部炎症、HYP、PF 评分呈正相关(r分别为 0.586、0.535、0.595和0.538、0.423、0.581,P 均 < 0.05)。IL-10 mRNA在肺组织的表达量与肺部炎症、HYP、PF评分呈正相关(r分别为 0.532、0.460、0.474,P 均 <0.05),血清IL-10水平与肺部炎症、HYP、PF评分呈正相关(r分别为 0.387、0.461、0.410,P 均 <0.05)。肺部Th2细胞与肺部IL-10 mRNA、外周血IL-10 水平呈正相关(r分别为 0.517、0.363,P 均 <0.05),外周血Th2细胞与肺部IL-10 mRNA呈正相关(r=0.444,P <0.05)。
3 讨论
小鼠背部皮下局部注射BLM,导致小鼠局部皮肤硬化并出现PF,产生自身抗体,且组织纤维化和自身抗体的产生与CD+4T细胞激活有关,这一模型很好地模拟了人类SSc-PF的主要特征[3]。本研究使用BLM在小鼠背部皮肤局部注射,与对照组比较,B、C组小鼠皮肤明显增厚,HYP、皮肤炎症明显增多;且B组小鼠出现肺部结构明显破坏,肺泡、肺间质和支气管壁纤维不同程度增厚,肺部炎症和纤维化评分、HYP较A、C组明显增多。提示造模后小鼠皮肤和肺部出现炎症与纤维化病变特征,成功再现了SSc继发性PF的模型。随着皮肤厚度和炎症加重,肺部炎症和纤维化程度也越来越重。
PF是由多种病因引起的慢性、间歇性和广泛的肺部疾病,其主要病理特点是弥漫性肺泡炎,肺间质纤维细胞增殖,大量细胞外基质积聚,肺泡结构紊乱和PF[6]。T细胞在PF发病机制中起到重要作用。一些研究表明,Th2细胞及其细胞因子对于PF起主要调节作用。Th2细胞及其细胞因子促进肺、皮肤等多种器官的纤维母细胞滋生和细胞外基质产生,加强胶原蛋白、纤连蛋白及肌腱蛋白的合成等[2];此外,IL-4还是成纤维母细胞强有力的趋化因子。有实验表明,抗氧化转录因子Nrf2通过调节肺氧化水平和转移Th1/Th2细胞间的平衡诱导Th1细胞反应,可以防止BLM致PF[7]。本研究发显示,与A组比较,B组小鼠外周血和肺部CD+4IL-4+Th2细胞数明显增多,且与肺部炎症评分、肺部HYP含量呈正相关,提示Th2细胞参与SSc-PF的发病,可能在PF病变中起促进作用。另外,有研究显示Th2细胞通过促进成纤维细胞活化、增生,使胶原蛋白合成增加,并且能够抑制其降解,导致基质蛋白沉积和纤维组织生成,最终形成纤维化[7]。
本研究显示,B、C组小鼠肺部IL-10 mRNA和B组外周血IL-10水平较A组明显增高,且肺部IL-10 mRNA表达量、血清IL-10水平与肺部炎症与纤维化评分、肺部 HYP 显著正相关。Barbarin 等[8,9]在PF小鼠模型中发现过度表达的IL-10可加重肺纤维化,且IL-10通过激活Th2型细胞因子,增加IL-4、IL-13等表达,促进PF形成[10]。动物实验研究也证实,IL-10可能通过CCL2/CCR2轴促使纤维细胞聚集和巨噬细胞活化最终导致PF[11]。最近研究表明,IL-10 主要通过上调 TGF-β1、IL-4、IL-13 等表达参与PF发病,这些都提示IL-10在SSc-PF中扮演重要角色。在Th0细胞分化过程中,IL-10可抑制Th0细胞向Th1细胞分化,诱导其向Th2细胞分化,且Th2也能产生IL-10。本研究发现,Th2与IL-10呈正相关,推测IL-10的增高可能与Th2增高有关,两者在SSc-PF发病中可能起促进作用。
总之,Th2细胞和IL-10在SSc-PF小鼠模型外周血、肺组织表达增高,且与肺部炎症和纤维化呈正相关,两者可能促进SSc-PF发病,抑制Th2细胞及其相关的细胞因子将有可能成为未来治疗SSc-PF的靶点。
[1]Steen VD,Medsger TA.Changes in causes of death in systemic sclerosis,1972-2002[J].Ann Rheum Dis,2007,66(7):940-944.
[2]Barrett NA,Austen KF.Innate cells and Thelper 2 cell immunity in airway inflammation[J].Immunity,2009,31(3):425-437.
[3]Ishikawa H,Takeda K,Okamoto A,et al.Induction of autoimmunity in a bleomycin-induced murine model of experimental systemic sclerosis:an important role for CD+4T cells[J].JInvest Dermatol,2009,129(7):1688-1695.
[4]Fineschi S,Bongiovanni M,Donati Y,et al.In vivo investigations on anti-fibrotic potential of proteasome inhibition in lung and skin fibrosis[J].Am JRespir Cell Mol Biol,2008,39(4):458-465.
[5]D'hulst AI,Vermaelen KY,Brusselle GG,et al.Time course of cigarette smoke-induced pulmonary inflammation in mice[J].Eur Respir J,2005,26(2):204-213.
[6]Raghu G,Collard HR,Egan JJ,et al.An official ATS/ERS/JRS/ALAT statement:idiopathic pulmonary fibrosis:evidence-based guidelines for diagnosis and management[J].Am J Respir Crit Care Med,2011,183(6):788-824.
[7]Kikuchi N,Ishii Y,Morishima Y,et al.Nrf2 protects against pulmonary fibrosis by regulating the lung oxidant level and Th1/Th2 balance[J].Respir Res,2010,(11):31.
[8]Barbarin V,Xing Z,Delos M,et al.Pulmonary overexpression of IL-10 augments lung fibrosis and Th2 responses induced by silica particles[J].Am J Physiol Lung Cell Mol Physiol,2005,288(5):1841-1848.
[9]Barbarin V,Nihoul A,Misson P,et al.The role of pro-and antiinflammatory responses in silica-induced lung fibrosis[J].Respir Res,2005,(6):112
[10]Haase MG,Klawitter A,Geyer P,et al.Expression of the immunomodulator IL-10 in type I pneumocytes of the rat:alterations of IL-10 expression in radiation-induced lung damage[J].J Histochem Cytochem,2007,55(11):1167-1172.
[11]Sun L,Louie MC,Vannella KM,et al.New concepts of IL-10-induced lung fibrosis:fibrocyte recruitment and M2 activation in a CCL2/CCR2 axis[J].Am JPhysiol Lung Cell Mol Physiol,2011,300(3):341-353.

