制备去细胞髓核支架最佳条件的初步优化研究
张 朋,曹 纬,周初松,吕 海,蔡进奎,陈 仲
腰椎椎间盘退变突出是脊柱外科常见疾病,通过制备具有天然三维结构的髓核基质支架来构建组织工程化髓核,可能有助于改变目前主要通过摘除髓核并内固定手术治疗的模式[1-3]。到目前为止,髓核组织工程支架材料在物理性能、生物性能与正常髓核相比仍有较大的差距,尚无与髓核结构高度相似且理化性能相近的支架材料。为此,本实验试图研究机械振荡及去污剂浓度对髓核脱细胞程度及其基质形态学变化的影响[4],探讨制备髓核去细胞支架的方法,为构建具有天然髓核基质结构的组织工程化髓核提供实验依据。
1 材料与方法
1.1 实验动物和器材
新西兰兔(南方医科大学动物实验中心),Triton X-100(Amresco),PBS 缓冲液、HE 染色试剂、脱氧胆酸钠[罗基(北京)生物技术有限公司],恒温回旋振荡器(南方医科大学附属南方医院中心实验室),扫描电镜(南方医科大学药学院实验室)。
1.2 兔髓核的来源
健康成年兔,雌雄不限,重2~3 kg。采用空气栓塞的方法将兔处死。然后行兔后背正中切口暴露并游离相应椎间盘、取出髓核。每段长约0.5 cm,分为7 个组,每组5 块,行脱细胞处理或作为空白对照,其中2 块用于石蜡切片,2 块用于扫描电镜观察。
1.3 髓核的预处理和化学萃取
先在手术显微镜下去除非髓核组织,然后进行萃取处理。A、B、C、D 4 组的萃取振荡频率分别0、80、130、180 r/min,C1、C2、C3 组的去污剂浓度分别为1%、3%、5%,其余各组的浓度均为3%。E 组为对照组,不作处理。萃取步骤:①浸入去离子水中浸泡12 h[5];②将髓核分别放入相应浓度Triton X-100 的PBS 溶液中。室温振荡萃取12 h;③用PBS 溶液漂洗3 次,每次45 min,并用去离子水漂洗2 次,每次1 h;④放入相应浓度的脱氧胆酸钠PBS 溶液中室温振荡萃取24 h[5];⑤PBS 溶液漂洗3 次,每次45 min,并用去离子水漂洗2 次,每次1 h;⑥重复1~5 操作步骤1次;⑦萃取后的髓核置4℃无菌PBS 溶液(PH 7.4,无钙镁)中保存备用。
1.4 观察
大体观察:观察各组标本的外形、色泽、透明度等情况。
HE 染色:用10%的福尔马林溶液固定,切片后行HE 染色。在光学显微镜下观察髓核内细胞清除是否完全及基质纤维的结构变化。
扫描电镜:观察采用25 g/L 的戊二醛和锇酸固定。经干燥和表面喷金后贴片行扫描电镜观察。
2 结 果
2.1 去细胞髓核支架的大体观察
肉眼观,新鲜兔髓核(E 组)柔软,半透明,成胶冻状,形态不固定。经去离子水浸泡1 h 后,明显肿胀;浸泡中的髓核外围部分可见明显细丝状突出,呈絮状物,透明程度明显增加(见图1a,b)。A 组、B组、C1 组经去污剂萃取后,去细胞髓核在无离子水中呈絮状物,外围带少量灰白色丝状突出;取出后呈半透明状,体积较新鲜髓核(E 组)组织稍变小(见图1c~e)。C2 组经去污剂萃取后,去细胞采集在无离子水中呈絮状物,外围带有多量灰白色丝状突出,丝状物直径变小、变扁;髓核取出后呈半透明状(见图1f)。C3 组与D 组去细胞髓核明显破损,丝状物断裂、脱落,更加不规则;取出后髓核的透明程度增加,但与新鲜髓核(E 组)相比,形态散乱、总体积变小(见图1g,h)。
2.2 去细胞髓核支架的显微结构观察
2.2.1 HE 染色切片观察

图1 髓核去细胞支架大体观察Fig.1 Microscopic appearance of the accellular nucleus pulposus scaffold
新鲜髓核(E 组)层次分明,结构紧密,整个髓核视野内均可见大量细胞结构,细胞边界清楚,胞浆和周围的纤维结缔组织红染。结缔组织彼此交联,境界清晰、锐利,呈均匀分布的网状结构(见图2a)。髓核经去污剂萃取后,着色较淡,A、B、C、D 各组的髓核内的细胞基本清除或者残存部分脱核细胞残株,可见大量无细胞核的“空泡状”结构。A 组、B 组和C1 组髓核内细胞清除不完全,可见较多胞浆红染的脱核的细胞残株,可见大量成束分布的基质纤维,形态不规则,彼此交织成网状,可见数个蓝染的核物质颗粒(见图2b~d);C2 组髓核内细胞清除非常完全,层次结构消失,未见细胞结构残留及蓝染核物质颗粒,仅可见网状排列的淡红色基质纤维结构(见图2e);C3 组和D 组与C2 组镜下观相似,但髓核外基质纤维结构紊乱,网状结构不清晰,有较明显损害(见图2f,g)。
2.2.2 扫描电镜观察
正常髓核组织(E 组)可见大量髓核细胞,形态为圆形或者椭圆形(见图3a);细胞外基质纤维清晰可见,排列成交织的三维空间网状结构(见图3b)。A 组、B 组及C1 组去细胞髓核内基质纤维结构清晰,呈网状排列的细胞外基质纤维间残存大量脱核的细胞残株碎片(见图3c~e)。C2 组经去污剂萃取后,髓核内细胞几乎完全消失,视野内由网状排列的细胞外基质纤维构成,可见基质纤维呈纵行、横行交织排列成网格状(见图3f)。C3 组和D 组脱细胞髓核内未见细胞结构,细胞外基质纤维亦呈网状结构,但是结构紊乱,其三维空间结构塌陷,其纤维条的直径未见明显变化,但可见较多的基质纤维扭曲和断裂(见图3g,h)。
3 讨 论
以支架材料进行动物椎间盘退变(以髓核组织为主)修复的报道较多,但治疗或者逆转椎间盘退变的疗效尚未获得实质性的突破,其中原因之一可能是缺乏天然的与髓核细胞生长环境高度一致的支架材料,影响了髓核细胞的增殖、分化进程[6]。理想的去细胞髓核支架应保留天然的髓核基质纤维骨架,且去除细胞等主要抗原成分,消除引起免疫反应的主要因素,为植入细胞的存活、增殖、分化提供良好的细胞微环境。近年来,有关新的理化方法制备脱细胞基质材料以及除垢工艺的进展,为进一步提高脱细胞基质材料的制备工艺及质量提供了新的思路。国内已有非髓核组织脱细胞方法的研究报道,本研究运用文献[7-8]所用脱细胞方法,并加以改进,采用Triton X-100 和脱氧胆酸钠联合脱细胞。Triton X-100 属于非离子型表面活性剂,在溶液中稳定性高,能与生物膜中的磷脂等脂质结合形成可溶性复合物。Triton X-100 中的疏水端也能和膜蛋白的疏水区结合形成复合物,溶解于溶液中。因此Triton X-100 能彻底破坏生物膜,从而使细胞溶解破坏,使细胞内的成分充分释放出来,达到去除髓核细胞成份的目的。脱氧胆酸钠为阴离子去垢剂,即阴离子型表面活性剂,是一种效力较强的化学消化剂,可进一步破坏细胞,并消化降解细胞碎片。非离子型去污剂在保存外基质方面效果较好,阴离子型和阳离子型去污剂在去除细胞方面效果较好。为此,本实验在前人去污剂萃取方法的基础上加以改进,观察在不同的机械振荡频率及不同去污剂浓度的作用下,髓核去细胞程度及其基质结构的破坏程度,探讨髓核去细胞支架的制备方法[9-10]。
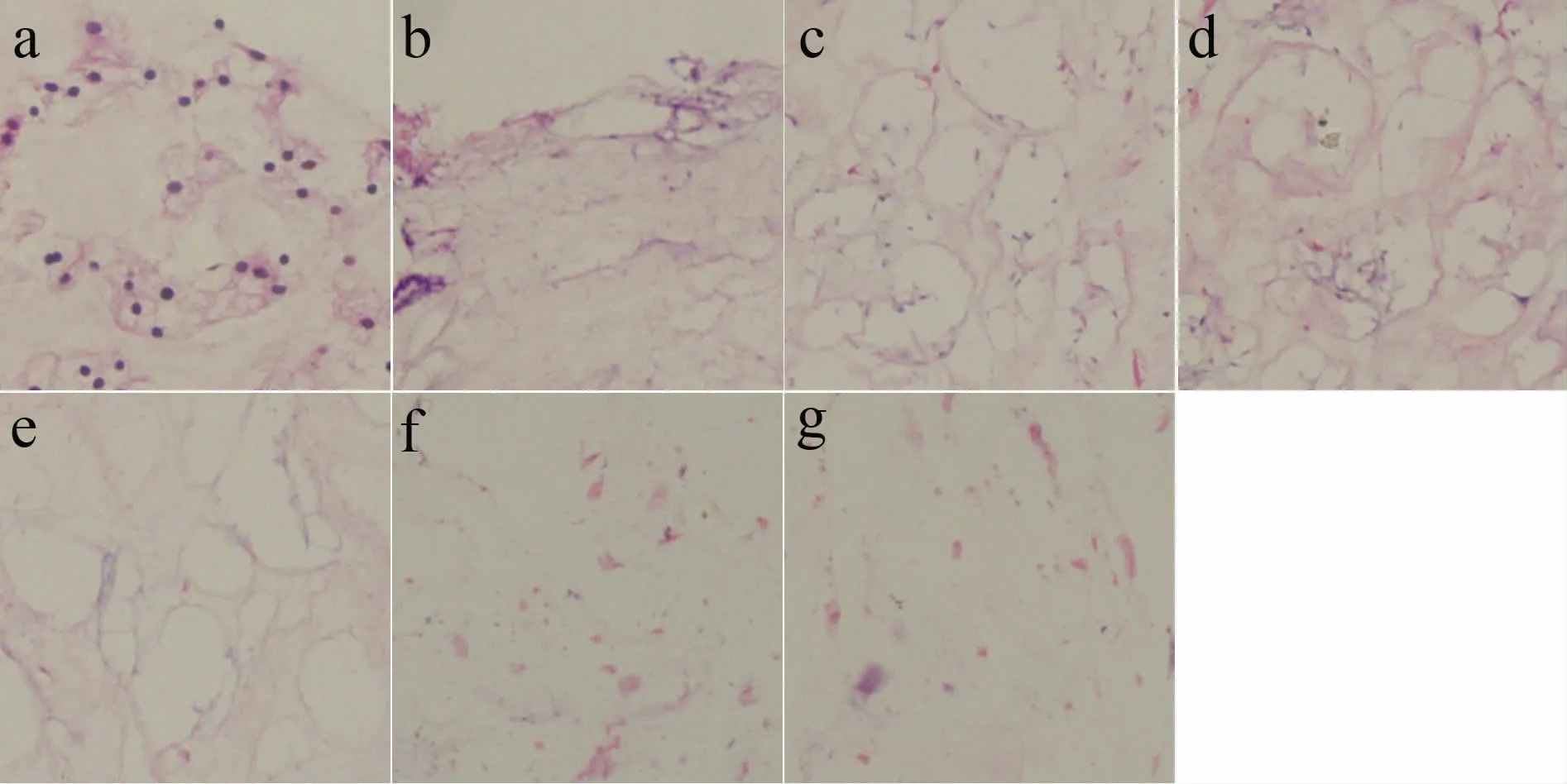
图2 髓核去细胞支架石蜡切片(HE 染色,×20)Fig.2 Microscopic appearance of the accellular nucleus pulposus scaffold (HE staining,×20)
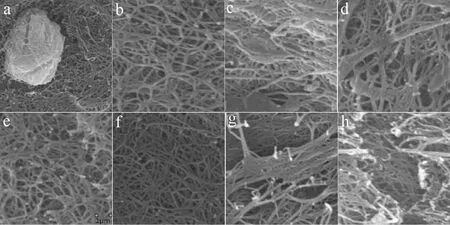
图3 髓核去细胞支架的扫描电镜图(b-h×10 000,a×5 000)Fig.3 Morphology of the acellular nucleus pulposus observed by acsnning electron microscope (b-h×10 000,a×5 000)
本实验是在去离子水浸泡、给予低渗环境轻度破坏髓核细胞的基础上,设计使用不同浓度的Triton X-100与脱氧胆酸钠在不同震荡频率条件下联合脱细胞,发挥两者高效脱细胞的优势,增加脱细胞的效率,对处理后的支架材料做大体观察、扫描电镜、组织学观察,探索去污剂法最佳的适合髓核脱细胞方案。研究表明,应用体积分数为3% Triton X-100与3%的脱氧胆酸钠在130 r/min 的转速条件下,可以将髓核细胞较彻底清除,且较完好地保留髓核组织的天然网状结构。
化学萃取制备髓核去细胞支架的原则主要去除细胞等主要抗原物质的同时,尽可能保留基质的三维空间结构。目前尚未见用去污剂对髓核组织进行脱细胞制备天然支架的相关报道。Sondell 等[4]用Triton X-100和脱氧胆酸钠成功制备大鼠坐骨神经去细胞支架,清除了神经组织内所有细胞成分,保留了细胞外基质支架成分。
使用去污剂制备去细胞支架的效果主要取决于选择合适的去污剂,此外,去污剂浓度、萃取温度、时间以及机械振荡也是影响去细胞效果的因素。本实验组借鉴Sondell 等[4]的化学萃取法并加以改进,且附加了不同频率的机械振动以及不同浓度的去污剂。实验结果表明在去污剂体积分数为3%的条件下,当机械振动频率为0 或者80 r/min 时,经脱细胞处理的支架中仍有大量细胞或者细胞沉淀物残留。当机械振荡频率为130r/min 时,髓核内细胞成分清除彻底,且支架的外基质成分形态在大体及镜下皆保持良好,无明显损毁。但是振动频率增大为180r/min 时,髓核内细胞虽然清除彻底,但髓核已明显破损,镜下可见基质纤维排列紊乱,出现明显的断裂,基质纤维的三维空间存在较严重的破坏。由此得出:①在无机械振荡或振荡频率比较低时,髓核细胞可以被清除,但是清除率有限;②在一定频率范围内,适宜的机械振荡频率可以促进髓核内细胞成分的清除,这可能与髓核组织结构疏松、细胞间连结松散有直接关系,而且去污剂在髓核组织中扩散,利于其发挥脱细胞作用,但过强的振动频率则会对细胞外基质的三维结构造成一定破坏[11];③适当的去污剂浓度既有利于髓核细胞的清除,同时也不会对基质的三维网状结构造成破坏;但是浓度过低髓核细胞清除不彻底,浓度过高则同样会对髓核外基质三维网状结构造成破坏。
综上所述,去污剂的浓度及机械震荡是影响髓核去细胞支架制备效果的重要因素,适当的机械震荡频率以及合理的去污剂浓度有利于彻底去除髓核细胞等抗原成分,且有利于保存髓核外基质的三维基质结构,为植入细胞的存活、增殖、分化以及细胞外基质的再生提供高度仿生的三维空间微环境。为构建理想的组织工程化髓核仍需进一步进行免疫组织相容性[12-13]等方面的研究。
[1]Liu C,Xia Z,Czernuszka JT.Design and development of threedimensional scaffolds for tissue engineering[J].Chem Eng Resand Des,2007,85(A7):1051-1064.
[2]Chadderdon RC,Shimer AL,Gilbertson LG,et al.Advances in gene therapy for intervertebral disc degeneration[J].Spine J,2004,4(6 Suppl):341-347.
[3]Nomura T,Mochida J,Okuma M,et al.Nucleus pulposus allograft retards intervertebral disc degeneration[J].Clin Orthop Relat Res,2001(389):94-101.
[4]Scondell M,Lundborg G,Kanje M.Regeneration of the rat sciatic nerve into allografts made acellular through chemical extraction[J].Brain Res,1998,795(1-2):44-54.
[5]李康杰,孙抒.去除移植免疫反应抗原成分脱细胞天然骨基质的制备[J].中国组织工程研究与临床康复,2011,15(8):1355-1359.
[6]Sell S,Barnes C,Smith M,et al.Extracellular matrix regenerated:tissue engineering via electrospun biomimetic nanofibers[J].Polym Int,2007,56(11):1349-1360.
[7]Hudson TW,Liu SY,Schmidt CE.Engineering an improved acellular nerve graft via optimized chemical processing[J].Tissue Eng,2004,10(9-10):1346-1358.
[8]Hudson TW,Zawko S,Deister C,et al.Optimized acellular nerve graft is immunologically tolerated and supports regeneration[J].Tissue Eng,2004,10(11-12):1641-1651.
[9]Falke G,Yoo JJ,Kwon TG,et al.Formation of corporal tissue architecture in vivo using human cavernosal muscle and endothelial cells seeded on collagen matrices[J].Tissue Eng,2003,9(5):871-879.
[10]Freytes DO,Badylak SF,Webster TJ,et al.Biaxial strength of multilaminated extracellular matrix scaffolds[J].Biomaterials,2004,25(12):2353-2361.
[11]Yin WH,Jin DD,Deng XY,et al.Effects of mechanical vibration on the morphology of the acellular scaffold for the spinal cord[J].Nan Fang Yi Ke Da Xue Xue Bao,2008,28(10):1748-1751.
[12]许国华,叶晓健,袁文,等.纳米氧化锆磷酸钙骨支架体内免疫及相容性研究[J].脊柱外科杂志,2007,5(5):302-304.
[13]吕宏,施杞,王拥军,等.兔成骨细胞与纳米氧化锆强韧化高孔隙率磷酸钙人工骨细胞支架生物相容性研究[J].脊柱外科杂志,2004,2(4):209-212.

