鸡马立克氏病发生与细胞内HSP70 mRNA转录水平相关性研究
裴兰英 (聊城大学农学院 山东 聊城 252059)
王俊海 (山东省聊城市畜牧站)
田中杰 (河南出入境检验检疫局 郑州)
鸡马立克氏病发生与细胞内HSP70 mRNA转录水平相关性研究
裴兰英 (聊城大学农学院 山东 聊城 252059)
王俊海 (山东省聊城市畜牧站)
田中杰 (河南出入境检验检疫局 郑州)
通过人工攻毒建立鸡马立克氏病肿瘤模型。利用荧光定量RT-PCR方法,研究肿瘤发生、发展过程中,HSP70mRNA转录水平的变化。结果显示:攻毒21d后,试验鸡肝脏和脾脏内HSP70mRNA的转录水平极显著升高,而疫苗组和空白组鸡肝脏和脾脏内HSP70mRNA的转录水平差异不显著(P>0.05)。
马立克氏病 RT-PCR HSP70mRNA 转录
恶性肿瘤已成为导致我国城乡居民因病死亡的一个重要原因。对肿瘤发生的机理和防治措施的研究是近现代医学界科研工作的热点和难点。HSP(Heat Shock Protein)是生物圈中最为保守的蛋白分子之一,近年来研究发现,HSP在肿瘤的发生、发展及转移过程中发挥着重要作用[1,2,3]。对临床病例及肿瘤细胞体的研究表明,发生肿瘤时,HSP的表达量发生剧烈变化,同时,有研究表明
HSPs对肿瘤细胞的生长和存活起重要作用[4]。但有关肿瘤的发生发展与HSPs mRNA转录、表达水平之间的动态相关性未见报道。本试验通过人工攻毒的方式,建立鸡马立克氏病动物模型,定期剖杀试验用鸡,采取动物组织,利用荧光定量RT-PCR方法,动态研究肿瘤发生、发展与HSP70mRNA转录水平之间的相关性,为探索HSPs作为肿瘤发生的预警作用提供理论基础,同时为深入研究HSPs在肿瘤发生、发展过程中的作用奠定基础。
1 材料与方法
1.1 试验动物和试剂
1.1.1 试验动物 200只1日龄SPF来杭鸡由聊城某SPF鸡场提供。在温控实验动物房条件下进行常规饲养,试验鸡由专人饲养管理。
1.1.2 主要试剂 AMV(D2620)、HS-Taq(DR007A)、Ribonuclease Inhibitor(D2310A)、RNA Marker(D508A)、DNA Marker(D501A)、DNase I(RNase Free,D2215)、Nde I(D1161A)均购自宝生物工程(大连)有限公司;SYBR Green I染料购自上海开放科技有限公司产品;pGEM-T载体系统试剂盒(A3610)、体外转录系统试剂盒(P1440)购自美国Promega公司产品;胶回收(小量)试剂盒购自上海华舜生物工程有限公司;iCycler iQTM荧光实时多波长PCR检测系统,美国Bio-Rad公司产品。MD强毒由聊城大学农学院实验室分离并保存。
1.2 试验方法
1.2.1 试验分组及取样 将200只1日龄SPF来杭鸡分为A、B、C 3组,其中A组为攻毒组,100只试验鸡,1日龄攻毒MDV 0.2ml/只;B组为疫苗对照组,50只试验鸡,1日龄防疫MD疫苗;C组为空白对照组,50只试验鸡。各组隔离饲养,分别在21、28、35、42、49日龄分5批进行剖杀,采取肝脏和脾脏,液氮保存。
1.2.2 一步法RT-PCR 将组织样品在液氮存在的条件下进行研磨,利用Trizol试剂提取样品组织总RNA,作为模板进行RT-PCR反应,扩增HSP70和GAPDH片段,其中GAPDH片段作为内参照。引物根据文献[5]进行设计,由大连TaKaRa公司合成。HSP70上游引物:5'-AGCGTAAC ACCACCATTCC-3',下游引物:5'-TGGCTCCCACCCTA TCTC-3';GAPDH上游引物:5'-TGAAAGTCGGAGTCA ACGGAT-3',下游引物:5'-ACGCTCCTGGAAGATAGT GAT-3'。根据设计引物,将得到GAPDH 230bp和HSP70372bp的片段。扩增两段DNA片段的PCR条件相同:42℃反转录50min,95℃预变性5min,94℃30s,58℃30s,72℃30s,30个循环,72℃延伸8min。反转录PCR产物作1.5%琼脂糖凝胶电泳分析。
1.2.3 RT-PCR扩增片段的亚克隆 将GAPDH和HSP70扩增产物通过琼脂糖凝胶回收后,加入pGEM-T Easy载体和连接液,4℃放置过夜。取连接产物转化JM 109感受态菌株,SOC培养基37℃振荡培养3h,取培养液接种到LB平板(含氨苄青霉素、IPTG和X-Gal),进行蓝白斑筛选。挑选单克隆菌落在SOC培养基中培养,提取质粒进行PCR鉴定和序列分析,选出用于体外转录的阳性质粒,-20℃保存。
1.2.4 标准品和标准曲线的制备 将1.2.3所得到的阳性质粒用ScaI酶进行限制性酶切,使质粒线性化,经碱性苯酚、氯仿抽提纯化后用于体外转录;体系为:5×Buffer 4μl,100mol·L-1 DTT 2μl,25nmol·L-1 rATP 1μl,25nmol·L-1 rGTP 1μl,25nmol·L-1 rUTP 1μl,25nmol·L-1 rCTP 1μl,线性化的质粒(约0.8mg·mL-1)1.5μl,T7 RNA聚合酶1μl,RNA酶抑制剂1μl,DEPC处理水6.5μl,总体系为20μl。37℃作用2h。加入DNaseI酶2μl,37℃作用15min,除去线性化的质粒DNA,产物经酸性苯酚/氯仿、氯仿/异戊醇抽提,所得RNA沉淀溶解于20μl DEPC处理水中。取3μl在含有溴化乙锭(Ethidium Bromide, EB)的1.5%琼脂糖凝胶上电泳,检测体外转录RNA的质量。其余的RNA分装,-80℃保存备用。用核酸测定仪测定RNA标准品的浓度,进一步换算成拷贝数。对标准品进行一步法RT-PCR鉴定。将鉴定好的标准品进行10-3~10-7系列梯度稀释,进行一步法荧光定量RT-PCR反应,每个样品两个重复,以模板起始拷贝数的对数为横坐标,以对应样品临界循环数(Threshold cycle,Ct)为纵坐标制作标准曲线,得到标准方程。
1.2.5 样品HSP70mRNA的定量分析 将组织样品在液氮存在的条件下进行研磨,利用Trizol试剂提取样品组织中的总RNA,作为模板进行荧光定量RT-PCR反应,得到各样品的Ct值,根据得到的标准方程换算mRNA的初始拷贝数。利用得到GAPDH mRNA初始拷贝数对得到的HSP70mRNA初始拷贝数进行归一化处理,比较各组织样品中HSP70mRNA转录水平的差异。如果一个样品HSP70的扩增曲线Ct值为Ct70,GAPDH的扩增曲线Ct值为Ctg。那么反应管中HSP70的模板量(X70)为:X70=10 (Ct70-52.535)/-3.129,反应管中GAPDH的模板量(Xg)为:Xg=10(Ctg-51.737)/-3.317,该组织HSP70的量用该组织中的GAPDH的量进行归一化,即X70与Xg相除:X70/Xg= 10(Ct70-52.535)/-3.129-(Ctg-51.737)/-3.317。这样就可得到该反应管中HSP70mRNA相对于该样品持家蛋白基因GAPDH的含量。
1.2.6 分析及统计 利用软件SPSS进行t检验,判定组间hsp mRNA相对量的差异显著性。
2 结果与分析
2.1 阳性质粒的PCR鉴定
GAPDH和HSP70的一步法RT-PCR采用25μl反应体系,模板加5μl,得到特异的230和372bp扩增条带。琼脂糖凝胶电泳回收目的片段,连接pGEM-T Easy载体,转化JM109感受态菌株。通过蓝白斑筛选,得到阳性菌落,提取质粒进行PCR鉴定,得到特异的230和372bp扩增条带(图1)。
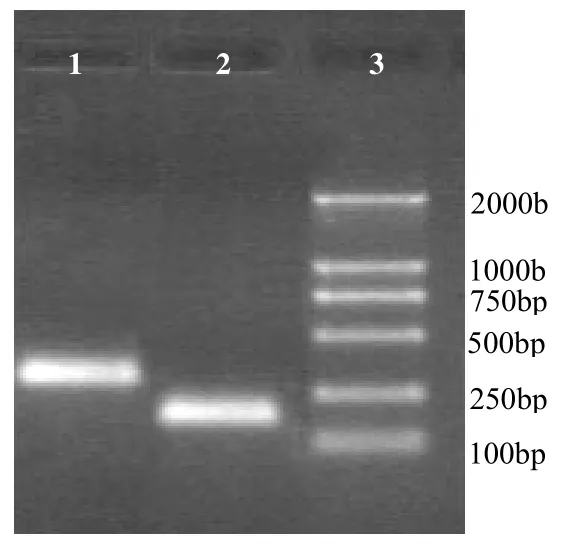
图1 阳性质粒PCR鉴定结果
2.2 标准曲线
将鉴定好的标准品进行10-3~10-7系列梯度稀释,进行一步法荧光定量RT-PCR反应,以模板起始拷贝数的对数为横坐标,以对应样品临界循环数(Threshold cycle,Ct)为纵坐标制作标准曲线,得到标准方程。
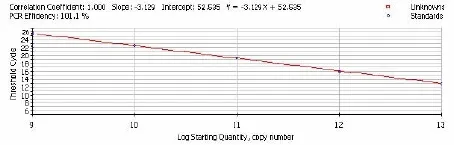
图2 体外转录HSP70 RNA模板10-3~10-7系列稀释制作标准曲线
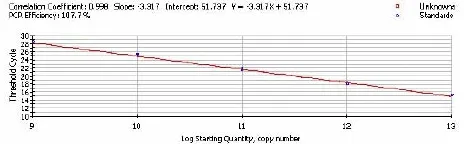
图3 体外转录GAPDH RNA模板10-3~10-7系列稀释制作标准曲线
荧光定量RT-PCR扩增HSP70的标准曲线为:Y=-3.129X+52.535(r=1.000);GAPDH的标准曲线为:Y=-3.317X+51.737(r=0.998)。其中Y代表Ct值,X代表模板量的对数值。结果显示标准曲线的斜率都接近理想值-3.322,相关系数也接近1.000,说明在10-3~10-7的稀释范围内有良好的线性关系(图1~2、图1~3)。
2.3 样品HSP70mRNA的定量
通过荧光定量RT-PCR得到不同样品反应的临界循环数,利用标准方程得到模板起始拷贝数对数值,进一步获得HSP70和GAPDH mRNA的拷贝数。二者的比值即为归一化数值,为本试验的最终数据。
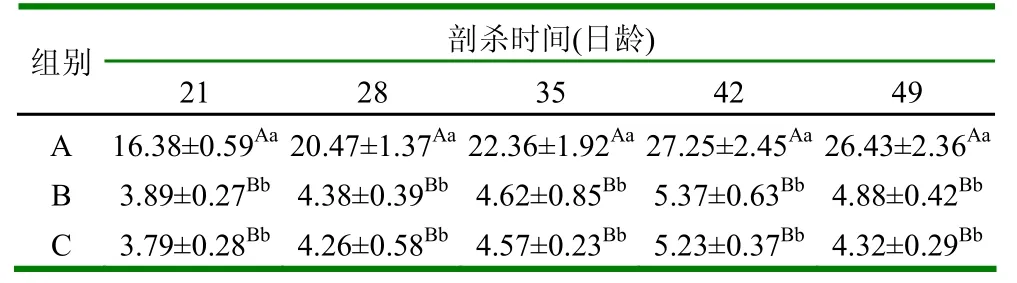
表1 鸡马立克氏病鸡肝脏中HSP70mRNA转录水平的变化

表2 鸡马立克氏病鸡脾脏中HSP70mRNA转录水平的变化
由表1可见,鸡马立克氏病毒攻毒后,肝脏HSP70mRNA的转录水平从21日龄后与空白组、疫苗组相比均极显著增高(P<0.01),而疫苗组与空白组差异不显著(P>0.05)。
由表2可见,鸡马立克氏病毒攻毒后,脾脏HSP70mRNA的转录水平从21日龄后与空白组、疫苗组相比均极显著增高(P<0.01),而疫苗组与空白组差异不显著(P>0.05)。
3 讨论
HSP70能够保护细胞内重要的遗传物质DNA,防止细胞的凋亡,是癌细胞存活的重要条件。食管鳞癌组织中HSP70的表达水平显著高于正常黏膜。利用现代分子生物学技术特异的减少肿瘤细胞系中HSP70的表达量,导致肿瘤细胞大量凋亡,证明HSP的表达是人类癌细胞存活的先决条件[6]。在DNA受损而发生凋亡的细胞中,细胞内HSP70水平较正常二倍体细胞明显减少,从而为HSP70能够保护细胞内重要遗传物质DNA找到了更为直接的证据。细胞在受到热刺激时,HSP70表达增加并逐步向细胞核内聚集;用HSP70表达抑制剂抑制HSP70表达后,细胞核的损伤加重。当乳腺癌细胞接受预热处理后,细胞内HSP70增加,此时细胞对一些本来较敏感的抗癌药物产生耐受,而这些药物正是通过破坏DNA而杀死肿瘤细胞的。
4 结论
本试验结果表明,当鸡马立克氏病毒引发肿瘤时,鸡肝脏和脾脏内HSP70的转录水平极显著高于疫苗组和空白组,而疫苗组和空白组试验鸡肝脏和脾脏内HSP70的转录水平差异不显著,说明攻毒组HSP70的增高是因为发生肿瘤引起的,而不是马立克氏病毒感染引起。
[1] Hightower L E, Hendershot L M. Molecular chaperones and the heat shock response at Cold Spring Harbor. Cell Stress Chaperones, 1997,2: 1-11.
[2] 尹燕明,秦庆亮,张伟,等. 肝细胞癌热休克蛋白70过表达与自发性癌细胞凋亡[J]. 中华肝脏病杂志, 2001, 9(2): 84-85.
[3] So A, Hadaschik B, Sowery R, et al. The role of stress proteins in prostate cancer. Curr Genomics, 2007, 8(4): 252-261.
[4] 孙培明, 李玉保, 王志亮等. 热应激下肉鸡心肌的损伤和热休克蛋白的定位[J]. 南京农业大学学报, 2005, 28(1): 131-134.
[5] 王文祥, 肖高明, 邹求益等. 热休克蛋白70阳性表达与食管鳞癌临床预后分析[J]. 医学临床研究, 2008, 25(9): 1571-1573.
[6] 张国高, 贺涵贞, 邬堂春. 热应激蛋白及其在职业卫生中应用前景[J]. 中华劳动卫生职业病杂志, 1998, 16: 67-70.
S858.31
A
1007-1733(2013)09-0007-03
2013–07–05)

