血管内皮生长因子在实验性分泌性中耳炎大鼠中耳粘膜的表达
李希平 戴海江 赵守琴 范尔钟 刘仲燕 魏永祥
血管内皮生长因子在实验性分泌性中耳炎大鼠中耳粘膜的表达
李希平1戴海江2赵守琴2范尔钟3刘仲燕3魏永祥1
目的探讨血管内皮生长因子(vascular endothelial growth factor,VEGF)与分泌性中耳炎(otitis media with effusion,OME)的关系。方法 50只健康的SD大鼠随机分为实验组(30只)及对照组(20只),均以右耳为实验耳,左耳作正常对照。两组实验耳分别经听泡注入来源于绿脓杆菌的内毒素(endotoxin,ET)35μl(实验组)和等量生理盐水(saline,NE)(对照组),于术后6小时、1天、3天、7天及14天各处死实验组动物6只和对照组动物4只,用HE染色观察两组动物中耳粘膜的病理变化,SABC免疫组织化学染色检测中耳粘膜中VEGF的表达。结果 实验组术后6小时术耳中耳粘膜上皮下间隙增厚,术后1天时增厚更显著并见炎性细胞浸润,中耳腔可见炎性细胞渗出,以多形核中性白细胞为主,3天时上述改变达高峰,7天时仅见上皮下间隙增厚且明显减轻,14天时基本恢复正常;对照组术耳未见明显异常改变。实验组术耳于术后1、3天时在部分中耳粘膜上皮细胞、炎性细胞、血管内皮细胞中见VEGF阳性表达,7天时仅在部分血管内皮细胞有阳性表达,术后6小时及14天、对照组及实验组正常对照耳中耳粘膜均未见阳性表达。结论 细菌内毒素能诱导大鼠急性OME,其病理改变3天时达高峰,14天基本恢复;VEGF可能参与了OME急性期的中耳炎症反应。
血管内皮生长因子; 分泌性中耳炎; 模型,动物
分泌性中耳炎(otitis media with effusion,OME)的发病机理十分复杂,至今尚无定论。细胞因子是炎症细胞和组织产生的糖蛋白,在免疫和炎症过程中起着重要的调节作用,其与OME的关系是近十年来该领域的研究热点。总的来说,细胞因子可分为致炎因子和生长因子两大类,分别具有致炎及刺激组织增生的作用。血管内皮生长因子(vascular endothelial growth factor,VEGF)是生长因子家族中的重要成员,近年来关于其在肿瘤及其他新生物形成过程中的作用已有大量报道[1,2],但对其在OME发病机制中的作用研究较少。本实验采用SABC免疫组化染色方法检测其在OME动物模型中耳粘膜的表达,旨在探讨其在OME发病机制中的作用。
1 材料与方法
1.1 实验动物与分组 50只健康的SD大鼠,体重250~300克,雌雄不拘。实验前所有动物耳廓反射正常,手术显微镜下检查双侧鼓膜均正常。随机分为实验组(30只)和对照组(20只),分别于右侧中耳腔内注射35μl来源于绿脓杆菌的细菌内毒素(endotoxin,ET)(实验组)和等量生理盐水(对照组),两组左耳均作为正常对照耳,不作任何处理。
1.2 主要仪器及试剂 手术显微镜(Olympus)50微量加样器。ET购自Sigma公司,为绿脓杆菌菌属,产品编号L-9143,10 mg包装,在无菌操作台用无菌NS配制成1 mg/ml后以50μl分装于安培管冻存备用。VEGF单克隆抗体(北京中山公司提供),SABC免疫组化试剂盒(武汉博士德公司提供)。
1.3 OME大鼠造模方法 大鼠以氯胺酮(1mg/kg)加芬太尼肌肉注射麻醉后仰卧位固定。颈部备皮,取右侧下颌骨内缘切口,小心钝性分离暴露听泡。以微量加样器抽取35μl ET经听泡壁轻轻刺入中耳腔,再距此穿孔2毫米处轻刺破听泡,以平衡注射时中耳腔压力,防止鼓膜破裂,注射完后用骨蜡封闭两孔,缝合切口。观察鼓膜确无破裂并见积液征后手术结束,送动物房分笼饲养。对照组右耳同法注入生理盐水35μl。
1.4 动物标本采集及染色 于术后6小时、1天、3天、7天、14天分别取实验组动物6只及对照组动物4只,深麻醉后断头暴露听泡往听泡内注入10%的福尔马林溶液50μl,将听泡完整取下,10%的福尔马林溶液中固定12小时,10%的中性EDTA溶液中脱钙约20天,酒精梯度脱水,常规石蜡包埋,各取半数听泡沿水平位与冠状位方向以4μm层厚切片,行常规HE染色和SABC法免疫组化染色。染色步骤按试剂盒说明书进行,VEGF免疫组化染色以PBS代替一抗作为阴性对照,以细胞胞浆呈棕黄色染色为阳性表达判断标准。
2 结果
2.1 组织学观察 实验组术后6小时术耳中耳粘膜上皮下间隙增厚,1天时增厚更明显并见炎性细胞浸润,中耳腔可见炎性细胞渗出,以多形核中性白细胞为主,3天时上述改变达高峰,7天时仅见上皮下间隙增厚,且明显减轻,14天时基本恢复正常。正常对照耳及对照组未见明显异常改变(图1~4)。
2.2 VEGE在两组动物中耳粘膜的表达 实验组术耳术后6小时VEGF无阳性表达,1天时在部分纤毛上皮细胞及中性粒细胞见阳性表达,3天时在中性粒细胞中表达明显增强,7天仅在部分纤毛上皮细胞见阳性表达,14天时未见阳性表达。正常对照耳及对照组均未见阳性表达(图5~8)。
3 讨论
OME的重要特征是渗出液积聚于中耳腔,关于渗液产生的机理,目前研究表明参与OME发病过程的炎症介质有组胺、花生四烯酸代谢产物、P物质、血管活性肠肽、血小板激活因子等[3~6],它们都有扩血管及增加血管通透性的作用,从而造成渗液的潴留。VEGF是目前已知的最强的促血管通透剂,其生物学作用是组胺的5万倍[7],其生物学效应包括增强血管通透性、促进血管内皮细胞增殖和促进血管形成,但其在OME发病过程中的作用不甚明了。新近研究[8]显示,VEGF在急性中耳炎大鼠的中耳粘膜中表达上调,微泵持续灌注VEGF可明显促进灌注区中耳粘膜的血管生成。在胃液诱发的兔中耳炎模型中同样发现VEGF在中耳粘膜的表达增加[9]。更为直接的证据是,在46份分泌性中耳炎患者的中耳渗液中VEGF检出率高达100%,并与内毒素水平明显相关,且VEGF在粘液性渗液中的浓度高于在浆液性渗液中的浓度[10],充分说明VEGF与中耳炎渗液的形成有关。

图1 正常大鼠鼓室前壁单层扁平上皮(HE×200)

图5 实验组造模后1天时VEGF在上皮细胞(黑箭头所示)、中性粒细胞(白色箭头所示)中的表达(免疫组化×400)
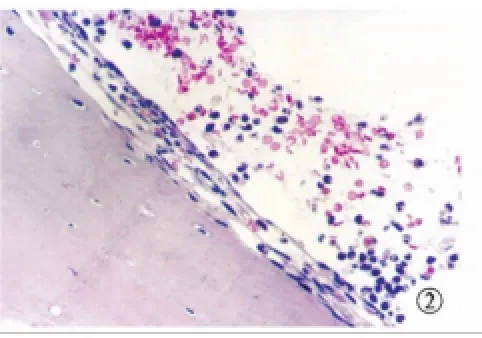
图2 实验组造模1天鼓室黏膜炎症反应,黏膜上皮下间隙增厚,炎症细胞浸润渗出(HE×200)

图3 实验组造模第3天鼓室黏膜炎症反应,黏膜上皮下间隙增厚更著,炎症细胞浸润渗出更重(HE×200)

图4 实验组造模第14天鼓室黏膜恢复情况,上皮层仍明显厚于正常,炎症反应消退(HE×200)

图6 实验组造模后3天时VEGF在大量中性粒细胞(黑色箭头)中的表达(免疫组化×400)

图7 实验组造模后7天时VEGF在上皮细胞中微弱表达(免疫组化×400)

图8 阴性对照组VEGF未见表达(免疫组化×400)
1999年Jung[7]首次报道在ET诱导的大鼠OME中耳粘膜中检测到了VEGF的表达,并通过RT-PCR技术检测到慢性中耳炎患者的中耳粘膜中有VEGF表达。他推测VEGF增加血管通透性及刺激内皮细胞增殖的作用可能对中耳炎的发生发展产生了一定促进作用。研究显示,ET可以刺激上皮细胞及血管平滑肌细胞产生VEGF,并被认为是VEGF的主要来源[11,12]。本实验结果显示VEGF在中耳粘膜纤毛上皮细胞中表达的同时,在中性粒细胞中的阳性表达十分明显,与Jung的研究结果相近。Webb[13]研究发现人类激活的中性粒细胞可以表达VEGF,结合本实验结果,推测OME模型中激活的中性粒细胞可能是VEGF的重要来源,VEGF产生后增加了血管通透性,可能对分泌性中耳炎的渗液形成起到了关键作用。Kim[14]将重组VEGF 1.0μg注入大鼠鼓室成功诱发了中耳黏膜的炎症反应,并产生了中耳渗液,进一步证明VEGF对渗液形成的作用。VEGF主要通过与VEGF受体结合起作用,受体分VEGFR-1和VEGFR-2两种,Chae[15]在内毒素诱导的分泌性中耳炎模型中取不同时间点的中耳黏膜采用RT-PCR检测VEGFR-1和VEGFR-2的表达,发现在造模后1小时和3天其表达均上调,表达高峰出现在12小时及1天。
近年来ET和VEGF之间的关系已引起了研究者的兴趣。Sugishita[16]在培养液中加入ET培养新生大鼠的心室肌细胞,以研究ET对VEGF表达和分泌的影响,发现10μg的ET在1小时内迅速增加了细胞内VEGFmRNA的水平,ET作用6小时后培养基中VEGF的浓度也显著增加,他推测VEGF参与了ET诱导的炎症反应过程。Itaya[17]研究巨噬细胞在ET刺激下产生VEGF的机制,发现可能有P38-MAP激酶途径介导,地塞米松可以抑制蛋白的产生,但却不能抑制mRNA的产生。说明ET与VEGF的产生有因果关系。
综上所述,推测OME患者有可能因为细菌ET的存在导致鼓室黏膜的炎性反应,不断刺激产生VEGF,造成血管通透性增加,导致渗液形成。今后进一步研究VEGF与其他细胞因子之间的相互作用和不同病程OME患者中耳渗液中VEGF的表达水平对阐明OME的发病机理和指导临床治疗将具有重要意义。
1 Leung DW,Cachianes G,Kuang WJ,et al.Vascular endothelial growth factor is a secreted angiogenic mitogen[J].Science,1989,246:1 306.
2 Majeti BK,Lee JH,Simmons BH,et al.VEGF is an important mediator of tumor angiogenesis in malignant lesions in a genetically engineered mouse model of lung adenocarcinoma[J]. BMC Cancer,2013,13:213.
3 Goldie P,Jung TT,Hellström S,et al.Arachidonic acid metabolites in experimental otitis media and effects of anti-inflammatory drugs[J].Ann Otol Rhinol Laryngol,1993,102:954.
4 Jung TT.Prostaglandins,Leukotrienes,and other arachidonic acid metabolites in the pathogenesis of otitis media[J].Laryngoscope,1988,98:980.
5 Berger G,Hawke M,Proops DW,et al.Histamine levels in middle ear effusions[J].Acta Otolaryngol,1984,98:385.
6 Rhee CK,Park YS,Long SA,et al.Effects of platelet activating factor on vascular permeability of the middle ear mucosa[J]. Ann Otol Rhinol Laryngol,1997,106:604.
7 Jung HH,Kim MW.Expression of vascular endothelial growth factor in otitis media[J].Acta Otolaryngol(Stockh),1999,119:801.
8 Husseman J,Palacios SD,Rivkin AZ,et al.The role of vascular endothelial growth factors and fibroblast growth factors in angiogenesis during otitis media[J].Audiol Neurootol,2012,17:148.
9 Başogˇlu MS,Eren E,Aslan H.Increased expression of VEGF,iNOS,IL-1β,and IL-17 in a rabbit model of gastric content -induced middle ear inflammation[J].Int JPediatr Otorhinolaryngol,2012,76:64.
10 Sekiyama K,Ohori J,Matsune S,et al.The role of vascular endothelial growth factor in pediatric otitis media with effusion[J].Auris Nasus Larynx,2011,38:319.
11 Burse B,Brown LF,Vande de Water L,et al.Vascular permeability factor gene is expressed differentially in normal tissues,macrophages,and tumors[J].Mol Biol Cell,1992,3:211.
12 Williams B,Quinn-Baker A,Gallacher B,et al.Serum and platelet-derived growth factor-induced expression of vascular permeability factor by human vascular smooth muscle cells in vitro[J].Clin Sci(Colch),1995,88:141.
13 Webb NJ,Myers CR,Watson CJ,et al.Activated human neutrophils express vascular endothelial growth factor[J].Cytokine,1998,10:254.
14 Kim TH,Chae SW,Kim HJ,et al.Effect of recombinant vascular endothelial growth factor on experimental otitis media with effusion[J].Acta Otolaryngol,2005,125:256.
15 Chae SW,Kim SJ,Kim JL,et al.Expression of vascular endothelial growth factor receptors in experimental otitis media in the rat[J].Acta Otolaryngol,2003,123:559.
16 Sugishita Y,Shimizu T,Yao A,et al.Lipopolysac-charide augments expression and secretion of vascular endothelial growth factor in rat ventricular myocytes[J].Biochem Biophys Res Commun,2000,268:657.
17 Itaya H,Imaizumi T,Yoshida H,et al.Expression of vascular endothelial growth factor in human monocyte/macrophages stimulated with lipopolysaccharide[J].Thromb Haemost,2001,85:171.
(2012-09-20收稿)
(本文编辑 雷培香)
Expression of Vascular Endothelial Growth Factor in Rat Experimental
Otitis Media with Effusion Li Xiping*,Dai Haijiang,Zhao Shouqin,Fan Erzhong,Liu Zhongyan,Wei Yongxiang
(*Department of Otolaryngology Head and Neck Surgery,Beijing Anzhen Hospital Affiliated to Capital Medical University,Beijing,100029,China)
Objective To study the expression of vascular endothelial growth factor(VEGF)and its relationship with otitis media with effusion(OME).Methods Fifty healthy Sprague-Dawley rats of either sex(250~300 mg)were randomly devided into experimental group(LPS group,30 rats)and control group(NS group,20 rats). Thirty-fiveμl volume of 1 mg/ml endotoxin(ET)from pseudomonas aeruginosa and the same amount of saline(NS)were injected into the right tympanic bullas of the two groups transbullaly.Six rats from LPS group and 4 rats from NS group were killed on postoperative 6 h,1 d,3 d,7 d,14 d respectively.The temporal bones were harvested for histology and VEGF SABC immunohistochemical analysis.The left tympanic bullas served as control.Results The epithelial layer and subepithelial space thicked mildly in ET group at 6 h,and more heavily at 1 d with inflammatory cells infiltration(mostly polymorphonuclear leukocytes)throughout them.At 3 d,the same changes were observed most severely.By 14 d,the mucosal lining became normal,while no obvious changes were observed in the NS group.Immunostaining of VEGF in normal rat middle ear and NS-treated mucosa revealed no expression.VEGF postitive staining was observed in ciliated cells,some inflammatory cells(mostly PMNs),vascular endothelial cells at 1 dand became strongest at 3 d and then weakily identified in few vascular endothelial cells by 7 d.No expression was observed at 6 h and 14 d.Conclusion Endotoxin can induce OME,with inflammatory changes peak at day 3 and return to normal by day 14.VEGF participates in the course of acute inflammatory reponse of OME and may play an important role in the pathogenesis of OME.
Vascular endothelial growth factor; Otitis Media,with effusion; Model,animals
10.3969/j.issn.1006-7299.2013.04.018
时间:2013-7-3 16:56
R764.21
A
1006-7299(2013)04-0387-04
1 首都医科大学附属北京安贞医院耳鼻咽喉头颈外科(北京 100029); 2 首都医科大学附属北京同仁医院耳鼻咽喉头颈外科; 3 北京市耳鼻咽喉科研究所
李希平,男,山东人,医学博士,副主任医师,主要研究方向为耳科基础与临床,睡眠呼吸暂停综合征的微创治疗。
魏永祥(weiyongxiang@vip.sina.com)
网络出版地址:http://www.cnki.net/kcms/detail/42.1391.R.20130703.1656.008.html

