听觉剥夺大鼠听皮层BDNF和Trk B的表达变化△
王玉杏 徐鸥 刘砚星 黄河银 路虹
听觉剥夺大鼠听皮层BDNF和Trk B的表达变化△
王玉杏1徐鸥1刘砚星2黄河银1路虹1
目的通过建立听觉剥夺(auditory deprivation,AD)的动物模型,探讨脑源性神经生长因子(brainderived neurotrophic factor,BDNF)和其功能性受体酪氨酸激酶B(tropomyosin receptor kinase B,Trk B)与听皮层可塑性的关系。方法 48只SD大鼠随机分为实验组和对照组,每组24只,采用耳后切口暴露听泡并打开,实验组行双侧耳蜗损毁术建立大鼠AD模型,对照组不损毁耳蜗。于术后2 w分别检测两组动物ABR反应阈,并应用实时荧光定量PCR技术和免疫组织化学方法,于术后2、4、6、8 w测定两组大鼠听皮层BDNF和Trk B基因mRNA和蛋白表达水平。结果 术后2 w,实验组动物双耳ABR反应阈明显高于对照组(P<0.05);听觉剥夺后,听皮层BDNF与TrkB有相同的表达变化趋势,除术后6 w外,实验组第2、8 w BDNF与TrkB基因mRNA和蛋白表达量低于对照组(P<0.05),而第4 w二者的表达量高于对照组(P<0.05)。结论 BDNF通过与功能性受体Trk B结合,参与听皮层神经元可塑性的调节,可能对神经元的损害具有代偿性修复作用。
听觉剥夺; 脑源性神经生长因子; 酪氨基激酶B; 可塑性; 听皮层
研究表明,听觉中枢能够在外周听觉系统损害或听觉训练后产生结构和功能的改变,这种听觉中枢随外界变化而变化的能力称作“可塑性”[1],其在出生后的脑发育阶段最明显,称“关键期”[2]。
脑源性神经生长因子(brain-derived neurotrophic factor,BDNF)作为神经营养蛋白家族中的重要成员之一,大量产生于中枢神经系统特定的神经元内。BDNF通过与细胞膜特异性受体酪氨酸激酶B(tropomyosin receptor kinase B,Trk B)结合,不仅可促进发育中的神经元的生存、分化、生长,维持神经元正常的生理功能以及突触的传递,而且对成年期神经元具有抗损伤性刺激,促进神经元再生和修复,促进神经纤维生长,抑制神经细胞凋亡的重要作用[3]。本实验拟采用双侧耳蜗损毁手术制作听觉剥夺(auditory deprivation,AD)动物模型,观察BDNF和Trk B在大鼠听皮层的表达变化,探讨BDNF-Trk B信号通路在听皮层发生可塑性变化过程中所起的调节作用。
1 材料与方法
1.1 实验动物分组及听觉剥夺模型的建立 48只两周龄健康雄性SD大鼠(由河北医科大学实验动物学部提供),双侧外耳道通畅,无耳疾,随机分为实验组和对照组,每组各24只。实验组行双侧耳后切口,暴露听泡并打开,窥见耳蜗并损毁之;对照组在相同条件下做双侧耳后切口并打开听泡,但不损毁耳蜗。按术后存活时间每组动物又分别分为4个小组,即术后2、4、6、8 w组,每组6只,分笼喂养于屏障环境中。
1.2 实验方法
1.2.1 听性脑干反应(ABR)检测 实验组与对照组动物分别于术后2 w进行ABR检测。动物以5%水合氯醛(10 ml/kg)腹腔注射麻醉,麻醉后置于隔声屏蔽室内,采用美国ICS听性脑干诱发电位仪检测,刺激声为短声,极性为交替波,速率为21.1/s,增益为50 k,以可引出波Ⅲ的最小刺激强度定为ABR反应阈。
1.2.2 免疫组织化学取材及染色 每组动物各取3只制作石蜡标本。动物以5%水合氯醛(10 ml/kg)腹腔注射麻醉,心脏灌注,取出整个大脑置于4%多聚甲醛中后固定24 h。固定后二次取材,经脱水、透明、浸蜡、包埋步骤制成石蜡块。参照大鼠脑立体定位图谱确定听皮层区域,用石蜡切片机连续切片。切片经脱蜡、水化后,抗原修复;H2O2封闭;血清封闭;加一抗工作液(兔抗鼠BDNF多克隆抗体,Santa Cruze,SC-20981;兔抗鼠TrkB多克隆抗体,Bioworld,BS1431;稀释比例1:100);加二抗工作液;加HRP标记的链霉亲和素;DAB显色;苏木素复染;脱水、透明、封片。除血清封闭外,余步骤孵育后用0.01 M PBS漂洗。阴性对照用0.01 M PBS代替一抗,余同上。以细胞胞膜和轴突存在棕黄色颗粒定为阳性细胞,用Image Pro Plus 5.1图像处理软件分析图片阳性细胞平均光密度值(AOD)。
1.2.3 RT-PCR取材和检测 每组动物各取3只,断头处死,快速取出听皮层置于Trizol内,保存于-80℃备用。采用RT-PCR法检测基因:提取总RNA,测定RNA纯度,反转录,RT-PCR:用AB 7500型荧光定量PCR仪,采用20μl反应体系,β-actin作为内参基因,扩增40个循环。根据原始检测结果(ct值,ct值越高,其表达越弱),采用2-ΔΔct分析法分析BDNF和T2KB mRNA的表达水平。
1.3 统计学方法 实验数据用均数±标准差(¯x± s)表示,采用SPSS13.0统计软件,两组间比较采用t检验,多组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 ABR检测结果 术后2 w对照组大鼠双耳ABR反应阈为20.21±4.29 dB SPL,AD组双耳ABR反应阈为91.33±5.32 dB SPL,两组间比较,差异有显著统计学意义(P<0.05)。
2.2 RT-PCR检测结果 实验组大鼠听皮层BDNF与Trk B的mRNA表达变化趋势基本一致,除术后6 w组外,2、4、8 w组BDNF与TrkB的mRNA表达量与对照组相比,差异具有统计学意义(P<0.05)(表1、表2)。
2.3 免疫组织化学染色结果 实验组和对照组听皮层均有BDNF和TrkB蛋白表达,主要定位于胞膜和轴突。AD组BDNF与Trk B蛋白表达量在术后2 w降低,4 w增多,之后下降,峰值在4 w;对照组蛋白表达在术后2 w最多,之后下降并保持在一定水平。实验组各组间比较,差异有统计学意义(P<0.05),除6 w组外,2、4、8 w组与对照组比较,差异均有统计学意义(P<0.05)(表3、图1、图2)。
表1 术后不同时间两组大鼠听皮层BDNF与Trk B RT-PCR检测结果

表1 术后不同时间两组大鼠听皮层BDNF与Trk B RT-PCR检测结果
注:*与对照组比较,P<0.05
检测时间BDNF实验组 对照组TrkB实验组 对照组术后2 w 25.69±0.40*24.48±0.32 25.59±0.51*25.45±0.52 24.62±0.40术后4 w 24.49±0.24*25.36±0.32 25.04±0.30*25.64±0.62术后6 w 25.50±0.43 25.32±0.58 25.39±0.40 25.61±0.59术后8 w 26.60±0.29*25.31±0.26 26.44±0.34*

表2 实验组大鼠术后不同时间听皮层BDNF与TrkB m RNA表达水平(2-ΔΔct)
表3 术后不同时间两组大鼠听皮层BDNF与TrkB蛋白表达的平均光密度值
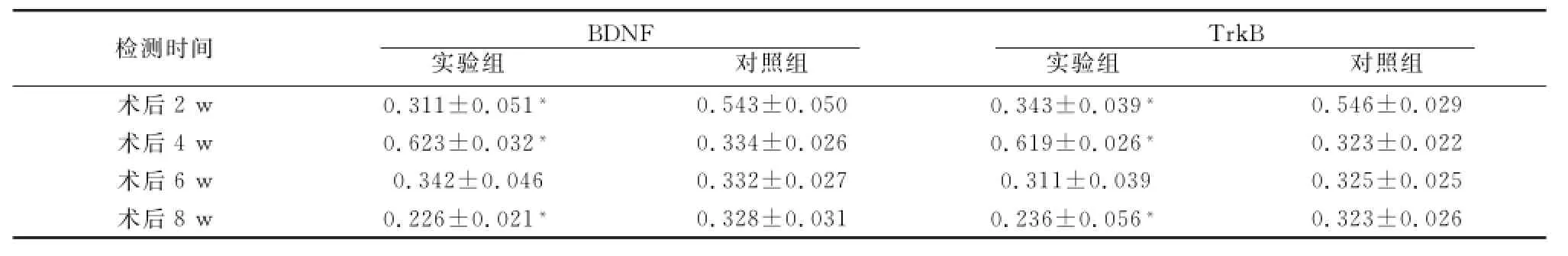
表3 术后不同时间两组大鼠听皮层BDNF与TrkB蛋白表达的平均光密度值
注:*与对照组比较,P<0.05
检测时间BDNF实验组 对照组TrkB实验组 对照组术后2 w 0.311±0.051*0.543±0.050 0.343±0.039*0.323±0.026 0.546±0.029术后4 w 0.623±0.032*0.334±0.026 0.619±0.026*0.323±0.022术后6 w 0.342±0.046 0.332±0.027 0.311±0.039 0.325±0.025术后8 w 0.226±0.021*0.328±0.031 0.236±0.056*

图1 两组大鼠听皮层BDNF免疫组织化学染色图片(SP×200)

图2 两组大鼠听皮层TrkB经免疫组织化学染色图片(SP×200)
3 讨论
听觉经历在听觉中枢的发育过程中扮演着非常重要的角色[4]。研究发现,幼年小鼠在接受特定音调的声音刺激一段时间后,初级听皮层此频率声音的代表区域扩大[5]。在幼鼠发育阶段,耳蜗损毁可导致听皮层结构和功能发生适应性改变,在双侧耳蜗损毁的大鼠,自听觉剥夺效应产生起,蜗神经核便出现了神经元凋亡现象,并持续发展,直到4个月时各核群体积明显缩小,神经元数量明显减少[6]。神经元数量的减少进一步导致听皮层发生可塑性的改变,其原因可能与听皮层内源性BDNF和Trk B的表达变化及其神经保护作用降低有关[7]。
大鼠听力发育的关键期在生后12天开始,30天结束[8],国此本实验选择出生后2 w的大鼠作为实验动物。Tan等[9]发现耳聋幼鼠听皮层内BDNF的表达下降,而在耳蜗植入重获听力之后,双侧听皮层BDNF表达水平明显提高。本研究结果显示,实验组大鼠在听觉发育期(生后4 w,即术后2 w)BDNF和TrkB的基因和蛋白表达均降低,提示BDNF和TrkB可能对听觉中枢神经元的发育发挥重要作用,进而维持听皮层正常的可塑性。
研究表明,在缺乏听觉信号刺激的新生大鼠外侧上橄榄核中,突触的发育过程只是部分受阻,并没有完全终止[10],这提示AD对大鼠听皮层的发育可能只是起到延缓作用,而非终止效应。本研究发现,正常大鼠听皮层BDNF与Trk B的最高表达量出现在2 w,而大鼠听觉剥夺没有声音信号刺激的情况下,听皮层BDNF和TrkB的表达在4 w时增多,这可能是BDNF-TrkB的代偿性改变,起到抵抗神经元细胞退化的作用。
本研究显示,对照组大鼠在出生后早期,听皮层BDNF对声音刺激极其敏感,2 w时表达最高,进而促进神经元的生长发育;Trk B作为BDNF的功能受体,最高表达量也出现在2 w,提示BDNF的促发育机制可能与BDNF-Trk B信号激活有关。而听觉剥夺大鼠在没有声信号刺激时也出现BDNF与Trk B的表达增多,且峰值在4 w,其原因可能为:①听皮层受到视觉等其他感觉刺激的影响产生了“交叉可塑性”变化,即邻近的其他感觉皮层神经元向听皮层延伸,并占据其位置;②神经元本身情况的不同,在早期,神经元处在生长发育阶段,而生后4 w幼稚的神经细胞逐渐发育成熟,由于成熟神经细胞表面Trk B受体表达不同,导致BDNF对细胞或突触的选择性。有研究发现TrkB截断受体能够隔离BDNF的作用,参与BDNF的转移,调节星形胶质细胞的细胞骨架结构[11]。目前Trk B受体各亚型与BDNF结合的作用机制的研究还不完全清楚[12],有待更进一步研究。
本研究结果显示,实验组动物到术后8 w,听皮层BDNF和Trk B的表达明显减少,说明听觉剥夺后,随听皮层“交叉可塑性”的完成,BDNF-TrkB所发挥的抵抗神经元损伤的作用基本结束。此外,上述现象也反映了BDNF-Trk B参与听皮层神经元可塑性变化的调节是一个缓慢的过程。因此,对于极重度听力损失的患儿,在听皮层神经元可塑性损害较轻的时段植入人工耳蜗,有利于其重获言语和交流的能力;而在听觉剥夺晚期,听皮层神经元大量减少,听皮层的可塑性受到严重的破坏,依靠耳蜗植入重获听力的可能性大大降低。而且,已有研究证实在听力丧失的早期接受耳蜗植入的儿童比晚期植入者能够更快的重获言语能力[13,14]。
BDNF-TrkB信号通路在调节听皮层可塑性变化方面可能发挥着重要作用,而BDNF与受体Trk B各亚型结合的机制有待进一步研究。
1 Palmer CV,Nelson CT,Lindley GA 4th.The functionally and physiologically plastic adult auditory system[J].J Acoust Soc Am,1998,103:1 705.
2 Oh SH,Kim CS,Song JJ.Gene expression and plasticity in the rat auditory cortex after bilateral cochlear ablation[J]. Acta Otolaryngological,2007,127:341.
3 Mc Allister AK.BDNF[J].Curr Biol,2002,12:R 310.
4 Zhang LI,Bao S,Merzenich MM.Disruption of primary auditory cortex by synchronous auditory inputs during a critical period[J].Proc Natl Acad Sci U S A,2002,99:2 309.
5 Zhang LI,Bao S,Merzenich MM.Persistent and specific influences of early acoustic environments on primary auditory cortex[J].Nat Neurosci,2001,4:1 123.
6 张萌,陈晓巍,田永胜.耳蜗毁损后小鼠听觉中枢的退行性改变[J].中华耳鼻咽喉头颈外科杂志,2009,44:571.
7 Pandya CD,Kutiyanawalla A,Pillai A.BDNF-TrkB signaling and neuroprotection in schizophrenia[J].Asian J Psychiatr,2013,6:22.
8 Nakahara H,Zhang LI,Merzenich MM.Specialization of primary auditory cortex processing by sound exposure in the"critical period"[J].Proc Natl Acad Sci U S A,2004,101:7 170.
9 Tan J,Widjaja S,Xu J,et al.Cochlear implants stimulate activity-dependent CREB pathway in deaf auditory cortex:implications for molecular plasticity induced by neural prosthetic devices[J].Cerebral Cortex,2008,18:1 799.
10 时海波,殷善开,冯艳梅,等.听觉剥夺延缓大鼠上外橄榄核神经元抑制性突触的发育[J].上海交通大学学报(医学版),2007,9:1 049.
11 Ohira K,Funatsu N,Homma KJ,et al.Truncated TrkBT1 regulates the morphology of neocortical layer I astrocytes in adult rat brain slices[J].Eur J Neurosci,2007,25:406.
12 Wong J,Garner B.Evidence that truncated TrkB isoform,TrkB-Shc can regulate phosphorylated Trk B protein levels[J].Biochem Biophys Res Commun,2012,420:331.
13 Svirsky MA,Teoh SW,Neuburger H.Development of language and speech perception in congenitally,profoundly deaf children as a function of age at cochlear implantation[J].Audiol Neurootol,2004,9:224.
14 Hayes H,Geers AE,Treiman R,et al.Receptive vocabulary development in deaf children with cochlear implants:achievement in an intensive auditory-oral educational setting[J].Ear Hear,2009,30:128.
(2013-01-06收稿)
(本文编辑 李翠娥)
Expression of BDNF and TrkB in Rat Auditory Cortex after Bilateral Cochlear Ablation
Wang Yuxing*,Xu Ou,Liu Yanxing,Huang Heyin,Lu Hong
(*Department of Otorhinolaryngology,the Second Hospital of Hebei Medical University,Shijiazhuang,050000,China)
Objective To investigate the relationship between brain-derived neurotrophic factor(BDNF)and tropomyosin receptor kinase B(TrkB)and the plasticity of auditory cortex(AC)in auditory deprivation(AD)fo animal model.Methods Forty-eight SD rats were randomly divised into 2 groups(24 rats/group).Experiment group received bilateral cochlear ablation while control group did not.AD model was established by bilateral cochlear ablation through retroauricular incision.Technology of real-time polymerase chain reaction(RT-PCR)and immunohistochemistry method were used to observe the expressions of BDNF and Trk B in AC at 2 wks,4 wks,6 wks and 8 wks after operation.Statistical analysis was conducted with SPSS 13.0 software.Results Bilateral cochlear ablation resulted in serious hearing loss and the threshold of ABR was significantly increased(P<0.05).The expression patterns of BDNF and TrkB in auditory cortex were similar with each other after auditory deprivation,which decreased at 2 wks,increased and peaked at 4 wks,and then decreased afterward.The difference between each AD group and control group was statistically significant(P<0.05)except for 6 wks.Conclusion BDNF participates in the plasticity change of auditory cortex through BDNF-Trk B signal passway which may play critical roles in the impairment of neuron.
Auditory deprivation; Brain-derived neurotrophic factor; Tropomyosin receptor kinase B;Plasticity; Auditorycortex
10.3969/j.issn.1006-7299.2013.04.016
时间:2013-5-9 13:58
R339.16
A
1006-7299(2013)04-0379-04
△ 河北省自然科学基金(C2011206036)和河北省卫生厅医学科学研究重点课题计划(20110375)资助
1 河北医科大学第二医院耳鼻咽喉科(石家庄 050000); 2 河北医科大学药理学教研室
王玉杏,女,河北人,硕士研究生,主要研究方向为耳科基础。
路虹(Email:luhong12112003@yahoo.com.cn)
网络出版地址:http://www.cnki.net/kcms/detail/42.1391.R.20130509.1358.003.html

