红景天对大鼠肝纤维化肝脏组织Smad4、Smad7表达的影响
卢凤美 刘东璞 王明富 郭梦凡 孟庆媛 盛延良 王 抒
(佳木斯大学司法鉴定中心,黑龙江 佳木斯 154007)
肝纤维化是多种慢性肝脏疾病发展为肝硬化的中间环节,有效的控制肝纤维化进展具有重要的临床意义。实验证明红景天具有保护肝细胞、调节机体免疫功能等多种功效,动物实验观察到其具有良好的干预四氯化碳诱导的肝纤维化作用。Smads是一族传递TGFβ信号的分子,其中Smad6,7具有抑制作用,Smad4则为传递信息必需的共用Smad分子,阻断或干扰该上述信号转导通路有可能阻止肝纤维化进程〔1〕,为肝纤维化的治疗带来了新希望。本文针对CCl4中毒性大鼠肝纤维化模型,应用反义寡核苷酸技术及免疫组化技术,以 Smad4及Smad7为靶基因,观察红景天对Smad4及Smad7基因表达的影响,进一步从分子水平探讨红景天干预实验性大鼠肝纤维化的可能分子机制。
1 材料与方法
1.1 材料 健康雄性SD大鼠60只,质量180~220 g,由佳木斯大学实验动物中心提供。四氯化碳(CCl4)购自天津石英钏厂霸州市化工厂分厂。红景天胶囊购自福州恒丰量子生物科技有限公司。组织RNA提取试剂盒及逆转录试剂盒为立陶宛MBI公司产品。Smad4、Smad7上下游引物及兔抗大鼠Smad4、Smad7的一抗由上海生物工程公司生产。辣根过氧化物酶(HRP)标记的免疫组化通用型羊抗兔的二抗工作液由北京中山生物技术有限公司生产。
1.2 方法
1.2.1 分组 随机分组:①正常组;②肝纤维化模型组;③复方红景天治疗组。每组20只,各组间暴露因素无差别(P>0.05)。用CCl4腹腔注射法诱导大鼠肝纤维化模型,即用100 ml/L CCl4(橄榄油稀释)1 ml/kg,1次/w,共8 w。红景天干预组在造模的同时给予红景天灌胃(浓度40 g/L,剂量10 ml/kg,2次/w,共8 w),肝纤维化模型组造模同时予生理盐水灌胃,正常组予等量橄榄油和生理盐水灌胃处理。各组大鼠在最后一次CCl4注射后48 h处死,部分肝脏用4%甲醛固定,留做病理检查,其余标本迅速放到-80℃冰箱保存。
1.2.2 常规病理学检查 病理学切片用HE染色,按2000年在西安会议上由中华医学会传染病与寄生虫病学分会、肝病学分会联合修订的慢性肝炎分级分期标准判定肝纤维化程度。
1.2.3 RT-PCR检测肝组织中Smad4 mRNA、Smad7 mRNA
TRIzol一步法提取组织总RNA,总RNA反转录成cDNA,PCR反应。取10μl PCR扩增产物加入25 g/L溴乙啶琼脂糖凝胶中,以80 V/cm电压电泳50 min,在紫外线下可见相应的长度的目的基因和内参的扩增条带,将电泳结果直接置于凝胶分析系统中对条带进行分析。根据GenBank数据库,应用Primer-3软件设计目的基因的扩增引物。Smad 4:上游:5'-TGCAGGTGGCTGGTCGGAAAG-3',下游:5'-AGGATGATTGGAAATGGGAGGCTG-3',长度 710 bp,反应条件分别是:94℃ 2 min,94℃ 30 s,58℃ 30 s,72℃ 50 s,28个循环(经多次预试验摸索最佳实验条件);72℃ 7 min。SMad7:上 游:5'-TCTCAGGCATTCCTCGGAAGTC-3',下 游:5'-ACGCC ATCCACTTCCCTTGTC-3',长 度481 bp,反应条件分别是:94℃ 2 min,94℃ 30 s,59℃ 30 s,72℃50 s,28个循环(经多次预试验摸索最佳实验条件);72℃7 min。PCR产物经琼脂糖凝胶电泳后用Bio-RadGel Doc2000型凝胶成像系统照像并用QuangtityOne软件计算基因相对表达值。
1.2.4 免疫组化检测肝组织中Smad4、Smad7 用3',3-二氨基联苯胺(DAB)二步法检测肝组织中Smad4、Smad7。方法:石蜡切片经常规脱蜡至水。用30 ml/L H2O2消除内源性过氧化氢酶,以柠檬酸盐工作缓冲液微波热修复,用100 ml/L正常山羊血清封闭非特异性抗原,滴加1∶200的一抗,4℃孵育过夜。滴加适量的二抗(HRP标记)工作液,37℃孵育20 min,DAB显色,苏木素液复染,封片。以磷酸盐缓冲液代替第一抗体作阴性对照。对阳性染色采用HPIAS-2000型高清晰度彩色病理图文分析系统进行灰度分析,按照Weidner方法,双盲法阅片,先在低倍镜下选择阳性结果密集区域,然后在高倍视野下自动计算A值,取平均值计为该切片的A值。
2 结果
2.1 大鼠肝组织Smad4表达 RT-PCR检测正常肝组织未见明显Smad4 mRNA阳性表达细胞;模型组大鼠肝组织Smad4 mRNA的水平较正常组显著增高(P<0.01);红景天治疗组大鼠肝组织中Smad4 mRNA的水平较模型组显著降低(P<0.05)。免疫组化染色可见正常大鼠肝组织未检出明显的Smad4表达,模型组大鼠肝组织则Smad4表达明显增加,棕黄色阳性颗粒定位于细胞质和细胞核,阳性细胞集中于汇管区,以梭状的间质细胞为主,肝细胞未见明确阳性反应。红景天治疗组大鼠肝组织Smad4表达较模型组明显减少,阳性细胞亦主要位于汇管区,以间质细胞为主。各组阴性对照未见阳性表达,证实免疫组化和RT-PCR检测结果具有特异性(P<0.05)。见表 1,图 1、图 2。
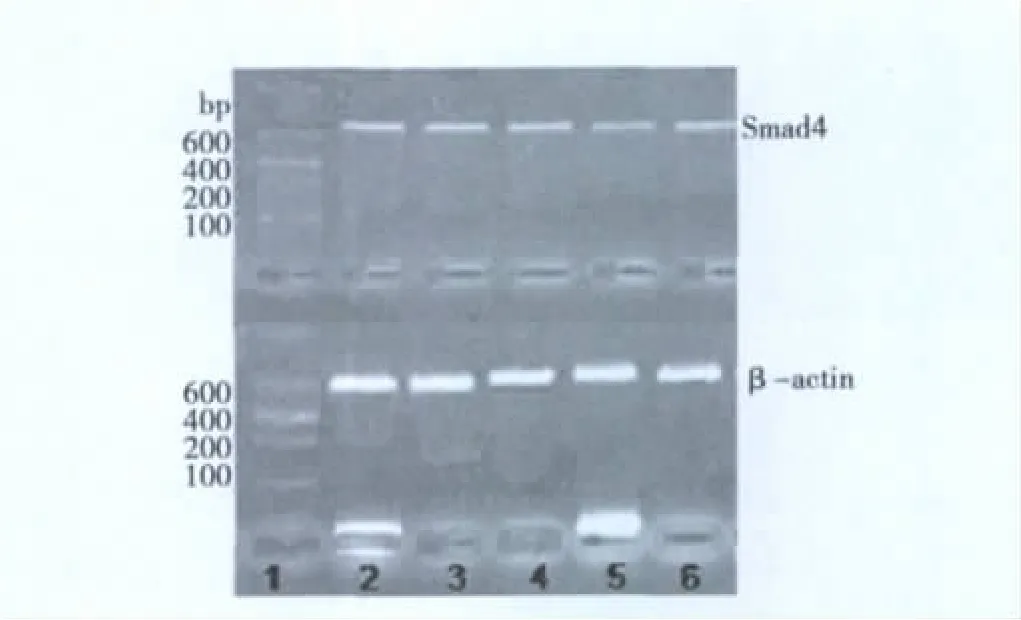
图1 肝组织中Smad4 mRNA表达的变化

图2 肝组织中Smad4表达(×100)

表1 肝组织Smad4、Smad7表达的变化(x ± s,n=20)
2.2 大鼠肝组织Smad7表达 RT-PCR检测正常肝组织未见明显Smad7 mRNA阳性表达细胞,红景天干预性治疗组大鼠肝组织Smad7 mRNA阳性率高于模型组(P<0.01);免疫组化染色可见,正常大鼠肝组织未检出Smad7表达,模型组大鼠肝组织只有少量细胞出现Smad7阳性表达,棕黄色阳性颗粒定位于细胞质,阳性细胞主要位于汇管区,以梭状的间质细胞为主,肝细胞未见明确阳性反应。红景天干预性治疗组大鼠肝组织Smad7蛋白阳性率高于模型组(P<0.01)。见表1,图3、图4。

图3 肝组织中Smad7 mRNA表达的变化

图4 肝组织中Smad7表达(×100)
3 讨论
治疗肝纤维化的研究是国内外的热点课题。近年来分子生物学、分子病理学、分子药理学等边缘学科的快速发展使人们对肝纤维化发生机制的认识不断深化。Smads蛋白家族是近年来发现的新的细胞内信号转导蛋白。大量研究证实TGFβ-Smad信号通路是肝纤维化时主要的信号转导通路〔2~4〕。根据Smads蛋白在TGF-β家族信号转导中的作用,将其分为3类:①受体激活型 Smads(R-Smads),包括 Smad2、Smad3以及Smad1、Smad5、Smad8 和 Smad9,能被 TGF-βⅠ型受体(TβRI)激活并与受体形成短暂复合物〔5〕;②共同通路型 Smads(Co-Smad),目前只有Smad4,主要通过与受体激活型Smads相连,从而参与信号转导〔6〕;③抑制型Smads(I-Smads),包括Smad6和Smad7,可与激活的Ⅰ型受体结合,抑制或调节TGF-β家族的信号转导〔7〕。TGF-β1是导致组织纤维化最重要的调节因子,与胞膜表面的TβRⅡ结合后,激活TβRⅠ,使Smad2、Smad3磷酸化而活化,继而与Smad4结合形成复合物,将信号从细胞质转移至细胞核〔8,9〕。Smad7则可抑制Smads复合物的形成或抑制Smad2、Smad3磷酸化而阻止该信号转导过程。
近年来,有关中草药对肝纤维化的防治报道较多,但红景天对肝纤维化TGFβ-Smad信号通路及Smads影响的研究报道甚少。本文应用半定量RT-PCR与免疫组化的方法,分别从mRNA与蛋白表达水平观察红景天对纤维化肝组织中Smad4、Smad7表达的影响,结果显示模型组中的Smad4蛋白表现为持续性高表达,且主要分布于非实质细胞,说明Smad4在纤维化肝脏主要来源于产生ECM的非实质细胞。可见Smad4表达增加及随后导致的Smads复合物在非实质细胞核内信号传导的增加,最终诱导了非实质细胞的ECM合成基因的转录,表明Smad4过度表达是TGF-β或TβRⅠ持续激活,引起ECM大量堆积的主要原因〔10〕。在纤维化肝脏中,Smad4除了分布于非实质细胞外,肝细胞中也有少量表达,可能是因为TGF-β在肝纤维化的发生中,除了通过刺激肝脏的非实质细胞增殖、合成ECM,还可作用于肝细胞,抑制其再生,诱导肝细胞凋亡〔11〕,从而放大肝损伤形成恶性循环,使纤维化加重;红景天可以较好防治CCl4损伤性肝纤维化,大鼠肝组织Smad4的表达减少,明显低于模型组,高于正常对照组;模型组中Smad7表现为全程持续性低表达,未见到反应性上调。用红景天干预后大鼠肝组织Smad7的表达逐渐增多,明显高于模型组,高于正常对照组。
本实验结果表明红景天通过抑制Smad4、促进Smad7的表达,保护纤维化肝组织内包括HSC在内的细胞周围正常的基底膜样细胞间质,抑制HSC的活化与肝纤维化的发展,从而有效地干预了TGFβ介导的肝纤维化信号传导过程,可能是其抗肝纤维化分子机制之一。
1 Kondou H,Mushiake S,Etani Y,et al.A blocking peptide for trans forming growth factor-beta1 activation prevents hepatic fibrosis in vivo〔J〕.J Hepatol,2003;39(5):742-8.
2 Benyon RC,Arthur MJ.Extracellular matrixdegradation and the role of hepatic stellate cells〔J〕.Semin Liver Dis,2001;21(2):373-84.
3 吴晓玲,曾维政.红景天甙对肝纤维化大鼠Samds基因表达的影响〔J〕.第四军医大学学报,2005;26(10):923-6.
4 Liu CH,Marianna DA,Gaca E,et al.Smads2 and 3 are differentially activated by transforming growth factor-β(TGF-β)in quiescent and activated hepatic stellate cells〔J〕.J Biol Chem,2003;278(13):11721-8.
5 Uemura M,Swenson ES,Marianna DA,et al.Smad2and Smad3 play different roles in rat hepatic stellate cell function andα-smooth muscle actin organization〔J〕.Mol Biol Cell,2005;16(113):4214-24.
6 Zhang BY,Zhang JY,Zhao K,et al.Expression of Smad4 and transforming growth factor-beta1,transforming growth factor-beta receptorⅡ in cholangiocarcinoma tissue and its biological significance〔J〕.Zhonghua Wai Ke Za Zhi,2005;43(6):846-9.
7 Saika S,Yamanaka O,Nishikawa-Ishida I,et al.Effects of Smad7 gene overexpression on transforming growth factorβ-induced retinal pigment fibrosis in a proliferative vitreoretinopathy mouse model〔J〕.Arch Ophthalmol,2007;125(5):647-54.
8 Liu Y,Wang LF,Zou HF,et al.Expression and location of Smad2,4 mRNAs during and after liver fibrogenesis of rats〔J〕.World JGastroenterol,2006;12:1577-82.
9 徐新保,何振平,梁志清,等.阻断转化生长因子-β1信号传导治疗大鼠实验性肝纤维化〔J〕.中华肝脏病杂志,2004;12(5):263-6.
10 Usui T,Takase M,Kaji Y,et al.Extracellular matrix production regulation by TGF-beta in corneal endothelial cells〔J〕.Invest Ophthalmol Vis Sci,1998;39(11):1981-9.
11 Herzer K,Ganten TM,Schulze-Bergkamen H,et al.Transforming growth factor beta can mediate apoptosis via the expression of TRAIL in human hepatoma cells〔J〕.Hepatology,2005;42(1):183-92.
——题《圣山系-金巅》

