岩茶水库岭肉桂中原花青素的高效液相色谱-串联质谱法分析
侯冬岩,刁全平,吴 寒,李铁纯,回瑞华,王顺明
(1.鞍山师范学院化学与生命科学学院,辽宁 鞍山 114007;2.武夷山市琪明茶叶科学研究所,福建 武夷山 354300)
原花青素广泛的存在于各种植物中,如葡萄、山楂、银杏、蓝莓等,近年来,该类化合物所体现的生物活性屡见报道,其清除自由基等作用引起了人们极大的关注[1-4]。我国原花青素的自然资源丰富,但是研究多处于植化研究阶段,有效成分的分离鉴定研究报道较少,开发的产品不多,其中研究最为广泛的为葡萄。原花青素是多酚化合物的聚合体,单体一般包括儿茶素、表儿茶素、表儿茶素没食子酸酯及它们3个自身或相互形成的二聚体。按聚合度的大小,通常将2~4聚体称为低聚体(简称OPC),将5聚体以上的称为高聚体(简称PPC),其中原花青素B2是自然界中最常见、研究的最多也是最重要二聚体[5-7]。4种原花青素类化合物的化学结构式示于图1。

图1 4种原花青素类化合物的结构式Fig.1 The structures of 4kinds of procyanidins
由于原花青素同时存在多种的聚合度和聚合方式,使得自身组成十分复杂[8]。目前还没有统一的质量控制方法,常用的分析方法有紫外分光光度法[9]、高效液相色谱法和高效液相色谱-质谱法[10-11]。但是这些分析方法测定茶叶中的原花青素都有较大的弊端,如紫外分光光度法只能测定原花青素的总成分,专属性不强,不能区分多酚的种类;由于茶叶中基质较为复杂,采用不能达到理想的原花青素分离,且保留时间长。
岩茶水库岭肉桂为乌龙茶,产于闽北“秀甲东南”的武夷山,茶树生长在岩缝之中,茶汤具有绿茶之清香,红茶之甘醇,是中国乌龙茶中之极品。有关岩茶水库岭肉桂的品质、产地特征、生产、加工和营养成分,陈睿等[12]已有论述,但因其基质复杂,且与原花青素结构类似的多酚类物质较多,所以其中原花青素的分析尚未见报道。本研究采用高效液相色谱-串联质谱技术,利用多重反应监测模式对岩茶水库岭肉桂样品中的原花青素组分进行定性和定量分析,为岩茶水库岭肉桂的进一步深入研究提供参考。
1 实验部分
1.1 仪器与试剂材料
1200型高效液相色谱仪、6410型串联三重四极杆质谱仪:美国安捷伦公司产品;XYA2-40-H型帕恩特纯水、超纯水机:北京湘顺源科技公司产品;BP211D型电子精密天平:德国赛多利天平有限公司产品;KQ-250DE型医用数控超声波清洗器:昆山市超声仪器有限公司产品;ZXZ型旋片式真空泵:上海玉龙真空泵厂产品;TDZ5-WS型台式自动平衡离心机:长沙湘仪离心机仪器有限公司产品。
儿茶素标准品(纯度>99%,色谱级,CAS:154-23-4)、表儿茶素标准品(纯度>99%,色谱级,CAS:490-46-0)、表儿茶素没食子酸酯标准品(纯度>99%,色谱级,CAS:1257-08-5):天津尖峰天然产物研究开发有限公司产品;原花青素B2标准品(纯度>99%,色谱级,CAS:1257-08-5):成都曼思特生物科技有限公司产品;甲酸、乙腈(色谱纯):北京化工厂产品;甲醇、无水乙醇、丙酮、乙酸乙酯(分析纯):北京化工厂产品;实验用水为超纯水。
样品:岩茶水库岭肉桂采于福建武夷山。
1.2 实验方法
1.2.1 标准储备液 分别精确称取5mg(精确到0.01mg)儿茶素、表儿茶素、表儿茶素没食子酸酯和原花青素B2标准品,置于10mL容量瓶中,加乙腈稀释、溶解、定容至刻度,得到浓度为500mg/L标准品储备液,用0.22μm有机系微孔滤膜过滤,滤液置于-4℃避光保存,备用。
1.2.2 样品前处理 精密称取0.5g(精确到0.000 1mg)干燥粉碎的样品,置于50mL具塞锥形瓶中,准确加入12.5mL 80%甲醇,于30℃下超声40min提取,提取液经抽滤过滤,除去提取时的残渣,将滤液以5 000r/min离心10min,上清液经滤纸过滤后用80%甲醇定容至50mL容量瓶中,再用0.22μm有机系微孔滤膜过滤,供高效液相色谱-串联质谱分析[13]。
1.2.3 色谱条件 色谱柱 Waters SunFire-C18柱(150mm×2.1mm×5μm);流动相:A 为0.1% 甲 酸 水 溶 液,B 为 乙 腈;流 速 0.25 mL/min,柱温25℃;进样量3μL;梯度洗脱程序列于表1[14-16]。
1.2.4 质谱条件 电喷雾离子化源(ESI),负离子扫描,多重反应监测,毛细管电压-3 500 V,雾化气压力350kPa,干燥气温度350℃,干燥气流量6L/min,碰撞能量30V。

表1 梯度洗脱程序Table 1 Gradient elution program
1.2.5 HPLC色谱分离 经1.2.1配制的混合标准溶液和经1.2.2处理的样品进行稀释后,在1.2.3条件下液相色谱图示于图2。
比较原花青素标准样品及样品的HPLC色谱图的保留时间,对岩茶水库岭肉桂样品中的原花青素组分进行初步分析。由图可以看出,样品中含有儿茶素、表儿茶素、表儿茶素没食子酸酯和原花青素B2。

图2 原花青素标准品(a)和样品(b)的HPLC图Fig.2 The HPLC of the proanthocyanidins standard(a)and the sample(b)
1.2.6 质谱分析 由HPLC的分析结果,利用与标准品比对初步判定样品中含有儿茶素、表儿茶素、表儿茶素没食子酸酯和原花青素B2,在质谱分析中,采用多重反应监测模式对上述的初步判定进行确认。4种原花青素的质谱谱图示于图3。
从图3(a)~3(c)可见,原花青素单体的质谱图主要产生准分子离子,碎片离子相对较少。图3(d)除产生准分子离子外,还产生了一系列碎片离子。在碰撞能量为30V时,分别对儿茶素、表儿茶素、表儿茶素没食子酸酯和原花青素B2进行子离子扫描,其质谱图示于图4。
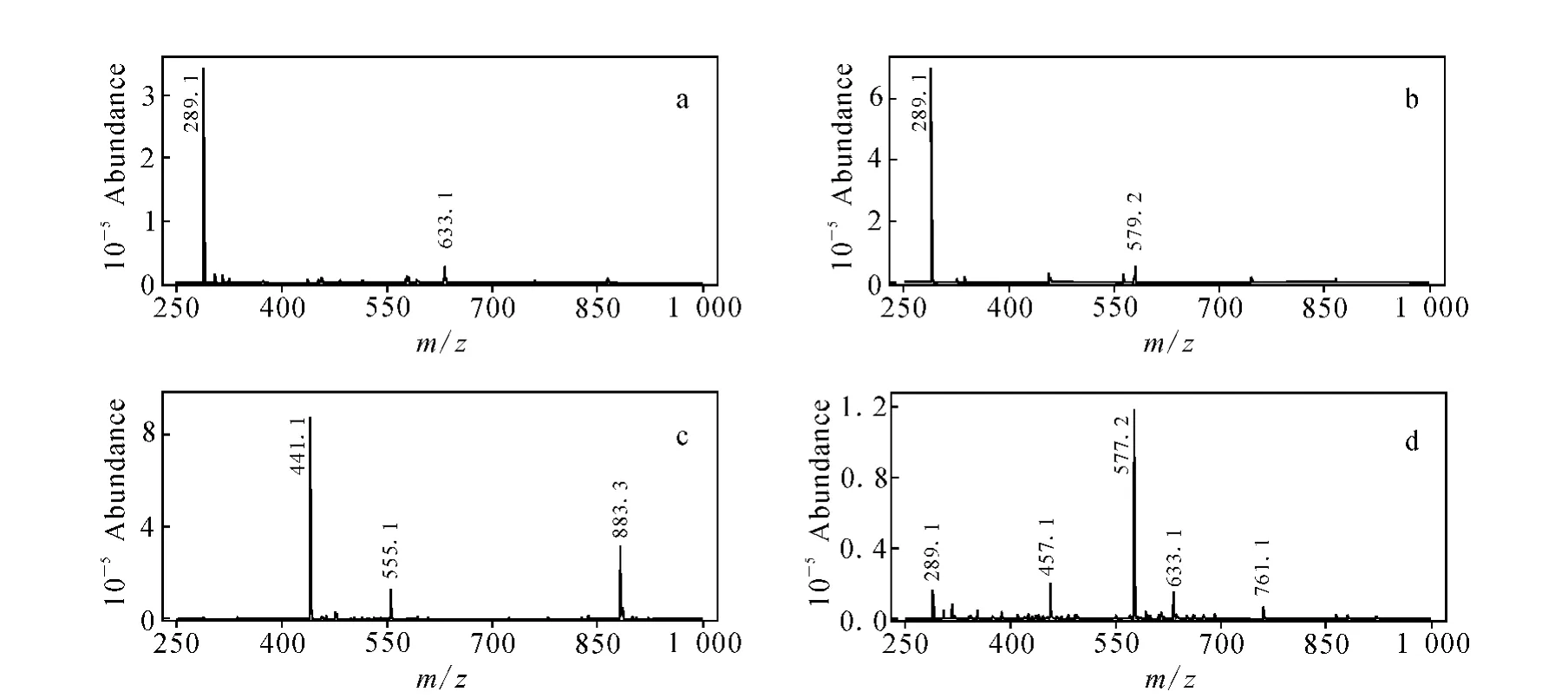
图3 儿茶素(a)、表儿茶素(b)、表儿茶素没食子酸酯(c)和原花青素B2(d)的质谱图Fig.3 Mass spectrum of catechin(a),epicatechin(b),epicatechin-3-O-gallate(c)and proanthocyanidin B2(d)
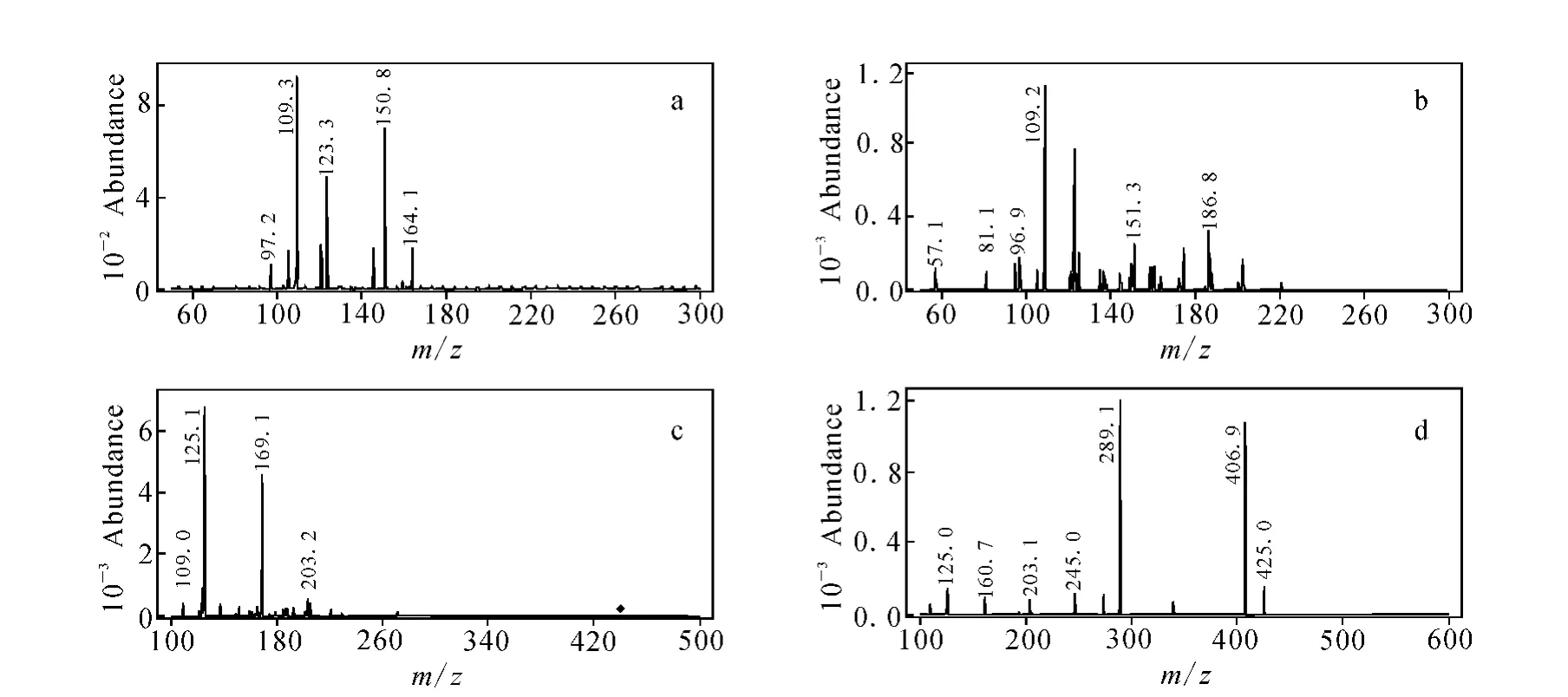
图4 儿茶素(a)、表儿茶素(b)、表儿茶素没食子酸酯(c)和原花青素B2(d)的离子质谱图Fig.4 Mass spectrum of production of catechin(a),epicatechin(b),epicatechin-3-O-gallate(c)and proanthocyanidin B2(d)
通过一级质谱选择一定质量母离子,与气体碰撞断裂后,再经二级质谱选择一定质量的子离子,这样大大提高了分析的选择性,同时也改善了信噪比,特别适合于复杂组分体系且干扰严重的样品中低含量组分的分析。由图3、图4可确定儿茶素、表儿茶素、表儿茶素没食子酸酯和原花青素B2的定性和定量离子对,列于表2。
1.2.7 标准曲线的绘制 从1.2.1配制的4种原花青素的混合标准品储备液中精确移取0.10、0.20、0.40、1.0、2.0、3.0mL 于10mL 和50 mL容量瓶中,用乙腈定容至刻度。配制好的标准溶液进样前分别通过0.22μm有机系微孔滤膜过滤,在1.2.3条件下进样,记录峰面积。以原花青素的质量浓度为横坐标,以峰面积为纵坐标,绘制标准曲线,其回归方程列于表3。线性范围为:儿茶素1.00~10.0mg/L;表儿茶素10.0~100mg/L;表儿茶素没食子酸酯50.0~150mg/L;原花青素B25.00~30.0mg/L。
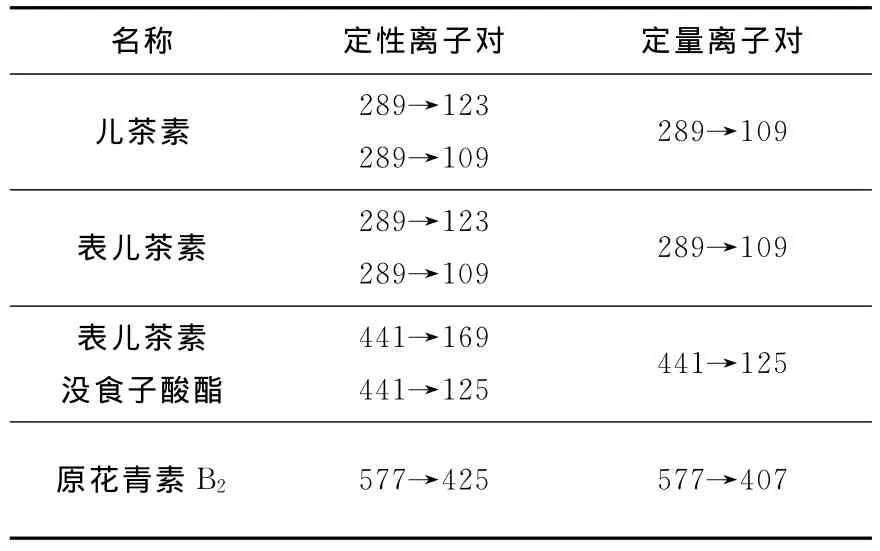
表2 4种原花青素的定性及定量离子对Table 2 The ion-pair of quantitative and qualitative of four oligomeric proanthocyanidins

表3 原花青素的回归方程Table 3 Regression equation of the procyanidins
2 结果与讨论
2.1 精密度实验
从1.2.1的4种原花青素标准品储备液中精确量取0.20mL制成10.00mg/L溶液,通过0.22μm有机系微孔滤膜过滤,在1.2.3条件下进样,记录峰面积。相同条件下测定7次,求得其相对标准偏差,结果列于表4。
2.2 回收率实验
取1.2.2相同浓度的样品,分别加入3个不同浓度的儿茶素、表儿茶素、表儿茶素没食子酸酯和原花青素B2的标准品溶液,在1.2.3条件下分别进样,记录峰面积。计算该方法下测定4种原花青素的方法回收率,结果列于表5。
2.3 方法检出限
取1.2.1的4种原花青素标准品溶液,连续稀释并通过0.22μm有机系微孔滤膜过滤,在1.2.3条件下进样,当响应值为基线噪音的2倍时,测其峰面积。计算此时该标准品溶液浓度即为最低检出限。儿茶素、表儿茶素、表儿茶素没食子酸酯、原花青素B2的检出限分别为0.013 2、0.012 4、0.008 5、0.005 5mg/L。
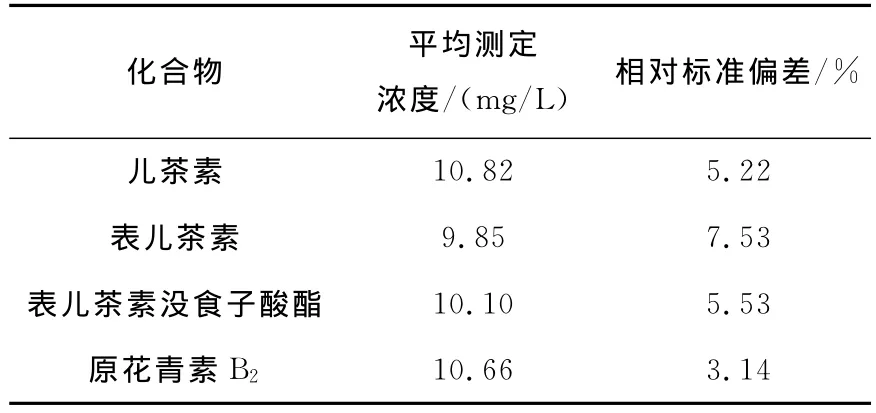
表4 精密度实验Table 4 Precision experiment

表5 方法的回收率Table 5 Recovery of the method
2.4 样品测定
按照1.2.2的方法处理3批武夷山岩茶水库岭肉桂样品,在1.2.3条件下每批分别进样3次,记录峰面积并代入回归方程,得到的武夷山岩茶水库岭肉桂原花青素的含量列于表6。

表6 样品的测定Table 6 Determination of samples(n=3,¯x±s)
3 结论
本研究采用高效液相色谱-串联质谱技术,利用多重反应监测模式对岩茶水库岭肉桂样品中的原花青素组分进行定性和定量分析,可以有效的消除茶叶中复杂基质的干扰,并对茶叶中的原花青素可进行逐一的定性及定量分析。实验结果表明,武夷岩茶水库岭肉桂中含有丰富的原花青素类化合物儿茶素、表儿茶素、表儿茶素没食子酸酯和原花青素B2。
[1] 吕丽爽.天然抗氧化剂低聚原花青素的研究进展[J].食品科学,2002,23(2):147-149.
[2] SOUQUET J M,CHEYNIER V I,BROSSAUD F,et al.Polymeric proanthocyan-idins from grape seeds[J].Phytochemistry,1996,43:509-512.
[3] TORRES J L,VARELA B,GARCIA M T,et al.Valorization of grape (vitis viniferal )by products.Antioxidant and biological properties of polyphenolic fractions differing in procyanidin composition and flavonol content[J].J Agric Food Chem,2002,50(26):7 548-7 555.
[4] BUELGA S,SCALBERT C A.Review:Proanth-ocyanidins and tannin-like compounds nature,occurrence,dietary intake and effects on nutrition and health[J].J Sci Food Agric,2000,80(7):1 094-1 117.
[5] 凌志群.莲房原花青素及其生物、药理活性成分[D].武汉:华中农业大学,2001.
[6] SMITH B E.Astringent tannins of the leaves ofGeraniumspecies[J].Phytochemistry,1981,20(3):211-216.
[7] 姚育翠.玫瑰花中原花青素的分离分析及抗氧化活性的研究[D].浙江:浙江大学,2008.
[8] 暴悦梅,佟永薇,章勤学.葡萄籽中原花青素的研究[J].食品研究与开发,2010,31(1):185-186.
[9] 杨晓辉,汪 岭.紫外分光光度法分析测定“黑美人”土豆原花青素[J].安徽农业科学,2010,38(25):13 643-13 644.
[10] 刁海鹏,孙体健,姬小蕾,等.高效液相法测定爬山虎红色素中原花青素含量[J].现代食品科技,2009,25(5):566-567.
[11] LAZARUS S A,ADAMSON G E,HAMMERSTONE J F,et al.High performance liquid chromatography-mass spectrometry analysis of proant hocyanidins in foods and beverages [J].J Agric Food Chem,1999,4(1):3 693-3 701.
[12] 陈 睿.茶叶功能性成分的化学组成及应用[J].安徽农业科学,2004,32:1 031-1 033.
[13] 侯冬岩,回瑞华,李铁纯.高效液相色谱法对绿茶中茶多酚含量的测定[J].食品科学,2010,31(24):305-307.
[14] 何忠梅,孙佳明,张 辉,等.固相萃取-高效液相色谱-电喷雾串联质谱法分析芍药和酒芍药的水溶性化学成分[J].分析化学,2009,37(8):1 201-1 205.
[15] 廖 杰,宋玉乔,赵玉兰,等.液相色谱-串联质谱法测定植物油中的6种儿茶素[J].现代仪器,2008,14:35-37.
[16] 任其龙,魏冠红,金米聪,等.反相高效液相色谱-电喷雾质谱法鉴定葡萄籽低聚原花青素[J].食品与发酵工业,2006,32(3):79-85.

