丝素蛋白和乳酸-己内酯共聚物纳米纤维支架构建组织工程化角膜上皮的实验研究△
李纲 钱婷婷 洪佳旭 徐建江 吴继红 崔呈俊 莫秀梅
角膜病是我国的重要致盲性眼病。同种异体角膜移植术是目前临床上治疗角膜盲最有效的方法。但是,角膜移植的供体来源极其匮乏,而且术后经常会发生排斥反应、各种并发症和潜在的疾病传播等问题,因此严重限制了其在临床上的应用。
随着组织工程学技术在角膜重建上的广泛应用,组织工程角膜成为一种极具前景的角膜替代品。其中,又以组织工程角膜上皮层的构建发展最为迅速。构建组织工程角膜上皮的基本方法是取少量健康组织,获取干细胞并进行体外扩增后,将其接种在生物相容性良好的支架材料上,在体外形成结构与正常角膜上皮相似的细胞材料复合物,再移植到患者的眼表。理想的支架材料是成功构建组织工程角膜上皮的关键。目前,常用于组织工程角膜上皮的支架材料有羊膜、纤维蛋白胶、温敏材料等。其中,由于羊膜具有良好的生物相容性、抑制炎症及新生血管等优点,在临床上广泛应用。然而,羊膜是一种同种异体的生物材料,存在着一些缺点,包括潜在的传播疾病的风险、来源有限、特殊的保存条件等;而由天然材料和人工合成高分子材料组成的复合支架材料可以克服以上这些缺点。丝素蛋白(silk fibroin,SF)是蚕丝的主要成分,具有良好的生物相容性,在体内可以被蛋白酶完全降解[1-2]。近期,有学者[3-8]研究报道,角膜上皮细胞能够在SF支架上生长增殖。乳酸-己内酯共聚物[poly(L-lactic acid-co-ε-caprolactone),PLCL]是 L-乳酸和 ε-己内酯的共聚物,具有良好的生物相容性、可降解性以及良好的力学性能,因而广泛应用于生物医学领域,诸如外科手术缝合线、药物载体及组织工程支架等[9]。目前关于SF-PLCL复合材料用做构建组织工程角膜上皮的研究报道较少。本课题组的前期研究,证实用8%的SF-PLCL共混物(质量比25∶75)静电纺的纳米纤维支架更有利于内皮细胞的增殖[10]。本研究拟通过利用天然材料(SF)混合人工合成高分子材料(PLCL)和静电纺丝技术,制作出具有良好生物相容性、较好三维结构的角膜上皮组织工程支架材料,并通过研究兔角膜缘上皮细胞在SF-PLCL纳米纤维薄膜上的黏附、增殖和分化情况,探讨SF-PLCL纳米纤维薄膜作为组织工程角膜上皮支架材料的可行性。
1 材料与方法
1.1 再生丝素的提取 蚕茧去蛹,剪碎,放入0.5%(w/v)的碳酸钠水溶液中100℃煮沸3次,每次30min;用蒸馏水充分冲洗脱胶的蚕丝,干燥后用三元溶剂[CaCl2∶C2H5OH∶H2O=1∶2∶8(摩尔比)]在70 ℃溶解1 h,冷却后装入透析袋 (250-7u,Sigma公司,美国);然后用蒸馏水透析3 d,过滤,冷冻干燥得到SF海绵。
1.2 SF-PLCL纳米纤维支架的制作 将SF和PLCL(50∶50)以质量比25∶75,以六氟异丙醇(HFIP)为溶剂,配制总浓度为8%(g/mL)的混合溶液,室温下搅拌过夜,获得纺丝液。将纺丝液注入2.5mL的注射器中,注射器的金属针头内径为0.21mm。纺丝参数为:电压12 kV、给液速率1.2mL/h、接收距离12~15cm。于室温下纺丝,获得SF-PLCL纳米纤维膜,真空干燥,进行退火处理:-80 kPa,水蒸气处理6 h,自然干燥。
1.3 兔角膜缘上皮细胞培养及接种 取雌性健康新西兰大白兔(上海市银根养兔室提供),体质量2.5~3 kg,以空气栓塞法处死。无菌条件下迅速摘取眼球,用磷酸盐缓冲液(phosphate-buffered saline,PBS)反复冲洗后,浸泡于含青霉素100 U/mL、链霉素100 μg/mL的PBS中10min。在超净工作台内将眼球用PBS冲洗2~3次,取角膜缘环,用2.5mg/mL的DispaseⅡ(Roche,美国)4℃消化过夜;在解剖镜下分离出上皮片,再用0.25%胰蛋白酶和0.02%EDTA 37℃消化10min,加含10%胎牛血清的达尔伯克改良伊格尔(DMEM)培养液终止消化;相对离心力为200×g离心5min,收集细胞沉淀物。用K-SFM(Invitrogen公司,美国)培养液重悬细胞,以5×105细胞/mL接种于丝裂霉素处理过的3T3培养瓶中,置37℃、5%CO2培养箱中培养;3 d后首次换液,以后每3 d更换1次。
1.4 兔角膜缘上皮细胞接种于SF-PLCL材料 SFPLCL材料在75%乙醇中处理30min,PBS充分漂洗后,K-SFM培养液中浸泡过夜。取第一代兔角膜缘上皮细胞悬液(5×105细胞/cm2)接种于SF-PLCL纳米纤维膜上,置37℃、5%CO2培养箱中培养,每3 d更换1次。
1.5 扫描电镜 细胞材料复合物培养7 d后,用PBS轻轻冲洗,2%戊二醛室温固定30min后,按以下步骤进行处理:PBS漂洗3次,1%锇酸固定45min,PBS漂洗3次,乙醇梯度脱水,丙酮/醋酸异戊脂(1∶1)10min,醋酸异戊脂30min,临界点干燥,喷金,用扫描电镜(JSM6390LV,JEOL公司,日本)观察。由中国科学院上海有机研究所协助检查。
1.6 免疫荧光 细胞材料复合物培养3 d后,用PBS漂洗后,4%多聚甲醛固定30min,PBS漂洗3次,每次5min,1%山羊血清封闭30min。再分别用小鼠抗兔K3单克隆抗体(Chemicon公司,美国)、小鼠抗兔Integrin β1单克隆抗体(Chemicon公司,美国)4℃过夜;PBS漂洗3次,每次5min;Alex Fluor 488山羊抗小鼠荧光二抗(invitrogen公司,美国)37℃作用30min,PBS漂洗3次,每次5min;PI衬染细胞核,PBS漂洗,封片后在荧光显微镜(DMI3000B,Leica,德国)下观察。
1.7 细胞活力检测 细胞材料复合物培养14 d,用PBS漂洗后,用含1mmol/L Calcein AM(eBioscience公司,美国)和 2.5mg/mL PI(invitrogen公司,美国)的PBS置37℃孵育15min,用激光共聚焦显微镜(SP5Ⅱ型,Leica,德国)观察。
2 结果
SF-PLCL纳米纤维膜的扫描电镜(图1)显示纳米纤维呈随机分布,孔与孔之间互相连通,纳米纤维的平均直径是(715±186)nm。由图2可见湿润的 SFPLCL纳米纤维膜的光学透明度与羊膜相当。

图1.SF-PLCL纳米纤维膜扫描电镜(×200)
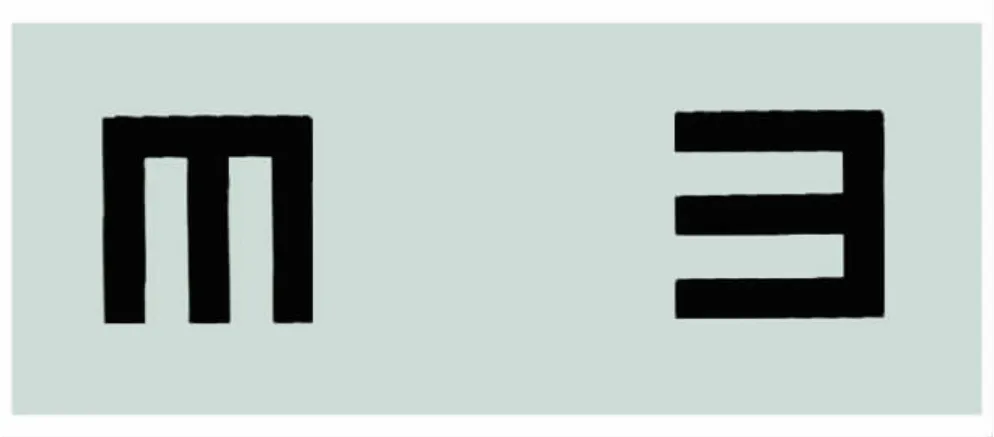
图2.SF-PLCL纳米纤维膜和羊膜的光学透明度从左到右依次为羊膜和SF-PLCL纳米纤维膜
原代培养的兔角膜缘上皮细胞通过倒置显微镜观察,呈铺路石样形态生长,细胞体积小,核质比高(图3),表明细胞生长状态良好。扫描电镜(图4)观察显示兔角膜缘上皮细胞在SF-PLCL纳米纤维膜上也呈铺路石样形态黏附生长,在细胞表面分布着许多微绒毛,细胞与细胞之间紧密连接,说明材料具有良好的生物相容性。免疫荧光检测显示(图5),在SF-PLCL纳米纤维膜上生长的兔角膜缘上皮细胞K3蛋白表达为阳性,说明细胞可以分化为成熟的角膜上皮细胞。通过细胞活力检测(图6),显示细胞在SF-PLCL纳米纤维膜上均匀分布,未见明显的死细胞(红色荧光),多表现为活细胞(绿色荧光)。利用激光共聚焦显微镜的三维重建技术,可以观察到标本的断层(图6),显示细胞在材料上呈多层,有呈上皮层化结构的趋势,进一步说明材料具有良好的生物相容性。

图3.倒置显微镜下原代兔角膜缘上皮细胞形态(×100,培养10 d后)
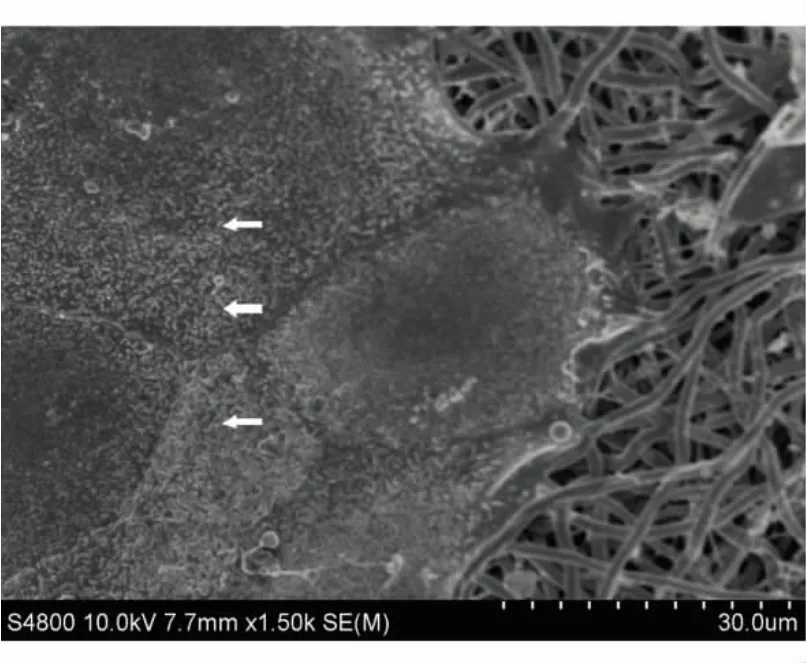
图4.兔角膜缘上皮细胞在SF-PLCL纳米纤维膜生长的扫描电镜(×1500,培养7 d后)

图6.兔角膜缘上皮细胞在SF-PLCL纳米纤维膜上的活力检测(×100,培养14 d后)
3 讨论
角膜上皮重建一直是组织工程领域研究的热点之一。利用具有不同性质的复合材料构建组织工程支架已成为一种趋势。本实验通过结合SF与PLCL两种不同材料的方法,综合两者的优点,构建出一种适合角膜上皮生长的组织工程支架材料。SF是蚕丝的主要成分,来源丰富,在临床上用做手术缝线已使用多年。由于其具有良好的生物相容性、可降解性、良好的透气和免疫原性低等优异的性能,广泛应用于组织工程领域。近期,已有多篇文献[3-8]报道证实角膜上皮细胞可以在丝素蛋白支架材料上黏附、增殖、生长。然而单一组分的SF纳米纤维脆性大,柔韧性差。PLCL是L-乳酸和ε-己内酯的共聚物,聚乳酸(PLLA)和聚ε-己内酯(PCL)都是经美国食品和药物管理局批准的生物材料,在医学领域应用广泛。PLCL更是具有两者的优点,PLLA生物降解度速度快,PCL生物降解度慢,因此,可通过调节两者的合成比例,以获得适合的降解速度,最终与角膜上皮组织工程的要求相匹配。PLCL的力学性能优良,延展率高。已有学者[11]报道角膜上皮细胞可以在PLLA混合明胶的纳米纤维膜上良好生长。还有学者[12-14]报道角膜上皮细胞、结膜上皮细胞和视网膜色素细胞都可以在PCL支架材料上良好生长。而目前对PLCL用做组织工程角膜上皮支架的研究鲜有报道。本研究中,我们应用静电纺丝技术,将SF与PLCL共混电纺制作出SF-PLCL共混纳米纤维膜材料,作为角膜上皮组织工程的支架材料。如图2所示,SF-PLCL纳米纤维膜材料具有较好的光学透明度,与羊膜的透明度相当。扫描电镜(图4)证实兔角膜缘上皮细胞在SF-PLCL纳米纤维膜上生长良好。
角膜上皮基底膜是由胶原蛋白、层粘连蛋白和其他蛋白互相编织的纤维和孔隙构成的三维网状纳米结构[15]。静电纺丝是将高分子聚合物制备成纳米级纤维的有效方法。利用静电纺丝技术电纺获得的纤维膜纤维直径和孔径可以达到纳米级,制备的纳米纤维支架可以仿生天然细胞外基质的结构,具有高的比表面积、高的孔隙率,有利于细胞的黏附、增殖、迁移和分化。SF-PLCL纳米纤维膜的扫描电镜(图1),显示纳米纤维的平均直径是(715±186)nm。,孔与孔之间互相贯通,纤维之间交错排列呈三维空间。兔角膜缘上皮细胞紧密地黏附在SF-PLCL纳米纤维膜上(图4),并阳性表达成熟角膜上皮细胞的标记蛋白K3(图5)。同时,还观察到有部分细胞未表达K3蛋白。由于本实验的细胞取自角膜缘的部位,有可能是未分化的干细胞及龛细胞,有待进一步研究证明。激光共聚焦显微镜(图6)显示,角膜缘上皮细胞在材料上分布均匀,呈2~3层的多层结构,类似于正常角膜上皮组织的层化结构。这些结果表明,SF-PLCL纳米纤维膜很好地模拟了细胞外基质,促进角膜缘上皮细胞的分化。
在未来的研究中,我们还需要进一步完善该组织工程角膜上皮的相关动物实验,明确其临床疗效及安全性,为最终开发一种成熟且可靠的角膜上皮层替代物奠定更为有力的实验基础。
[1]Acharya C,Ghosh SK,Kundu SC.Silk fibroin protein frommulberry and non-mulberrysilkworms:cytotoxicity,biocompatibility and kinetics of L929 murine fibroblast adhesion[J].J Mater Sci Mater Med,2008,19(8):2827-2836.
[2]Wang Y,Rudym DD,Walsh A,et al.In vivo degradation of threedimensional silk fibroin scaffolds[J].Biomaterials,2008,29(24/25):3415-3428.
[3]Chirila T,Barnard Z,Zainuddin,et al.Bombyx mori silk fibroin membranes as potential substrata for epithelial constructs used in the management of ocular surface disorders[J].Tissue Eng Part A,2008,14(7):1203-1211.
[4]Bray LJ,George KA,Hutmacher DW,et al.A dual-layer silk fibroin scaffold for reconstructing the human corneallimbus[J].Biomaterials,2012,33(13):3529-3538.
[5]Higa K,Takeshima N,Moro F,et al.Porous Silk Fibroin Film as a Transparent Carrier for Cultivated Corneal Epithelial Sheets[J].J Biomater Sci Polym Ed,2011,22(17):2261-2276.
[6]Bray LJ,George KA,Ainscough SL,et al.Human corneal epithelial equivalents constructed on Bombyx mori silk fibroin membranes[J].Biomaterials,2011,32(22):5086-5091.
[7]Liu J,Lawrence BD,Liu A,et al.Silk fibroin as a biomaterial substrate for corneal epithelial cell sheet generation[J].Invest Ophthalmol Vis Sci,2012,53(7):4130-4138.
[8]Lawrence BD,Marchant JK,Pindrus MA,et al.Silk film biomaterials for cornea tissue engineering[J].Biomaterials,2009,30(7):1299-1308.
[9]Huang HH,He CL,Wang HS,et al.Preparation of core-shell biodegradable microfibers for long-term drug delivery[J].J Biomed Mater Res A,2009,90(4):1243-1251.
[10]Zhang K,Wang H,Huang C,et al.Fabrication of silk fibroin blended P(LLA-CL)nanofibrous scaffolds for tissue engineering[J].J Biomed Mater Res A,2010,93(3):984-993.
[11]Yan J,Qiang L,Gao Y,et al.Effect of fiber alignment in electrospun scaffolds on keratocytes and corneal epithelial cells behavior[J].J Biomed Mater Res A,2011,100A(2):527-535.
[12]Sharma S,Mohanty S,Gupta D,et al.Cellular response of limbal epithelial cells on electrospun poly-epsilon-caprolactone nanofibrous scaffolds for ocular surface bioengineering:a preliminary in vitro study[J].Mol Vis,2011,17:2898-2910.
[13]Ang LP,Cheng ZY,Beuerman RW,et al.The development of a serum-free derived bioengineered conjunctival epithelial equivalent using an ultrathin poly(epsilon-caprolactone)membrane substrate[J].Invest Ophthalmol Vis Sci,2006,47(1):105-112.
[14]Redenti S,Tao S,Yang J,et al.Retinal tissue engineering using mouse retinal progenitor cells and a novel biodegradable,thin-film poly(e-caprolactone)nanowire scaffold[J].J Ocul Biol Dis Infor,2008,1(1):19-29.
[15]Abrams GA,Schaus SS,Goodman SL,et al.Nanoscale topography of the corneal epithelial basement membrane and Descemet's membrane of the human[J].Cornea,2000,19(1):57-64.

