C8磁纳米颗粒分离检测湘江水中菊酯类农药残留
尹艳凤,黄淑芳,李 波,李倦生
(长沙环境保护职业技术学院,长沙 410004)
0 引 言
拟菊酯类农药是广谱性杀虫剂,具有高效、低毒、低残留、对作物安全等特点,除对140多种害虫防治有特效外,有些菊酯类农药还对地下害虫和螨类害虫有较好的防治效果[1-3].随着拟除虫菊酯农药的广泛和长期使用,其所带来的环境污染和食品问题也日益严重.由于该类化合物有亲脂性和环境持久性,会导致水生态系统结构改变和功能破坏,目前各国及国际组织先后制定了菊酯类农药的最大残留限量标准,七氟菊酯、联苯菊酯、氯氰菊酯、氰戊菊酯、溴氰菊酯属于使用较多的高效中等毒性的拟除虫菊酯类农药,我们对湘江水中这五种拟除虫菊酯的含量进行了测定.
由于湘江水中菊酯类含量较低,必须经过基质转化及浓缩才能达到仪器的检出限,目前测定水中菊酯类含量的样品前处理方法有液液萃取[4]、固相萃取[5-6]等,但这些方法大多具有以下特点:浓缩方法繁琐、有机溶剂用量大,样品分析周期较长[7-10]等特点,为了克服这些问题,本文合成了一种C8包裹的磁纳米颗粒为固相萃取材料,一步浓缩湘江水中的菊酯类农残、同时达到溶剂转化的目的,大大缩短了样品分析周期,简化了浓缩流程,降低了有机溶剂的用量.
1 实验部分
1.1 试剂及仪器
所有试剂均为分析纯,七氟菊酯、联苯菊酯、氟氯氰菊酯、溴氰菊酯等标准品购自国家标准物质中心,储备液为甲苯溶液,其浓度分别为1000μg/mL,并在4℃避光保存,使用液用甲醇配制,现配现用.甲苯、丙酮、六水合三氯化铁、四水合氯化亚铁、氨水、吐温-40均来自北京化学试剂厂.水样品取自湘江水.岛津QP-2010气相色谱仪(带ECD检测器).
1.2 色谱工作条件:
色谱分析条件:DB-5弹性石英毛细管色谱柱(50m×0.25mm×0.25μm),不分流进样,恒流模式,柱内流速:1mL/min,进样口温度:290℃,检测器温度:300℃,尾吹气流速:60mL/min,柱温:150℃(保持1min)以25℃/min升温速度升至200℃,再以3℃/min升温速度升至280℃(保持25min)
2 实验部分
2.1 C8-Fe3O4的合成
Fe3O4磁性粒子通过化学共沉淀法制备[11],具体流程如下:首先将11.0克FeCl3·6H2O,5.0克的FeCl2·4H2O溶解在150mL去离子水中(去离子水事先用氮气脱气),并滴加25%氨水至溶液的pH为9.5左右,在不断搅拌下,60℃反应2h.反应完成后,通过磁铁分离获得的四氧化三铁颗粒,然后用去离子水清洗数次,最后置于60℃下真空干燥16h,得到Fe3O4磁纳米粒子.
取2.0g Fe3O4磁纳米粒子分散在30mL甲苯中,加入10mL正辛基三乙氧基硅烷,超声20min,于120℃搅拌16h,反应结束后,获得的C8-Fe3O4微粒通过磁铁分离,并用甲醇清洗.最终产物被置于真空干燥箱中,于60℃下干燥待用.
2.2 样品萃取与富集
用甲醇和超纯水轮流冲洗活化C8-Fe3O4后加入湘江水样品溶液中.在室温下经过超声振荡5 min使之呈均匀分散状态.通过外加磁场快速使磁纳米颗粒从溶液中快速分离.弃去上层溶液后,被吸附在磁颗粒上的菊酯类农药通过3×2mL的乙腈洗脱,收集所有洗脱液氮吹至近干并最终复溶于200μL的乙腈中,备用.
3 结果讨论
为了得到最佳分离提纯效率,提供分析准确度和灵敏度,我们对萃取过程中吸附剂用量、萃取时间和样品平衡时间等条件进行了优化.
3.1 吸附剂用量的优化
由于C8-Fe3O4的表面积大,吸附性能高,理论上极少量的吸附剂用量就能得到满意的萃取效率,本文对C8-Fe3O4的用量进行了优化,从图1可见,当吸附剂用量从20mg增加到50mg时,样品的回收率逐渐提高,但吸附剂用量增加到50mg以上时,样品的回收率基本保持不变,因此我们选用50 mg的吸附剂进行下一步的分析.

图1 吸附剂用量对菊酯类农残回收率的影响标样加入浓度:0.1μg/g
3.2 吸附平衡时间的优化
由于C8-Fe3O4的表面积大,在短时间内C8-Fe3O4与样品中的菊酯类农残就能达到吸附平衡,达到从水中富集菊酯类的目的,本实验对吸附平衡时间进行了优化,当吸附时间增加到10min时,如图2所示,吸附基本达到平衡,随着时间的增加,样品回收率基本不变,因此我们选用10min为样品吸附平衡时间.同时我们对吸附剂用量及吸附平衡时间的依赖性做了如下对照实验:同样是200mL的水样品,一份里面加入50mg C8-Fe3O4振荡10 min,另一份加入30mg C8-Fe3O4振荡30min,得到的回收率基本相当,这说明吸附剂C8-Fe3O4的吸附容量是非常大的,适当增加吸附剂用量可以缩短吸附平衡时间.
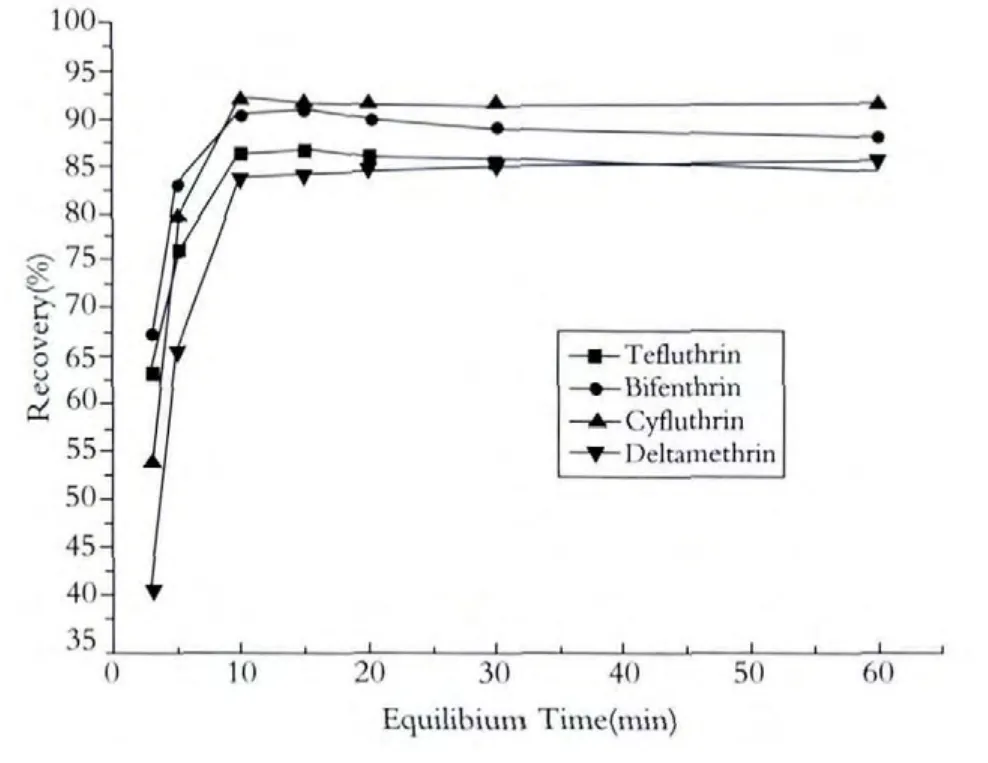
图2 平衡时间对菊酯类农残回收率的影响标样加入浓度:0.1μg/g
3.3 解析条件的选择
样品的解析条件包括解析溶剂种类及用量、解析时间等
3.3.1 解析溶剂种类的选择
由于菊酯类农残不溶于水,易溶于有机溶剂,而不同的有机溶剂的溶解能力不一样,为了能够有效地解析吸附在C8-Fe3O4上的农药残留,减少基质中有机杂质的干扰,本文选用了三种异丙醇、甲醇、乙腈、丙酮等有机溶剂对样品进行解析,结果发现异丙醇解析能力较弱,乙腈和丙酮解析较强,甲醇解析能力次之(如图3所示),造成这种现象可能与溶剂的极性有关,四种溶剂中,异丙醇的极性最弱,甲醇的极性最强,乙腈、丙酮的极性一般,由此可见,极性太强或者太弱都不利于菊酯类农残的解析,从解析后样品的色谱图上可见,丙酮解析的样品杂质远远多于乙腈解析的样品,因此本文选用乙腈为解析溶剂.
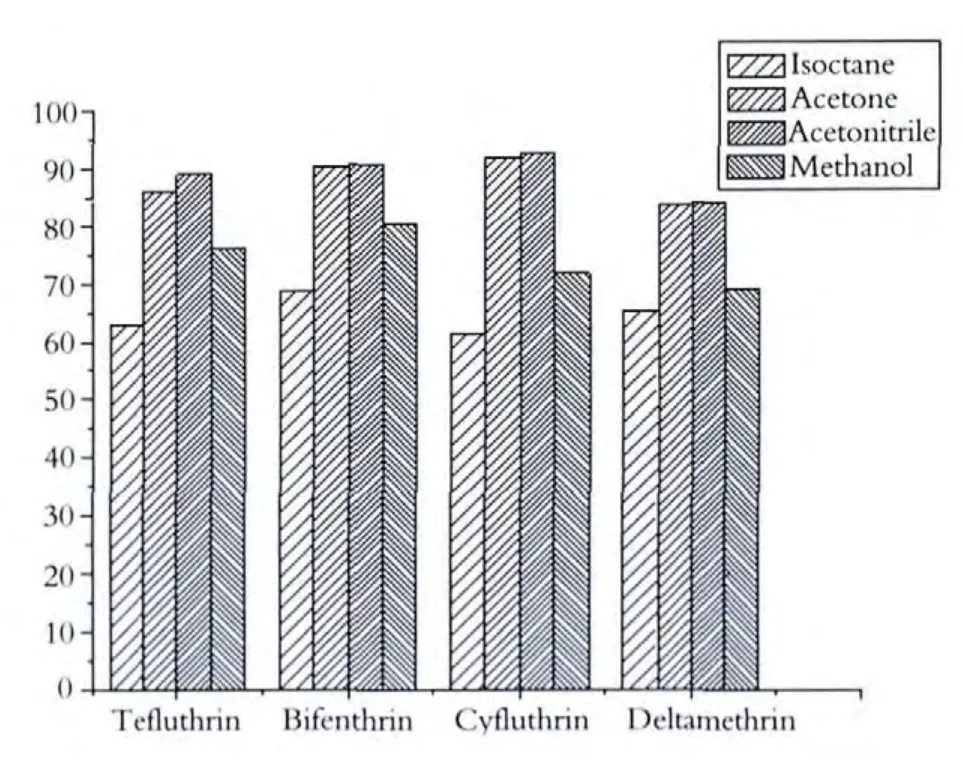
图3 溶剂种类对菊酯类农残回收率的影响标样加入浓度:0.1μg/g
3.3.2 解析溶剂用量的选择
由于有机溶剂均有一定的毒性,在实验过程中应尽量减少有机溶剂的用量,为了取得最佳的萃取效率,本文对乙腈的用量进行了优化(如表1所示),当乙腈的用量为3×1mL时,样品萃取回收率就达到了83%以上,当乙腈的用量达到3×3mL时,样品萃取回收率在85%左右,说明尽管溶剂用量增加了一倍,但回收率增加不大,因此本实验选用3×1mL作为萃取溶剂用量.
3.3.3 解析时间的选择
为了保证菊酯类农残能有效从C8-Fe3O4上解析,同时缩短样品前处理时间,本文对解析时间进行了优化(见表2),当解析时间在10min以下时,回收率呈增加趋势,随后回收率基本保持不变,因此,本实验选用10min为样品解析时间.
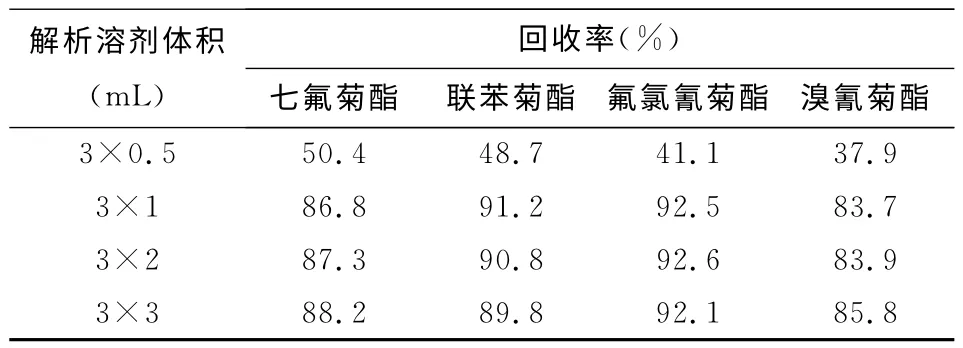
表1 解析溶剂用量对菊酯类农残回收率的影响
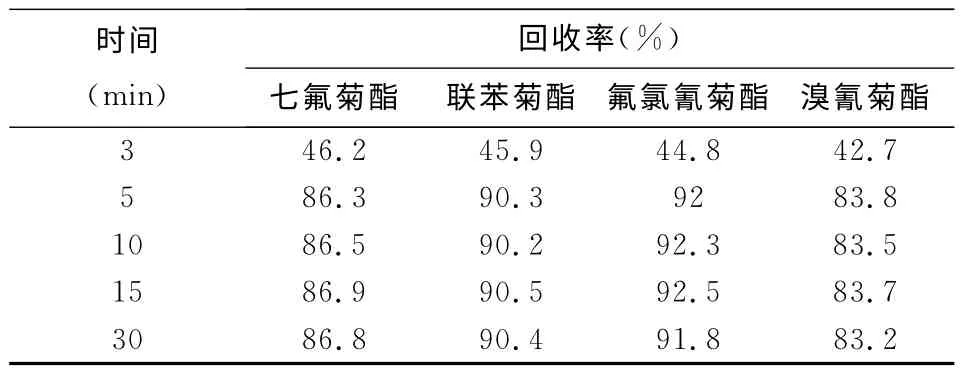
表2 解析时间对菊酯类农残的影响
3.4 方法评价
在上述优化的实验条件下,我们用标准加入法对该方法的线性范围、检出限及定量限进行了研究(如表3所示),从表中可见七氟菊酯和联苯菊酯的线性范围为0.005~1.0μ/g、氟氯氰菊酯的线性范围是0.01~1.0μ/g、溴氰菊酯的线性范围是0.05~2.0 μ/g,几种菊酯的相关系数均在0.997以上.该方法的检出限在0.0016~0.0250μ/L之间,定量限在0.0053~0.0833μ/L之间,其检出限低于CORESTA农用化学品咨询委员会制定的指导残留水平.

表3 菊酯类农残的相关系数、检出限及定量限
3.5 样品测定
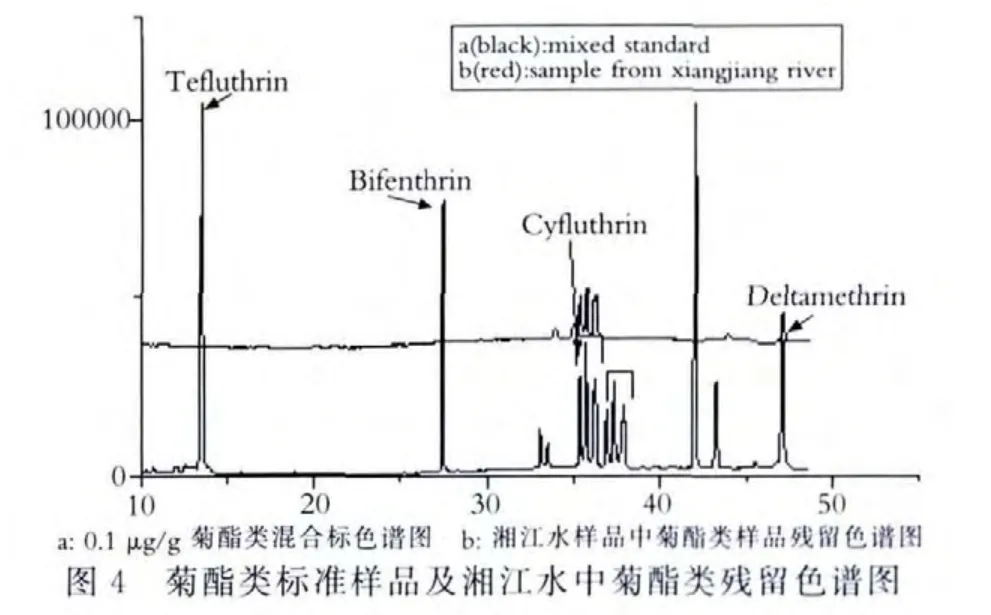
为了验证方法的可行性,我们对不同地段的湘江水样品进行了测定(见图4),发现湘江水中有少量的氟氯氰菊酯及溴氰菊酯残留.
[1]Casida,J.E.,Gammon,D.W.,Glickman,A.H.,and Lawrence,L.J.Mechanisms of Selective Action of Pyrethroid Insecticides[J].Annual Review of Pharmacology and Toxicology,1983,23,413-438.
[2]Taylor,M.F.,Heckel,D.G.,Brown,T.M.,Kreitman,M.E.,and Black,B.Linkage of Pyrethroid Insecticide Resistance to a Sodium Channel Locus in the Tobacco Budworm[J].Insect Biochemistry and Molecular Biology,1993,23,763-775.
[3]Cahill,M.,Byrne,F.J.,Gorman,K.,Denholm,I.,and Devonshire,A.L.Pyrethroid and Organophosphate Resistance in the Tobacco Whitefly Bemisia Tabaci(Homoptera:Aleyrodidae)[J].Bulletin of Entomological Research,1995,85,181-188.
[4]Colume,A.,Cardenas,S.,Gallego,M.,and Valcarcel,M.Selective Enrichment of 17Pyrethroids from Lyophilised Agricultural Samples[J].Journal of chromatography A,2001,912:83-90.
[5]Fernandez-Alba,A.R.,Valverde,A.,Agüera,A.,Contreras,M.,and Chiron,S.Determination of ImidaCloprid in Vegetables by High-performance Liquid Chromatography with Diode-array Detection[J].Journal of chromatography A 1996,721:97-105.
[6]Ling,Y-C.,and Huang,I.-P.Multi-residue Matrix Solidphase Dispersion Method for the Determination of Six Synthetic Pyrethroids in Vegetables Followed by Aas Chromatography with Electron Capture Detection[J].Journal of chromatography A,1995,695:75-82.
[7]Nakamura,Y.,Tonogai,Y.,Tsumura,Y.,and Ito,Y.(1993)Determination of Pyrethroid Residues in Vegetables,Fruits,Grains,Beans,and Green Tea Leaves:Applications to Pyrethroid Residue Monitoring Studies[J].Journal of aoac International,1993,76:1348.
[8]Obana,H.,Akutsu,K.,Okihashi,M.,Kakimoto,S.,and Hori,S.Multiresidue Analysis of Pesticides in Vegetables and Fruits Using a High Capacity Absorbent Polymer for Water[J].Analyst,1999,124:1159-1165.
[9]Chen,Z-M.,and Wang,Y.-H.Chromatographic Methods for the Determination of Pyrethrin and Pyrethroid Pesticide Residues in Crops,Foods and Environmental Samples[J].Journal of Chromatography A,1999,754:367-395.
[10]Stefani,R.,Buzzi,M.,and Grazzi,R.Supercritical Fluid Extraction of Pesticide Residues in Fortified Apple Matrices[J].Journal of chromatography A,1997,782:123-132.
[11]Zhifei W.,Huishi G.,Yinglei Y.,Nongyue H,(2006).Synthesis and Characterization of a Novel Magnetic Carrier with Its Composition of Fe3O4/Carbon Using Hydrothermal Reaction[J].Journal of Magnetism and Magnetic Materials,2006,302:397 -404.
- 湖南工程学院学报(自然科学版)的其它文章
- 不同形貌纳米ZnO、ZnO2的制备及紫外光下光催化性能的表征
- 型函数极限求解方法的总结归类

