不同形貌纳米ZnO、ZnO2的制备及紫外光下光催化性能的表征
邹萍萍,薛 亮,柯友涛
(陕西师范大学 化学化工学院,西安 710062)
0 引 言
利用光催化剂催化降解水中污染物是一种新型水处理技术,该法成本较低,工艺简单,具有比紫外线更强的杀菌能力,为解决环境污染问题提供了一条有效的途径[1-2].与纳米 TiO2一样,纳米ZnO作为一种多功能性的新型无机材料,由于晶粒的细微化等特点,产生了宏观物体所不具有的表面效应、体积效应等许多特殊的性质[3].尤其近年来发现它在催化、光学、磁学等方面展现出许多特殊功能,且由于其反应条件温和,无二次污染可以用作光催化剂高效降解废水中的有机污染物,有效缓解环境污染[4-5].
本研究在参照已有研究的基础上采用水热法及超声分解法制备了纳米花状ZnO晶体及棒状ZnO晶体,并进一步合成相应的花状及棒状ZnO2晶体,并对其光催化性能进行表征,为进一步研究晶体的形貌、粒径分布和团聚状况等各种因素对催化剂光催化性能的影响奠定基础.
1 材料与方法
1.1 主要的试剂及实验仪器
(1)试剂
二水醋酸锌(AR)、氢氧化钠(AR)、双氧水(AR)、丙酮(AR)、去离子水、罗丹明B(AR).
(2)实验仪器
恒温加热磁力搅拌器、超声波清洗器磁力、加热搅拌器、聚四氟乙烯反应釜、电热鼓风干燥箱、紫外灯、高速台式离心机、紫外可见分光光度计、电子天平、量筒
1.2 催化剂的制备
1.2.1 超声法制备花状纳米ZnO颗粒
分别配制0.0625mol/L的Zn(CH3COO)2溶液及1mol/L的NaOH溶液各100mL.将两种溶液混合入烧杯,用超声机超声溶解,恒温70℃,保持1h.反应结束后,自然冷却至室温.用去离子水及丙酮试剂洗涤数次减压抽滤.将产品在60℃下空气干燥5h.收集产品,编号试样Ⅰ.
1.2.2 水热法制备粒状纳米ZnO颗粒
同样方法配制以上两种溶液各100mL.将两者充分混合后入烧杯,用恒温加热磁力搅拌器加热,恒温70℃,保持1h.反应结束,自然冷却至室温.后用去离子水及丙酮试剂洗涤数次减压抽滤.然后将产品在60℃下空气干燥5h.收集产品,标号试样Ⅱ.
实验发现按传统方法在Zn(CH3COO)2溶液与NaOH溶液摩尔浓度比为1∶16情况下的产物产率较低,故改变配比重复实验,发现当二者摩尔浓度比1∶8,产物产率明显提高,表明碱性环境不利于氧化锌晶体的生成.
1.2.3 花状及粒状纳米ZnO2颗粒的制备
(1)纳米ZnO2颗粒初产品制备
称取已制备的花状及粒状ZnO晶体各0.4g,标注为1、2两份样品,各加入5mL去离子水,25mL30%H2O2溶液,磁力加热搅拌器搅拌2h,转入相应编号的不锈钢反应釜(30mL)中.密封,在鼓风干燥箱中加热到150℃,恒温保持20h,反应完毕后自然冷却至室温,然后用无水乙醇及丙酮试剂洗涤数次进行减压抽滤,并将产品在60℃下空气干燥5h.收集产品,编号3、4.
1.2.4 两种纳米ZnO2颗粒的高温处理
分别称取上述已制备的纳米ZnO2初产品(花状,粒状)各0.1551g放入坩埚中,并将坩埚置于空气干燥箱中,设定温度180℃,恒温加热10h.反应完毕后,冷却至室温.收集产品,编号5、6.
1.3 催化剂的物理性能表征
通过紫外-可见漫反射吸收光谱测定(UVVis DRS)判断吸收边(如图1、图2、图3所示),利用X射线粉末衍射(XRD)仪分析物相,如图4、图5、图6所示.
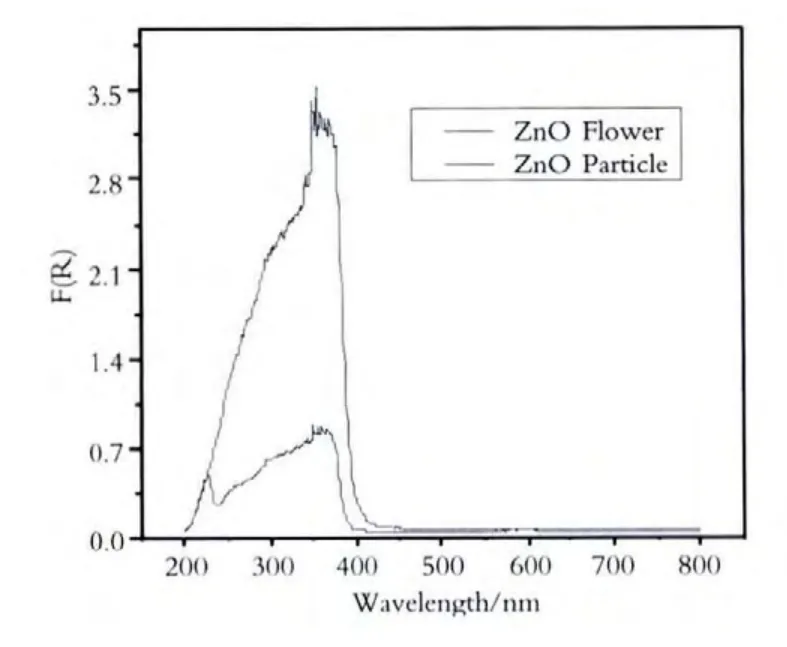
图1 不同形貌的ZnO纳米晶DRS图谱
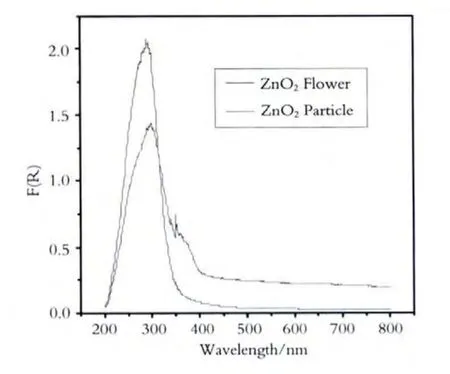
图2 不同形貌的ZnO2纳米晶DRS图谱

图3 经过180℃处理的ZnO2的DRS图
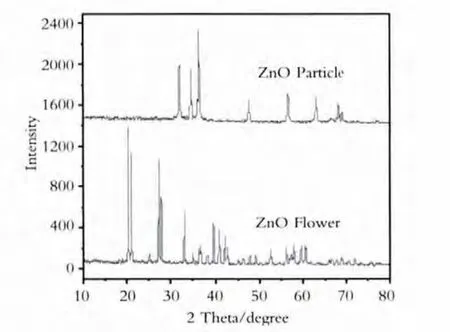
图4 两种形貌ZnO纳米晶的XRD图谱
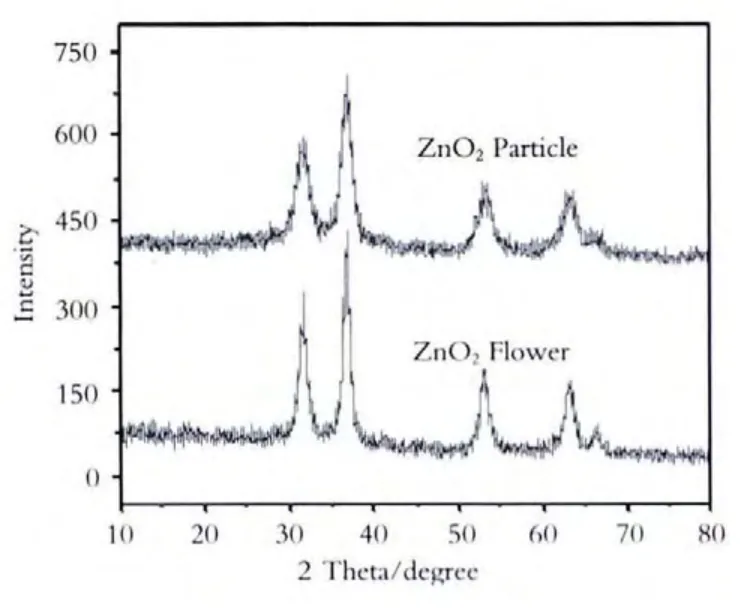
图5 两种形貌ZnO2纳米晶的XRD图谱

图6 180℃处理后的ZnO2纳米晶的XRD图谱
1.4 催化剂光催化活性评价
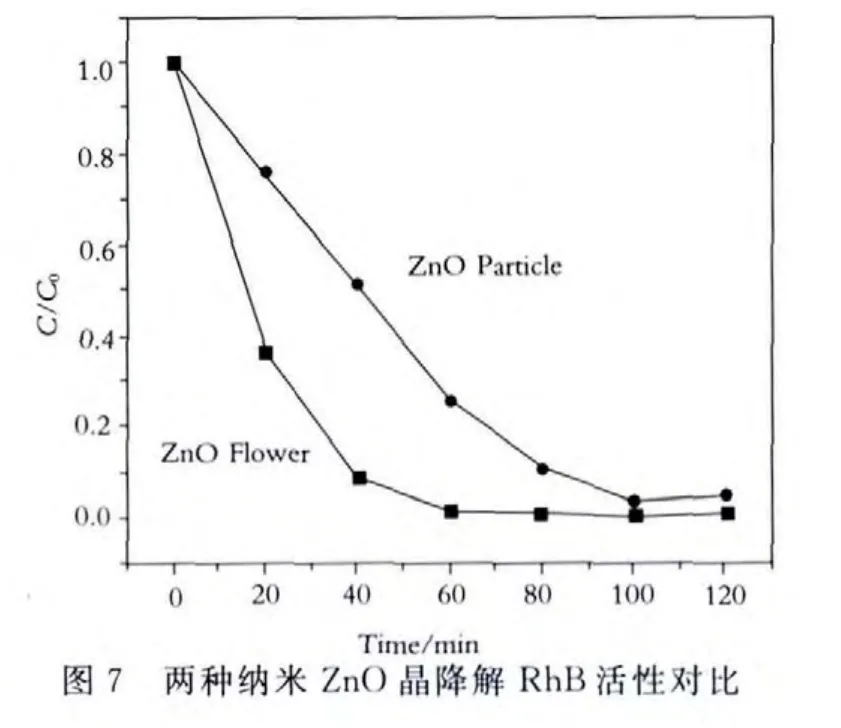
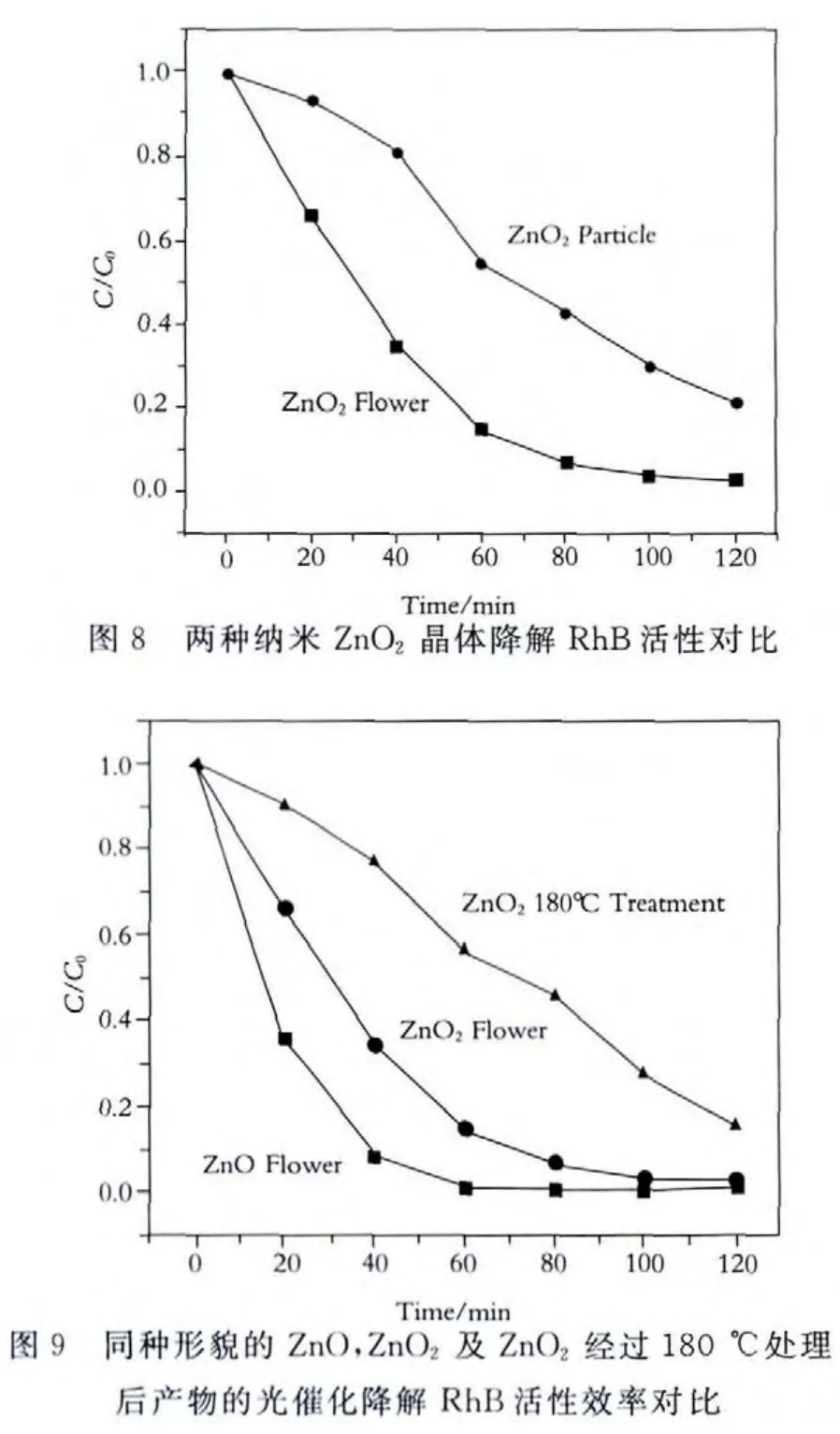
催化剂催化活性实验在催化装置中进行,以罗丹明B为目标分解物.过程与方法如下:将0.08g花状纳米ZnO颗粒产物和150mL桃红色罗丹明B溶液混合放入200mL石英反应试管中,避光条件下搅拌60min排除催化剂吸附作用的干扰.然后放入光催化反应装置中,磁力搅拌下,打开紫外灯,在254nm紫外光下进行光催化降解反应实验120min,每20min取一次样,根据取样时间依次编号.将粒状纳米ZnO颗粒,花状及粒状纳米ZnO2颗粒及180℃高温处理后的花状及粒状纳米ZnO2颗粒进行同样操作.取样结束后,将降解液转入洁净离心管中,放入离心机以10000r/min离心分离,取上层清液用723紫外可见光谱分光光度计进行光谱分析,测得染料溶液降解率随时间变化图,如图7、图8、图9所示.
2 结果与分析
2.1 紫外-可见漫反射吸收光谱分析(DRS)
图2、图3、图4是制备的不同形貌的ZnO及ZnO2纳米晶及经过180℃处理的产物的漫反射光谱,从图可以看出,样品具有明显的吸收带边,其吸收带边位置如表1所示.

表1 各产物及其吸收边
由图1、图2、图3及表1可以看出在紫外波段,水热法制备粒状ZnO纳米晶及ZnO2纳米晶的吸收边发生了红移,说明与粒状ZnO纳米晶及ZnO2纳米晶相比,花状ZnO纳米晶与花状ZnO2纳米晶在紫外波段对光的吸收更好.
2.2 X射线粉末衍射(XRD)图谱分析
由图4可以看出,两种方法合成的ZnO晶型不同,这是由于长时间在70℃水浴中反应导致粒子间的团聚.而超声辅助处理,可以利用其超搅拌混合作用使体系均匀化,从而得到分散性更好的纳米氧化锌.由图5可以看出,两种方法合成出的ZnO2均为空心球型,经过180℃处理之后,晶型未发生变化.图谱中无杂峰存在,说明产物纯度较高.
2.3 紫外光催化光谱分析
在低浓度范围内,吸光度A与染料溶液浓度之间为线性关系,用吸光度变化率来代替染料溶液浓度的变化率来计算光催化剂的催化降解效率.以C/C0为纵坐标(C0是光照前的浓度,C是某时刻染料的浓度),紫外光照时间t为横坐标作图,反映降解率随时间的变化趋势.
实验结果表明,在加入已制备的催化剂紫外光照射下,随着光照时间的增加,染料降解效果明显.同种形貌的花状ZnO比ZnO2光催化效率更高,效果更好.不同形貌的同种催化剂,经过超声处理的花状纳米ZnO颗粒比水热处理的粒状纳米ZnO颗粒光催化活性高.同样,其进一步的反应产物花状纳米ZnO2颗粒比粒状纳米ZnO2颗粒光催化活性高,且都优于经过高温处理后的最终产物.
3 结 论
(1)本实验采用了简便的实验法(超声法,水热法)成功地制备了不同形貌的纳米ZnO晶体并进一步合成纳米ZnO2晶体,并发现碱性环境更适合氧化锌晶体的生成.
(2)两种不同方法制得的不同形貌的产物,经过XRD、DRS等多种技术对其晶相结构、晶粒大小、光吸收性能等进行了表征分析发等发现产物即为目标产物纳米ZnO及ZnO2,且产物为多晶结构,具有纯度高、吸光系数大和稳定性好的特点.
(3)通过光催化剂降解活性分析发现,不同形貌的ZnO纳米晶体及进一步合成的纳米ZnO2晶体都具有光催化活性,且在紫外光下对有机染料的降解效果很显著.但利用不同方法制备的光催化剂光催化活性不同.超声辅助制备的花状ZnO纳米颗粒的光催化性能优于水热法制备的粒状ZnO纳米颗粒;同类型的纳米ZnO晶体的光催化效能高于纳米ZnO2;经过180℃高温处理后得到的产物光催化性能降低.
[1]Fujishima A.,Honda K..Electrochemical Photolysis of Water at a Semiconductor Electrode[J].Nature,1972,238:37-38.
[2]Domen K.,Kudos A.,Onitsha T.,et al..Photo Catalytic Decomposition of Water into Hydrogen and Oxygen Over Nickel(II)Oxide-strontium Titan Ate(Sr-TiO3)Powder[J].J.Phys.Chem.,1986,90:292-295.
[3]Ezio Pelizzetti.Photochemical Conversion and Storage of Solar Energy[J].Kluwer Academic Publishers,Dordrecht,1991,324:32-38.
[4]牛新书,陈晓丽.掺杂La3+ 纳米氧化锌的制备及其光催化性能[J].化工环保,2009,29(1):67-70.
[5]苏碧桃,胡常林,左显维,等.纳米氧化锌的制备及其在太阳光下的光催化性能[J].无机化学学报,2010,132:54-58.
- 湖南工程学院学报(自然科学版)的其它文章
- 型函数极限求解方法的总结归类
- C8磁纳米颗粒分离检测湘江水中菊酯类农药残留

