长期酒精暴露对秀丽隐杆线虫生殖能力的损伤作用研究
李乃鹏 梁琼麟 罗国安 孟宪生▲.辽宁中医药大学药学院,辽宁大连 6600;.清华大学化学系,北京 00084
我国是酒的发源地,拥有悠久的酿酒历史和丰富的酒文化,尤其在生活和工作节奏日益加快的当今社会,酒更是成为人们生活中必不可少的一种饮品。然而大量的事实表明,大量饮酒会引起酒精急性中毒,甚至危及生命;长期饮酒可以引起酒精慢性中毒,对机体造成严重的损伤并引发一系列的疾病,如长期大量饮酒可能会对人类生殖系统造成一定的损伤。有研究发现,酒精对小鼠精子数量和质量也有比较明显的毒性作用[1-2],长期酒精暴露会导致后代发育和运动异常[3];酒精可以迅速通过胎盘[4],影响胚胎和母体间的物质吸收、利用和转运[5],间接地损害胚胎进而对后代的生长发育造成影响。但长期大量饮酒,尤其从幼年时期开始酗酒对人类生殖系统造成的影响,目前研究尚不完善。
为正确认识酒精对人类生育的损伤,提高人类生育质量,对酒精生殖毒性的系统研究具有深远的意义。然而利用人类自身进行酒精生殖毒性系统研究的可行性不大,而利用鼠、猴等实验动物进行研究,存在实验成本高、周期长、可选用实验参数少、实验操作复杂等缺点。
秀丽线虫是一种优秀的模式生物。该模式生物具有体积小、身体透明度高、繁殖速度快、生命周期短、遗传背景清晰等诸多优点,更适合在实验室中大量培养。秀丽线虫对外界环境的变化也非常敏感,环境因子的微小变化都可能引起秀丽线虫一系列身体特性的改变,因此,它们常被用作毒理学与环境暴露安全性评价的重要动物模型[6-7]。本文以秀丽线虫为实验生物,对酒精的生殖毒性进行评价,研究不同浓度酒精的长期刺激对秀丽线虫生殖能力的影响,并观察这种毒性对子代线虫运动能力造成的影响,为酒精生殖毒性的系统研究提供依据。
1 材料与方法
1.1 试剂、仪器和线虫品系
乙醇(C6H5OH),北京现代东方精细化学品有限公司。Olympus IX71倒置荧光显微镜,日本奥林巴斯株式会社。Hettich MIKRO 22R高速冷冻离心机 德国Hettich公司。Sanyo MCO 175 CO2培养箱 日本Sanyo电器集团。秀丽线虫品系为野生型N2,清华大学医学院薛定教授惠赠。
1.2 线虫的培养和同期化处理
秀丽线虫培养在涂有大肠埃希菌OP50的琼脂培养基(NGM)上[8],到达产卵期后,将线虫用 20%次氯酸钠和0.5 mol/L的氢氧化钠处理,经反复洗涤离心后在M9缓冲液中孵化,即获得同期化的线虫。将同期化的线虫接种在NGM培养基上,20℃下培养。实验分为分别含有1%、2%、3%、4%、5%酒精的实验组和不含酒精的空白对照组。
1.3 后代数目测定
方法参考Swain SC等[9]的报道,随机挑取L4期线虫到实验组和对照组的NGM培养基上,每个培养基1条,20℃下培养,每隔12小时转板一次,将线虫挑至新的含有对应浓度酒精的NGM培养基上,直到产卵期结束,统计每块NGM培养基上后代的数目。
1.4 子宫内受精卵数目测定
将同期化的线虫分别接种在实验组和对照组的NGM培养基上,线虫进入产卵期后,随即挑取线虫至无OP50的NGM培养基上,滴加新配制的线虫裂解液到虫体,待虫体被裂解,体内受精卵暴露,显微镜下观察,统计受精卵的数目[10]。
1.5 单侧性腺臂卵母细胞数目测定
将同期化的线虫分别接种在实验组和对照组的NGM培养基上,产卵期结束后,随机挑取线虫至载玻片上,滴加NaN3溶液至虫体,盖上盖玻片,显微镜下观察,统计线虫单侧性腺臂远端loop区到性腺臂近端纳精囊之间卵母细胞的数目[11]。
1.6 排卵速率测定
方法同1.3后代数目测定,随机挑取L4期线虫到实验组和对照组的NGM培养基上,每个培养基1条,20℃下培养,每12小时转板一次,排除首次和末次NGM培养基上后代,计算排卵过程中线虫的平均排卵速率。
1.7 子代线虫头部摆动频率测定
头部摆动频率 (thrashes)的测定主要参照Tsalik ET和Hobert O[12]的方法,将实验组和对照组的子代L4期线虫分别挑至不含酒精和OP50的NGM培养基上,显微镜下观察,统计1min内线虫头部摆动次数。
1.8 子代线虫身体弯曲频率测定
身体弯曲频率(body bends)的测定主要参照Tsalik EL和Hobert O[12]的方法,将实验组和对照组的子代L4期线虫分别挑至不含酒精和OP50的NGM培养基上,显微镜下观察,统计1min内线虫身体弯曲次数。
1.9 统计学分析
采用Microsoft office Excel 2003软件,数据以x±s表示,并且用配对t检验法对数据进行组间差异统计学分析。P<0.05为差异有统计学意义。
2 结果
2.1 长期暴露在不同浓度酒精条件下线虫后代数目的改变
与对照组相比,长期暴露在酒精浓度为1%条件下,线虫的后代数目无显著性变化,2%、3%、4%、5%条件下线虫后代数目明显降低(P<0.05),见图1。
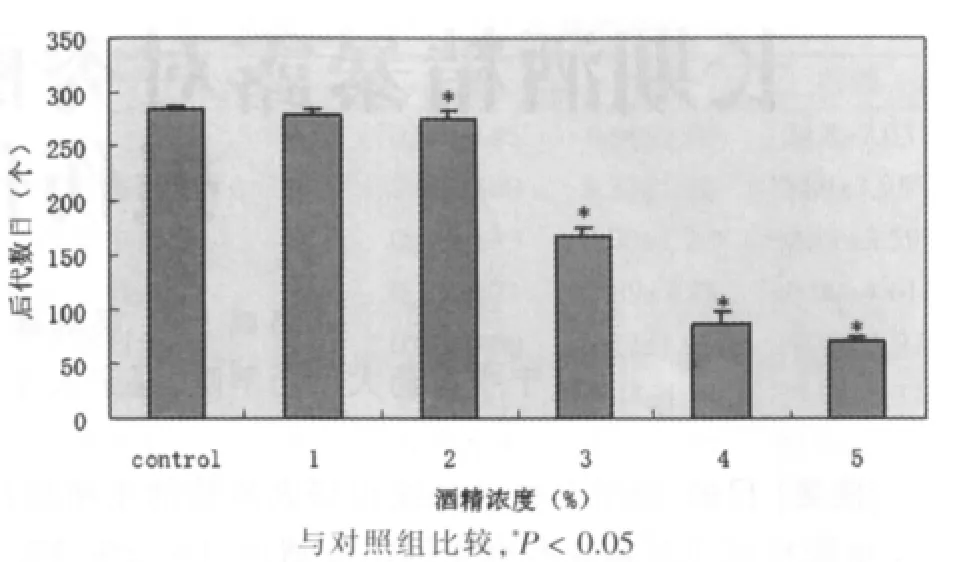
图1 长期暴露在不同浓度酒精条件下线虫的后代数目
2.2 长期暴露在不同浓度酒精条件下线虫子宫内受精卵数目的改变
与对照组相比,长期暴露在酒精浓度为1%条件下,线虫子宫内受精卵数目无显著性变化,2%、3%、4%、5%条件下线虫子宫内受精卵数目明显降低(P<0.05),见图2。

图2 长期暴露在不同浓度酒精条件下线虫子宫内受精卵数目
2.3 长期暴露在不同浓度酒精条件下线虫单侧性腺臂卵母细胞数目的改变
与对照组相比,长期暴露在酒精浓度为1%条件下,线虫单侧性腺臂卵母细胞数目无显著性变化,2%、3%、4%、5%条件下线虫单侧性腺臂卵母细胞数目明显降低 (P<0.05),见图 3。

图3 长期暴露在不同浓度酒精条件下线虫单侧性腺臂卵母细胞数目
2.4 长期暴露在不同浓度酒精条件下线虫排卵速率的改变
与对照组相比,长期暴露在酒精浓度为1%、2%条件下,线虫的排卵速率无显著性变化,3%、4%、5%条件下线虫的排卵速率明显降低(P<0.05),见图4。
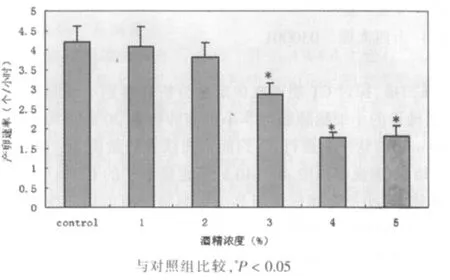
图4 长期暴露在不同浓度酒精条件下线虫的排卵速率
2.5 长期暴露在不同浓度酒精条件下产生并孵化的子代线虫的头部摆动频率的改变
与对照组相比,各实验组的子代线虫的头部摆动频率均有明显降低(P<0.05),见图 5。

图5 长期暴露在不同浓度酒精条件下产生并孵化的子代线虫的头部摆动频率
2.6 长期暴露在不同浓度酒精条件下产生并孵化的子代线虫的身体扭动频率的改变
与对照组相比,各实验组的子代线虫的头部摆动频率均有明显降低(P<0.05),见图 6。
3 讨论
传统的生殖毒性实验常选用大鼠、小鼠等啮齿类哺乳动物,性成熟时间6~8周,妊娠期约3周,哺乳期约3周,每胎产仔约8~10只,繁殖周期长。L4期线虫约18 h发育为产卵期成虫,产卵期约3~4 d,产卵约280~300个。与传统实验动物相比,应用线虫进行实验具有周期短、成本低优点等优点,在环境毒性研究方面具有一定的应用价值。
本次实验结果显示:秀丽隐杆线虫长期暴露在浓度分别为2%到5%的酒精中,后代数目、子宫内受精卵的数目、性腺单侧臂卵母细胞的数目均有不同幅度的降低,说明酒精对线虫的生殖功能造成了一定程度的损伤。其中酒精浓度由低到高的各实验组后代数目较对照组分别减少了1.8%、3.2%、41.1%、69.1%、75.4%,随着酒精浓度升高,产卵数目明显降低,从宏观上直接反映了酒精对线虫生殖系统造成的损伤。
由于本研究使用的是雌雄同体的线虫,因此线虫的受精卵是卵子和精子在体内通过受精过程产生的。在线虫正常的生殖过程中,卵母细胞从单侧性腺臂远端loop区到性腺臂近端纳精囊之间是紧密排列并与体细胞充分接触,并且由远及近,体积会逐渐增大[13],而实验观察到,线虫卵母细胞数目减少的同时,卵母细胞的大小形态也发生了一定程度的变化,导致细胞的排列并不像对照组一样紧密,而是出现了一定的间隙。有报道表明,卵母细胞的生长主要依靠从性腺粗线区域向近端性腺延伸的细胞流向其输送营养物质[14],而细胞间接触在营养物质向卵母细胞传递过程中起到一定作用[15]。实验中观察到的细胞间隙的出现可能影响到了正常的营养传输,从而导致卵母细胞的发育受到抑制,这也是直接导致子宫内受精卵数目降低的原因之一。

图6 长期暴露在不同浓度酒精条件下产生并孵化的子代线虫的身体扭动频率
实验结果同时显示,酒精浓度由低到高的各组受精卵数目较对照组分别减少 7.6%、26.6%、41.8%、58.2%、74.7%,卵母细胞数目较对照组分别减少7.7%、15.4%、15.4%、23.1%、30.8%,受精卵数目减少趋势明显高于卵母细胞数目减少趋势。笔者推测酒精可能对线虫精子的产生也造成了损伤并可能影响到了线虫的受精过程,从而导致了受精卵数目的大幅下降。
排卵速率实验中,浓度分别为3%、4%、5%的实验组线虫排卵速率为每小时2.88个、1.78个、1.79个,较对照组有明显降低,同时我们观察到个别线虫母体内出现了少量已经孵化的幼虫,这些现象的出现表明较高浓度酒精刺激下的线虫不能正常的将受精卵排出体外,同时因此笔者推断酒精对线虫的排卵功能也会造成一定程度的损伤。
针对子代线虫运动能力的实验中,不同浓度实验组的子代线虫的头部摆动速率和身体扭动速率较对照组均有显著降低,笔者推断线虫的运动功能可能也受到了酒精的抑制。但是由于子代线虫是在孵化后挑至无酒精的NGM培养基上进行实验,因此不能确定线虫运动能力的降低是因为酒精在生殖时期对受精卵造成的损伤还是孵化后子代线虫短期接触酒精而受到的神经抑制,具体机制有待于我们继续研究。而且由于线虫和人类之间存在物种差异以及在量效关系转化等方面尚不完善,因此结果的合理外推还需要进行大量的后续研究。
综上所述,实验中线虫经历了L1~L4的幼虫期(相当于人的幼年时期)以及产卵期,实现了酒精的长期暴露,而且酒精通过对卵母细胞和受精卵的损伤、对受精作用和排卵功能的抑制等方面降低了线虫的生殖能力,表明长期酒精暴露对线虫具有生殖毒性,为研究长期饮酒对人类生殖系统的损伤作用提供了参考。同时线虫在酒精生殖毒性实验中体现出的短周期、低成本和高灵敏度等优点,也再次验证了线虫作为一种模式生物在环境毒性评价中的应用价值。
[1]VillaltaJ,BallescaJL,NicolasJM,etal.Testicularfunctioninasymptomaticchronicalcoholics: relationtoethanolintake[J].Alcohol Clin Exp Res,1997,21(1):128-134.
[2]马明月.乙醇对雄性小鼠精子生成的影响[J].工业卫生与职业病,2000,26(4):209-212.
[3]Ledig M,Misslin R,Vogel E,et al.Pateral alcohol exposure: developmental and behavioral effects on the offspring of rats[J].Neuropharmacology, 1998, 37(1):57-63.
[4]Laijtha A.Handbook of Neurochemistry[M].New York:Kluwer Academic/Plenum Publishers,1985:251.
[5]Abel EL.Prenatal effects of alcohol on growth:a brief overview[J].Feder ation proceedings,1985,44(7):2318-2322.
[6]RankinCH.FromgenetoidentifiedneurontobehaviorinCaenorhabditis elegans[J].Nat Rev Genet, 2002,3(8):622-630.
[7]LeungMCK,WilliamsPL,BenedettoAAC,etal.Caenorhabditiselegans:an emerging model in biomedical and environmental toxicology[J].Toxicol Sci,2008,106(1):17-19.
[8]Brenner S.The genetics of Caenorhabditis elegans[J].Genetics,1974,77(1):71-94.
[9]SwainSC,KeusekottenK,BaumeisterB,etal.C.elegansmetallothioneins:new insights into the phenotypic effects of cadmium toxicosis[J].J Mol Biol,2004,341:951-959.
[10]Dempsey CM,Mackenzie SM,Gargus A,et al.Serotonin (5HT), fluo xetine,imipramineand dopaminetargetdistinct5HT receptor signaling to modulate Caenorhabditis elegans egg laying behavior[J].Genetics,2005,169(3):1425-1436.
[11]阮秦莉,居静娟,王大勇,等.氯氰菊酯对模式动物秀丽隐杆线虫生殖能力的损伤作用[J].癌变 畸变 突变,2011,24(2):136-140.
[12]Tsalik EL,Hobret O.Functional mapping of neurons that control loco motory behavior in Caenorhabditis elegans[J].J Neurobiol,2003,56:178-197.
[13]Greenstein D.Control of oocyte meiotic maturation and fertilization[M].WormBook,The C.elegans Research Community,2005.
[14]Wolke U,Jezuit EA,Priess JR.Actin dependent cytoplasmic streaming in C.elegans oogenesis[J].Development,2007,134(12):2227-2236.
[15]Luo SJ, Murphy CT.Caenorhabditis elegans reproductive aging: regu lation and underlying mechanisms[J].Genesis,2011,49(2):53-65.

