半胱氨酸-海藻酸钠-壳聚糖凝胶球的制备研究
孔 静,李和生,王亚儿,朱仁义,徐霄晴
(宁波大学海洋学院,浙江宁波315211)
目前,已有报道重金属在部分地区水产鱼类贝类中富集,且部分企业水产品加工不当,使大量重金属超标水产品流入市场[1]。重金属往往不以单质形式存在,不易被分解破坏,具毒性大、不易代谢等特点,对人体造成严重损伤[2]。有研究表明,重金属对人体的危害主要集中于脏器损伤及神经性毒性,其中,部分金属影响智力发育,且可造成肺、肾脏、肝脏等脏器的坏死[3-5]。半胱氨酸(Cysteine)是唯一一种含还原性硫醇基团的氨基酸,其上的巯基能与大部分金属元素形成多齿配体结构的不溶性硫醇盐[6],从而使金属离子从溶液中被沉淀下来。目前对半胱氨酸的应用主要集中在食品风味物质的合成、食物保鲜[7-8]中,对其应用于食品重金属的脱除报道较少。藻类生物具丰富的粘性物质,可提供大量与金属离子结合的官能团,且具有生物来源广泛,不造成二次污染的特性[9],利用藻类提取物吸附回收废水中重金属离子的技术在目前众多的重金属处理技术中脱颖而出。海藻酸钠是从藻类生物中提取的天然高分子,其分子链上含有大量的羧基。本研究选择海藻酸钠、壳聚糖、半胱氨酸等三种廉价易得的原料制备海藻酸钠-半胱氨酸-壳聚糖凝胶球。通过适量半胱氨酸的引入,对常用的海藻酸钠-壳聚糖体系进行改进,克服双组分体系的局限性;另一方面,利用半胱氨酸中的巯基可以对金属离子进行螯合的特性,使物理吸附和化学包埋法相结合,制备一种无毒、生物相容性好的金属吸附剂,为重金属吸附提供了一种新的尝试[10]。
1 材料与方法
1.1 材料与仪器
海藻酸钠 化学纯;壳聚糖 生化试剂纯;半胱氨酸、氯化钙、醋酸、紫脲酸铵、硫酸铜、乌洛托品 均为分析纯。
SB-5200 DTS双频超声波清洗机、JY92-IIN超声波细胞粉碎机 宁波新芝生物科技股份有限公司;WFJ-7200紫外可见分光光度计 尤尼柯(上海)仪器有限公司;BP221S分析天平 德国Sartorius公司。
1.2 复合凝胶球的制备
参考李庆丽[11]的方法,称取一定量的海藻酸钠置于10mL双蒸水中,溶解均匀后继续加入半胱氨酸,待分散均匀,25kHz超声处理2min除去溶胶中气泡。向不同浓度的氯化钙溶液中缓慢注射5mL凝胶,形成大小均匀的凝胶球,边滴边振荡。静置30min后,用双蒸水清洗凝胶球3次,滤纸吸干球表面的水分后转入不同浓度的壳聚糖溶液中。振荡后静置3h,再用双蒸水清洗凝胶球3次,吸干表面的水分,置于4℃条件下保存。
1.3 紫脲酸铵(TMM)法测定凝胶球对铜离子的吸附能力
参考Maillard等[12]的方法并略作修改。取1mL 0.4mmol/L硫酸铜标准溶液于1mL 50mmol/L pH5.0乌洛托品缓冲液中,使其终浓度为0.2mmol/L。投入一定量制备好的凝胶球,在水平摇床上室温振荡10min,取出凝胶球,加入0.1mL TMM溶液,检测溶液在460nm和530nm处的吸光值,重复三次取其平均值,对照标准曲线,求出溶液中游离硫酸铜浓度,计算吸附率。
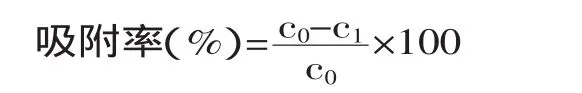
式中,c0:未加入凝胶球前铜离子浓度;c1:加入凝胶球吸附后铜离子浓度。
1.4 凝胶球制备条件优化
采用正交实验,对凝胶球制备条件进行优化,其因素和水平见表1。
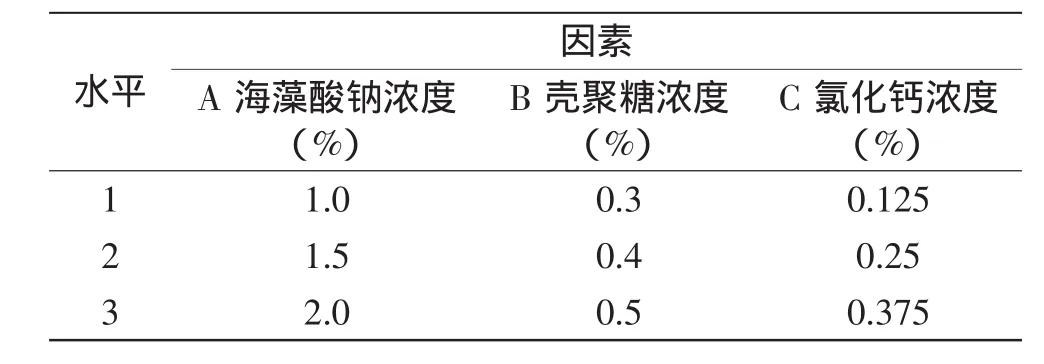
表1 正交实验因素水平表Table 1 Factors and levels of orthogonal experiment
2 结果与讨论
2.1 海藻酸钠浓度对凝胶球吸附铜离子能力的影响
取0.1g半胱氨酸于10mL,浓度分别为0.5%、0.75%、1%、1.5%、2%海藻酸钠溶液中,搅拌均匀,以2.5mL注射器缓慢逐滴滴于50mL含0.4%壳聚糖的1%氯化钙溶液中,振荡,静置3h,取出,冲洗数次后,晾干。测定凝胶球对铜离子的吸附能力,其结果如图1所示。
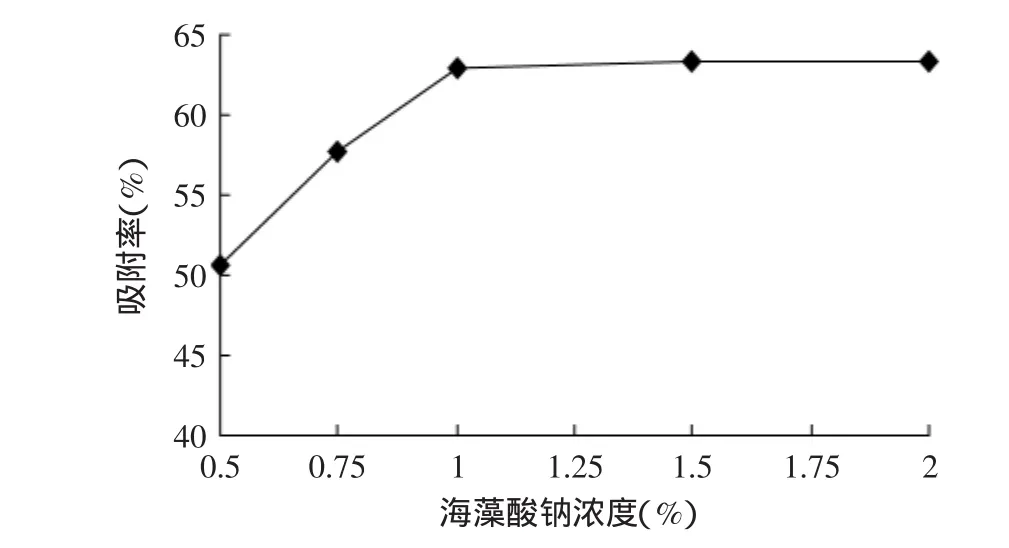
图1 海藻酸钠浓度对凝胶球吸附率的影响Fig.1 The effect of absorption capacity by sodium alginate in different concentration
由图1可知,海藻酸钠浓度在0.5%~1%的范围内时,凝胶球的金属吸附能力随海藻酸钠浓度的增加有较大幅度增加,当海藻酸钠浓度为1%时,其铜离子吸附率为62.96%。而当海藻酸钠浓度的增加大于1%后,海藻酸钠浓度对凝胶球的金属吸附能力基本无影响。这可能与凝胶球成型性有关。当原料中海藻酸钠浓度小于1%时,由于凝胶球成型性差,使金属吸附材料流失,而当海藻酸钠浓度大于1%时,其溶液粘度足以使凝胶球成型,从而使半胱氨酸被稳定固定,这与王秀娟等[13]在对海藻酸钠凝胶特性研究的结论基本一致。
2.2 壳聚糖浓度对凝胶球吸附铜离子能力的影响
重复操作2.1,将含10mg/mL半胱氨酸的1%海藻酸钠溶液分别逐滴滴于50mL含0%、0.2%、0.4%、0.6%、0.8%壳聚糖的1%氯化钙溶液中,振荡,静置3h,取出,冲洗数次后,晾干。测定凝胶球对铜离子的吸附能力,其结果如图2所示。
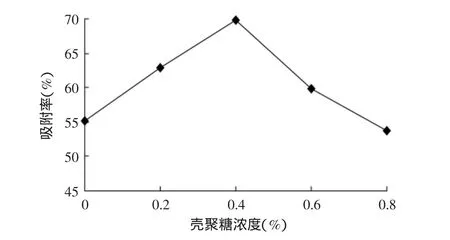
图2 壳聚糖浓度对凝胶球吸附率的影响Fig.2 The effect of absorption capacity by chitosan in different concentration
由图2可知,当壳聚糖浓度小于0.4%时,凝胶球的金属吸附能力随壳聚糖浓度增加而呈增强趋势,并在壳聚糖浓度为0.4%时,凝胶球金属吸附能力达到最大值69.71%。由于在制备凝胶球过程中,壳聚糖溶液本身具有一定粘度,能在凝胶球表面覆膜,当壳聚糖浓度为0%时,由于没有包被,导致半胱氨酸没有很好的锁定在凝胶球内而更易扩散至球体外,导致凝胶球固定的半胱氨酸量减少,从而使其散失一部分金属吸附能力。而当壳聚糖浓度大于0.4%时,凝胶球的金属吸附能力却随着壳聚糖浓度的增加而呈下降趋势。由于壳聚糖是乙酰或脱乙酰氨基葡萄糖聚合物,本身带有大量的氨基基团[14],能与海藻酸钠剩余羧基相结合,从而产生趋向于凝胶球内核的一个结合力,造成凝胶球内部水分外渗,从而使部分未稳定结合的半胱氨酸损失,造成凝胶球金属吸附能力的下降。实验中,同样可以观察到,在高浓度壳聚糖溶液包被过程中,凝胶球缩水现象远比浸泡于低浓度壳聚糖溶液中的凝胶球明显。
2.3 氯化钙浓度对凝胶球吸附铜离子能力的影响
重复操作2.1,将含10mg/mL半胱氨酸的1%海藻酸钠溶液分别逐滴滴于50mL含0.4%壳聚糖的0%、0.125%、0.25%、0.5%、1%、1.5%和2%氯化钙溶液中,振荡,静置3h,取出,冲洗数次后,晾干。测定凝胶球对铜离子的吸附能力,其结果如图3所示。
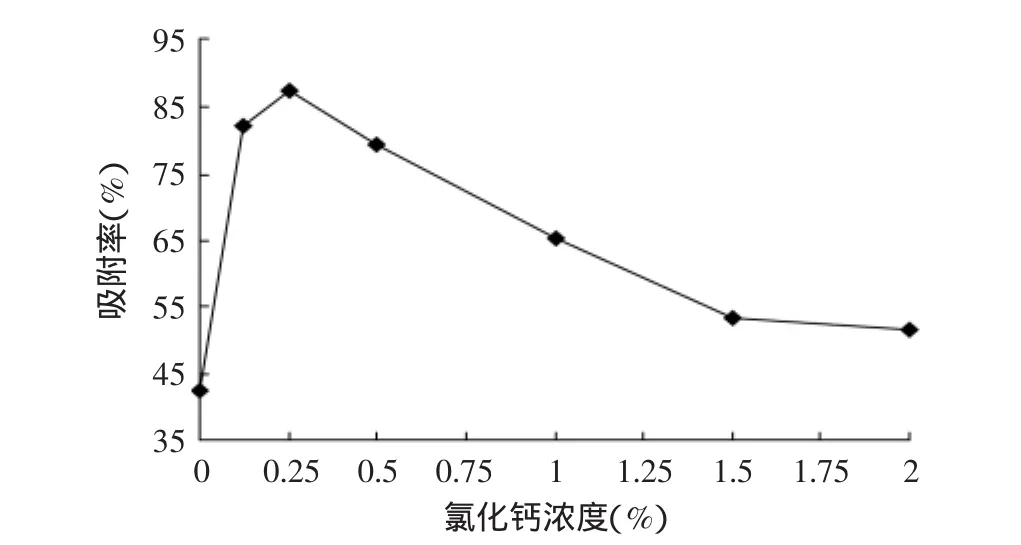
图3 氯化钙浓度对凝胶球吸附率的影响Fig.3 The effect of absorption capacity by calcium chloride in different concentration
由图3可知,壳聚糖-海藻酸钠-半胱氨酸凝胶球金属吸附能力随着氯化钙浓度的增加呈先增加后减小的趋势。当氯化钙浓度小于0.25%时,凝胶球的成型性不好,而其吸附能力随氯化钙的浓度增加有明显增长趋势,这与氯化钙在球体中的固化作用有关。当氯化钙浓度继续增加时,凝胶球的吸附逐渐减小,推断是由于半胱氨酸能与大量一价、二价金属离子形成不溶的硫醇盐,因此,高浓度的氯化钙反而与半胱氨酸反应,从而造成巯基基团的损失,影响凝胶球的金属吸附能力。
2.4 半胱氨酸浓度对凝胶球吸附铜离子能力的影响
分别取0.050、0.075、0.100、0.125、0.150g半胱氨酸于10mL 1%海藻酸钠溶液中,搅拌均匀,以2.5mL注射器缓慢逐滴滴于50mL含0.4%壳聚糖的0.25%氯化钙溶液中,振荡,静置3h,取出,冲洗数次后,晾干。测定凝胶球对铜离子的吸附能力,其结果如图4所示。
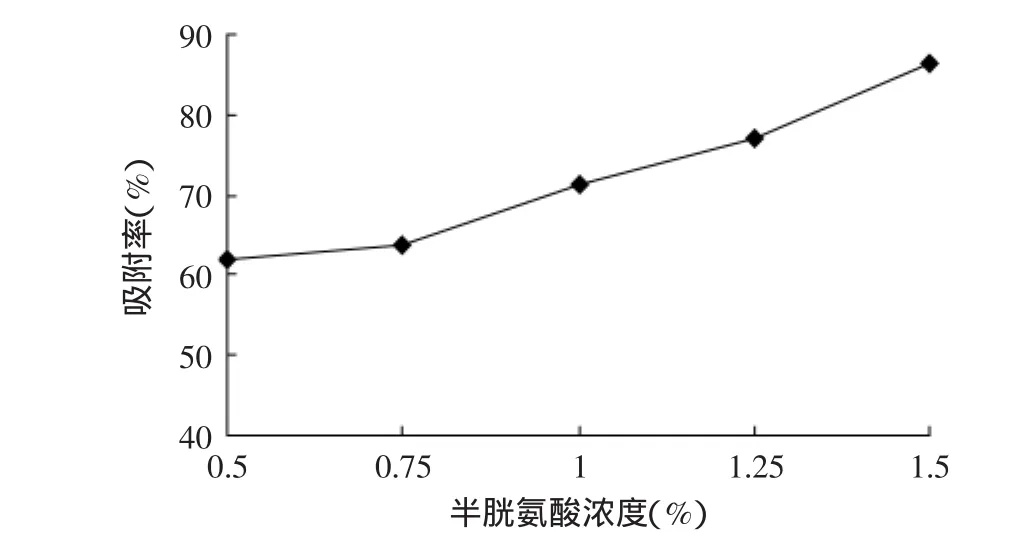
图4 半胱氨酸浓度对凝胶球吸附率的影响Fig.4 The effect of absorption capacity by cysteine in different concentration
由图4可知,凝胶球金属吸附能力随着半胱氨酸浓度的增加而呈上升趋势。当半胱氨酸浓度为1%时,其金属吸附率达到71.13%。由于半胱氨酸具有活泼的巯基基团,且能与金属离子形成硫醇盐从而沉淀下来,因此,半胱氨酸浓度的增加,使其可固定的半胱氨酸量也逐渐增大。从而使其金属吸附能力逐渐增强。综合考虑成本与吸附效果,选择半胱氨酸浓度为1%为宜。
2.5 凝胶球制备条件的优化
考虑到半胱氨酸在凝胶球吸附能力中的正向相关性,恒定半胱氨酸添加量为1%,选取海藻酸钠浓度、壳聚糖浓度、氯化钙浓度的量作为主要的考察因素,以对铜离子的吸附率为考察指标进行正交实验,确定凝胶球制备的最佳条件,结果如表2所示。
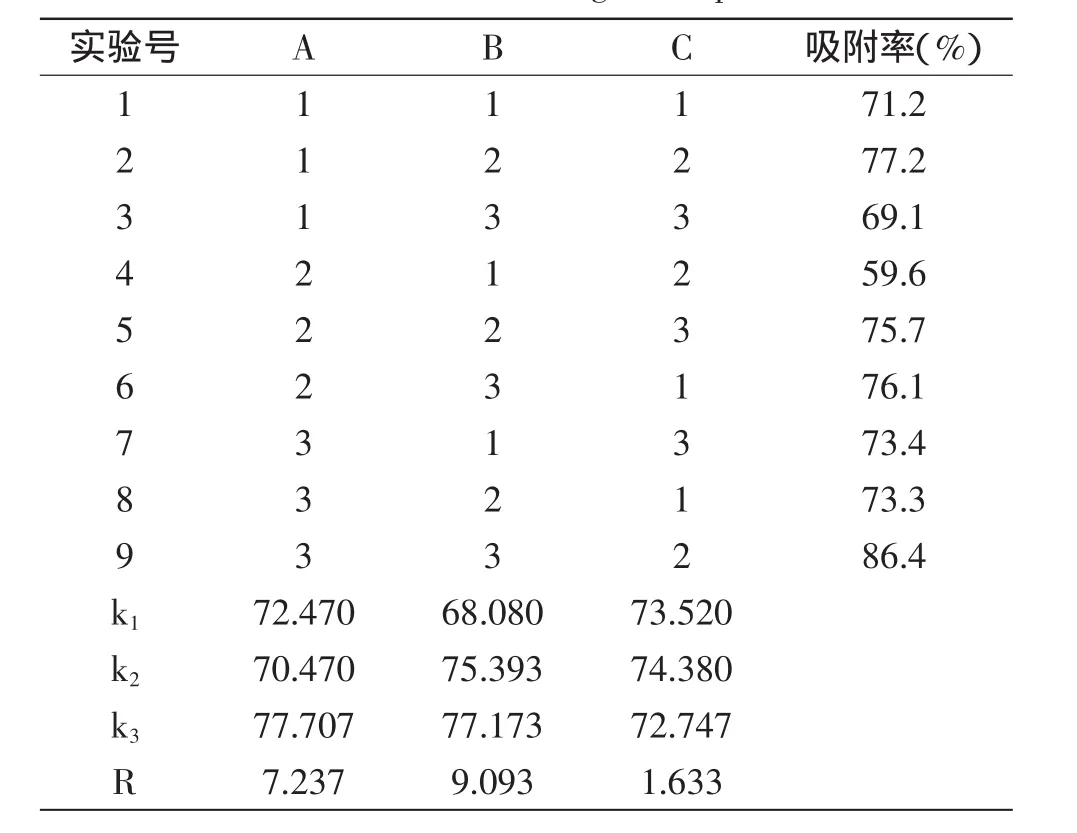
表2 正交实验结果Table 2 Results of orthogonal experiment
正交结果显示,壳聚糖浓度的极差值最大,海藻酸钠浓度的极差值次之,氯化钙浓度的极差值最小,说明壳聚糖浓度对凝胶球金属吸附能力影响最大。由于壳聚糖具有良好的成膜性[15],在一定浓度范围内可有效防止金属吸附材料的流失,另外壳聚糖本身对金属离子有一定的吸附能力,因此对凝胶球的金属吸附能力有较大影响。从正交结果分析看出,其最佳配方应为A3B3C2,即海藻酸钠质量浓度为2.0%、壳聚糖浓度为0.5%、氯化钙浓度为0.25%、半胱氨酸浓度为1%。
3 结论
通过探讨以半胱氨酸、海藻酸钠及壳聚糖为主要原料制备复合凝胶球各成分对凝胶球铜离子吸附能力的影响,表明在一定范围内凝胶球对铜离子吸附能力随半胱氨酸和海藻酸钠浓度增加而增加,随着氯化钙和壳聚糖浓度的增大先增加后减小。综合分析推测,海藻酸钠和氯化钙同时影响凝胶球成型。当海藻酸钠浓度小于1%,氯化钙浓度小于0.25%时,球体成型性差。壳聚糖具有一定的粘稠度,可以很好的包埋复合在凝胶球中的关键成分半胱氨酸,当壳聚糖浓度超过0.4%时,由于凝胶球内部水分的外渗,致使部分未稳定结合的半胱氨酸流失。正交实验分析表明,凝胶球制备最佳配方为2.0%海藻酸钠、0.5%壳聚糖、0.25%氯化钙、1%半胱氨酸。重复上述配方制备的凝胶球,对铜离子的吸附率高达87%±0.69%(p<0.05),与正交表中9号实验得出数据相近。本研究所得复合凝胶球,安全无毒,且有良好的铜离子吸附能力,为其在重金属吸附研究中奠定基础。
[1]Wan Ngah,Hanafiah M.Removal of heavy metal ions from wastewater by chemically modified plant wastes as adsorbents:A review[J].Bioresource Technology,2008,99(10):3935-3948.
[2]陈海仟,吴光红,张美琴,等.我国水产品重金属污染现状及其生物修复技术分析[J].科学养鱼,2010(3):3-5.
[3]Farag A M,May T,Marty G D.The effect of chronic chromium exposure on the health of Chinook salmon[J].Aquatic Toxicology,2006,76(3-4):246-257.
[4]Mortada W I.The exposure to cadmium,lead and mercury from smoking and its impact on renal integrity[J].Medical Science Monitor,2004,10(3):112-116.
[5]Navas-Acien A,Selvin E,Sharrett A R,et al.Lead,cadmium,smoking,and increased risk of peripheral arterial disease[J].Circulation,2004,109(25):3196-3201.
[6]陈春华,陆茜.L-半胱氨酸希夫碱及其铜、锌配合物的合成及表征[J].湖北化工,1998(5):18-19.
[7]Nilesh P,Soottawat B. Biochemical properties of polyphenoloxidase from the cephalothorax ofPacific white shrimp(Litopenaeus vannamei)[J].Nirmal and Benjakul International Aquatic Research,2012,4(1):1-13.
[8]Moon J,Choi I.Development of natural meat-like flavor based on Maillard reaction products[J].Korean Journal for Food Science of Animal Resources,2011,31(1):129-138.
[9]Jorge L,Garden T,Dermis W.Effect of chemical modification of algae carboxyl groups onmetalion binding[J].Enviro Scitechnol,1990,24(9):1372-1378.
[10]李朝霞.海藻酸钠-壳聚糖-粉末活性炭生物微胶囊的制备[J].膜科学与科技,2007,27(6):37-41.
[11]李庆丽.重金属吸附剂的研究及其在蚝油中的应用[D].青岛:中国海洋大学,2009.
[12]Maillard M N,Billaud C,Chow Y N,et al.Free radical scavenging,inhibition of polyphenoloxidase activity and copper chelating properties of model Maillard systems[J].Swiss Society of Food Science and Technology,2007,40(8):1434-1444.
[13]王秀娟.海藻酸钠凝胶特性的研究[J].食品工业科技,2008,29(2):259-262.
[14]Pillai C,Willi P.Chitin and chitosan polymers:Chemistry,solubility and fiber formation[J].Progress in Polymer Science,2009,34(7):641-678.
[15]姚子昂,韩宝芹,刘万顺,等.不同分子量壳聚糖膜性质的研究[J].中国生物医学工程学报,2002,21(3):256-262.

