德国鸢尾对Cd胁迫的生理生态响应及积累特性
张呈祥,陈为峰
(山东农业大学资源与环境学院,泰安 271018)
Cd是一种对环境危害大且生物非必需的元素,不仅会导致土壤正常的功能失调、质量下降,而且会对植物产生毒害[1]。城市工业和交通的日益发达使越来越多的Cd释放到环境中并在土壤中大量积累,城市土壤Cd污染的治理已相当紧迫[2-3]。植物修复技术以其安全、廉价等众多优点成为学术界研究的热点[4],目前已经发现的超富集植物一般生长缓慢、Cd迁移总量相对不高且园林观赏价值一般,难以在城市地区大量应用[5]。利用地被植物修复城市土壤Cd污染,不仅可以净化土壤,而且可以获得景观和生态效应。
德国鸢尾(Iris germanica L.)是鸢尾科鸢尾属多年生宿根花卉,是在鸢尾的基础上,经过处理的杂交矮生品种,其形态优美、花色艳丽、适应性强、管理粗放,作为城市节约型绿化的重要地被材料被广泛应用[6]。目前对德国鸢尾的研究主要集中在分类育种[7]、繁育[8]及抗旱性[9]等方面,关于Cd胁迫方面的研究鲜有报道。本文研究了德国鸢尾在不同浓度Cd胁迫下的生长状况、生态效应、生理特性、吸收和富集Cd的能力,旨在为德国鸢尾在城市特别是Cd污染地区的园林应用提供参考,探讨Cd对德国鸢尾的伤害机理及德国鸢尾在Cd污染土壤修复中的应用潜力。
1 材料与方法
1.1 供试材料
供试德国鸢尾由泰安恒源大地景观工程有限公司提供。供试土壤取自泰安周边地区,褐土,pH值7.0,有机质10.5 g/kg,全氮0.65 g/kg,速效钾0.032 g/kg,速效磷 0.032 g/kg,Cd 0.083 mg/kg。Cd添加形式为CdCl2·2.5H2O,分析纯。
1.2 试验方法
室外盆栽试验于2010年9月至2011年6月份在山东农业大学实验基地进行。土壤风干后过1 cm筛,拌入5%质量草炭作基肥,充分混合后装入下口直径16.5 cm、上口直径21 cm、高22 cm的塑料盆中,每盆装土5.5 kg。试验以不使用Cd处理作为对照,Cd所设浓度梯度为:0.5、1、5、10、20 mg/kg(含背景值,以Cd2+计),每个处理3次重复。
按预先设置的浓度于每盆中添加CdCl2·2.5H2O并混合均匀,喷施清水平衡3周后从苗床上小心移取长势大小均一致的德国鸢尾幼苗,用蒸馏水洗净根系泥土,去除地上部分后移植于盆中,进行正常养护管理,保持土壤含水量为其田间持水量的60%。试验期间每月取德国鸢尾根际土壤测定Cd浓度,根据测定结果补充CdCl2·2.5H2O,使土壤Cd维持在试验所设浓度,避免各处理下的土壤Cd浓度随着试验进程下降,难以进行关联分析;同时可以更加准确地模拟城市土壤Cd污染特征。补充方法为将CdCl2·2.5H2O溶于100 mL蒸馏水并浇灌进入盆土。
2010年9月28日移栽后每隔10 d用尺子直接量取株高直至株高不再随时间增长,株高为德国鸢尾最顶端到地面的垂直高度;试验期间观测德国鸢尾花期和绿期长短,以花序完全舒展开为开花期、花序枯黄为谢花期,以叶片完全枯黄为枯黄期、春季长出新叶为返青期。
2011年6月2日,德国鸢尾谢花期后。使用CB1102型光合蒸腾仪在晴朗无风的条件下不离体测定德国鸢尾同一部位成熟叶片的净光合速率和蒸腾速率,从8:00到18:00每隔2 h测定1次。晚上的暗呼吸量按白天同化量的20%计[10],计算单位面积叶片日净同化量(P)、日固定CO2量(WCO2)和释放O2量(WO2),单位面积叶片日蒸腾总量(E)、蒸腾使周围空气降温量(ΔT)和绝对湿度增加量(Δa)。
2011年6月28日测定倒3片功能叶叶面积(采用美国LI-COR公司产LI-3000A型便携式叶面积测定仪测定);取成熟鲜叶片测定生理指标、取根系测定根系活力,然后将德国鸢尾分为地上部分和根系两组收获,用蒸馏水冲洗干净,测定分蘖数后沥去水分,105℃杀青30 min。之后在70℃下烘干至衡重,分别测定地上部分和根系干重作为生物量。磨碎,过60目筛,测定Cd含量并计算富集系数、转运系数。
1.3 测定方法
土壤基本理化性质按土壤农化常规分析法测定[11]。
生理指标的测定按邹琦的方法[12]:含水量使用烘干称重法测定;细胞膜透性使用电导法测定;叶绿素含量使用丙酮提取,721型分光光度计测定;游离脯氨酸含量使用磺基水杨酸提取法测定;可溶性糖含量使用蒽酮比色法测定;根系活力用TTC法测定。
植株Cd含量采用HNO3-HClO4消化,原子吸收分光光度计测定[11]。
1.4 数据分析
所有测定均设置3次重复,使用Microsoft Excel计算平均值;用SAS数据分析软件进行标准差运算和差异显著性检验(a=0.05)。

式中,Pi为初测点瞬时净光合速率,Pi+1为下一点净光合速率。
WCO2和WO2的计算按刘维东的方法[10]。

式中,ei为初测点瞬时蒸腾速率,ei+1为下一点蒸腾速率。
ΔT和Δa的计算按杨士弘的方法[13]。
富集系数=植物地上部分或根系Cd积累浓度/土壤中Cd浓度[14](式中土壤中Cd浓度=试验期间添加Cd的总量/盆土质量)。
转运系数=地上部分Cd积累浓度/根系Cd积累浓度[15]。
积累量=植物地上部分或根系Cd积累浓度×地上部分或根系生物量。
2 结果与分析
2.1 Cd对德国鸢尾生长的影响
Cd浓度小于5 mg/kg时对德国鸢尾株高增长影响不大;大于5 mg/kg时抑制了德国鸢尾的株高增长(图1)。Cd浓度小于1 mg/kg时德国鸢尾20 d到40 d之间的株高高于对照,50 d时的株高与对照相近。Cd浓度为5 mg/kg时德国鸢尾整个生育期株高与对照相近。Cd浓度大于10 mg/kg时德国鸢尾20 d后株高低于对照,生长受到抑制。

图1 Cd处理下德国鸢尾株高Fig.1 Plant height of Iris germanica L.under different Cd treatments
Cd浓度小于5 mg/kg时叶面积高于对照且不同浓度Cd处理间差异不显著,Cd浓度大于5 mg/kg时随着浓度增大叶面积迅速降低。分蘖数随着Cd浓度的增大逐渐降低但与对照差异不显著。生物量随着Cd浓度的增大先缓慢降低后迅速降低,Cd浓度为0.5 mg/kg时与对照差异不显著,大于10 mg/kg时显著低于对照。Cd浓度小于1 mg/kg时德国鸢尾绿期延长,小于10 mg/kg时花期延长,其中Cd浓度为1 mg/kg时绿期和花期均达到最大值,分别较对照延长11 d和5 d。Cd对德国鸢尾生长状况的影响呈现浓度效应:Cd浓度小于5 mg/kg时影响不大,大于10 mg/kg时显著抑制德国鸢尾生长(表1)。
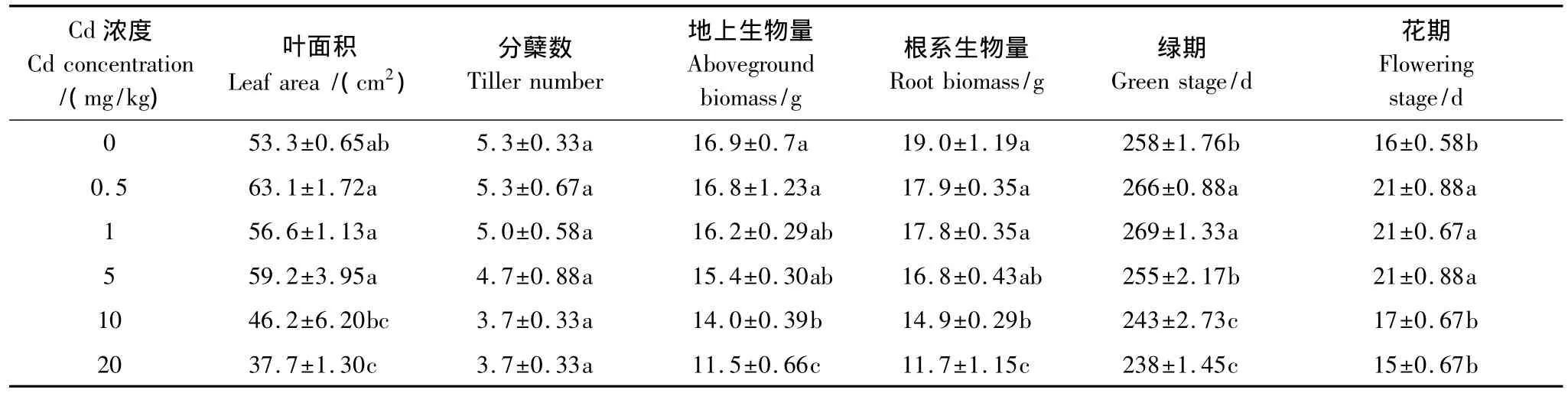
表1 Cd处理下德国鸢尾的生长状况Table 1 Growth of Iris germanica L.under different Cd treatments
2.2 Cd对德国鸢尾光合和蒸腾的影响
Cd对德国鸢尾8:00和18:00的瞬时净光合速率影响不大,但降低了德国鸢尾8:00—18:00之间的净光合速率(图2)。Cd浓度为0.5 mg/kg时净光合速率随时间的变化与对照相近,但12:00—16:00间的净光合速率低于对照;Cd浓度大于1 mg/kg时,净光合速率低于对照且随着浓度的增大降低;Cd浓度大于10 mg/kg时,不同浓度Cd处理间净光合速率变化曲线相近但低于其他处理。
Cd降低了德国鸢尾全天的蒸腾速率,随着Cd浓度的增大蒸腾速率降低。Cd浓度小于5 mg/kg时,德国鸢尾14:00前的蒸腾速率变化曲线与对照相近,14:00后的蒸腾速率低于对照;Cd浓度大于10 mg/kg时,不同浓度Cd处理间蒸腾速率变化曲线相近但低于其他处理。

图2 Cd处理下德国鸢尾的净光合速率和蒸腾速率日变化Fig.2 Diurnal changes of net photosynthesis and transpiration rates of Iris germanica L.under different Cd treatments
Cd降低了德国鸢尾的单位叶面积净同化量和蒸腾量,使德国鸢尾吸碳、释氧、降温、增湿等生态效应均低于对照(表2)。所有浓度Cd处理的德国鸢尾吸碳、释氧量均明显低于对照,Cd浓度小于1 mg/kg时蒸腾作用导致的周围空气降温量和绝对湿度增加量与对照差异不显著,可见低浓度Cd对德国鸢尾光合的抑制较蒸腾强烈。随着Cd浓度的增大,德国鸢尾的生态效应逐渐降低,Cd浓度为20 mg/kg时单位面积叶片日净同化量和日蒸腾总量均最低,分别为对照的80.0%和77.0%,可见高浓度Cd对德国鸢尾光合和蒸腾的抑制程度相近。
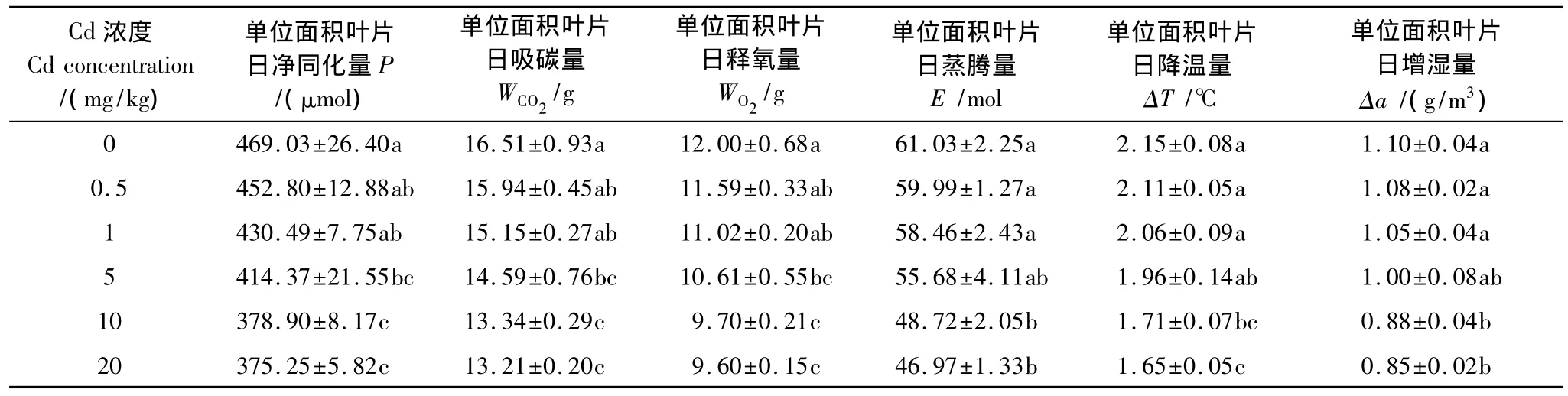
表2 Cd处理下德国鸢尾的生态效应变化Table 2 Changes of ecological benefits of Iris germanica L.under different Cd treatments
2.3 Cd对德国鸢尾生理指标的影响
Cd处理下德国鸢尾叶片叶绿素含量和根系活力低于对照,叶绿素a/b和含水量低于对照但差异不显著,细胞膜透性显著高于对照(表3)。随着Cd浓度的增大,叶绿素含量逐渐降低,叶绿素a/b、根系活力和含水量也呈逐渐降低的趋势,细胞膜透性逐渐升高,游离脯氨酸和可溶性糖含量先升高后降低。Cd浓度为0.5 mg/kg时根系活力和游离脯氨酸含量与对照相近;Cd浓度在1 mg/kg—10 mg/kg之间时,不同处理间叶绿素含量、根系活力、细胞膜透性和可溶性糖含量差异不显著;Cd浓度为5 mg/kg时游离脯氨酸和可溶性糖含量均最高,Cd浓度为20 mg/kg时叶绿素含量最低,为对照的74.0%;细胞膜透性最大,为对照的3.2倍;可溶性糖含量低于对照。
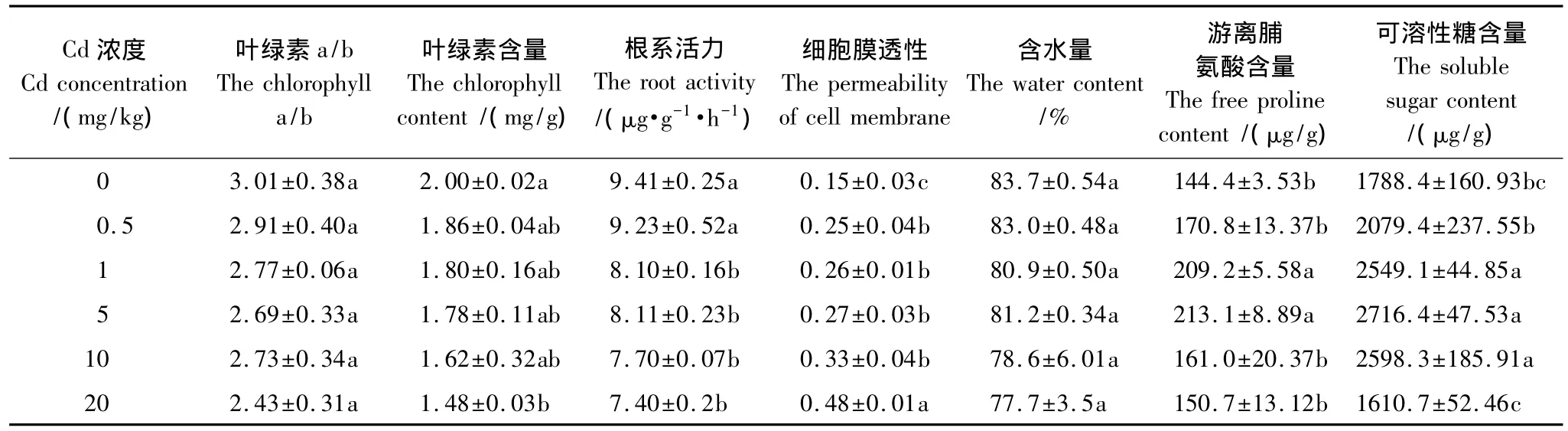
表3 Cd处理下德国鸢尾部分生理指标的变化Table 3 Physiological indexes of Iris germanica L.under different Cd treatments
2.4 Cd在德国鸢尾体内的积累和分布情况
德国鸢尾地上部分和根系的Cd积累浓度和积累量随着Cd浓度的增大逐渐升高,Cd浓度相同时根系积累浓度和积累量高于地上部分(表4)。Cd浓度为20 mg/kg时德国鸢尾体内Cd积累量最大,为2.122 mg/株。德国鸢尾根系和地上部分对Cd的富集系数均大于1.0,随着Cd浓度的增大,德国鸢尾根系和地上部分对Cd的富集系数均逐渐降低,转运系数逐渐降低。
3 讨论
生长状况决定了地被植物的景观效益。本试验低浓度Cd对德国鸢尾生长影响不大,高浓度Cd抑制德国鸢尾生长,与周守标对菰和菖蒲的研究结果一致[16]。Cd胁迫会打破植物细胞内活性氧产生与清除之间的平衡,导致膜脂过氧化和脱脂化作用从而破坏细胞膜结构[17],使膜透性增大、内部环境的稳定性降低(表3),进而对植物体造成伤害。Cd浓度小于5 mg/kg时德国鸢尾生长状况与对照相近(图1,表1),可见耐性较强、适用于土壤修复,原因是游离脯氨酸和可溶性糖等逆境保护性物质的积累缓解了低浓度Cd的伤害(表3)。游离脯氨酸可以清除活性氧[18]并和可溶性糖共同调节渗透平衡[19]。本试验Cd胁迫下德国鸢尾分蘖数降低的原因是Cd与Ca竞争,影响Ca调素的活性进而影响细胞分裂。同时Cd能与带负电的核酸结合,破坏核仁结构,抑制DNase和RNase活性,使细胞分化受阻[20]。德国鸢尾不同部位对Cd胁迫的敏感性不同,Cd浓度为20 mg/kg时地上部分和根系生物量分别为对照的68.0%和61.6%(表1),可见Cd对德国鸢尾根系生长的抑制较地上部分强烈。Cd浓度小于1 mg/kg时德国鸢尾绿期延长、小于10 mg/kg时花期延长(表1),可见Cd可以一定程度上提高德国鸢尾的景观质量。绿期延长的原因是Cd胁迫下细胞活性的降低和逆境保护性物质的积累增强了德国鸢尾的抗寒性,花期延长的原因可能是Cd引起德国鸢尾激素调节紊乱[21]使其提前进入生殖生长阶段。
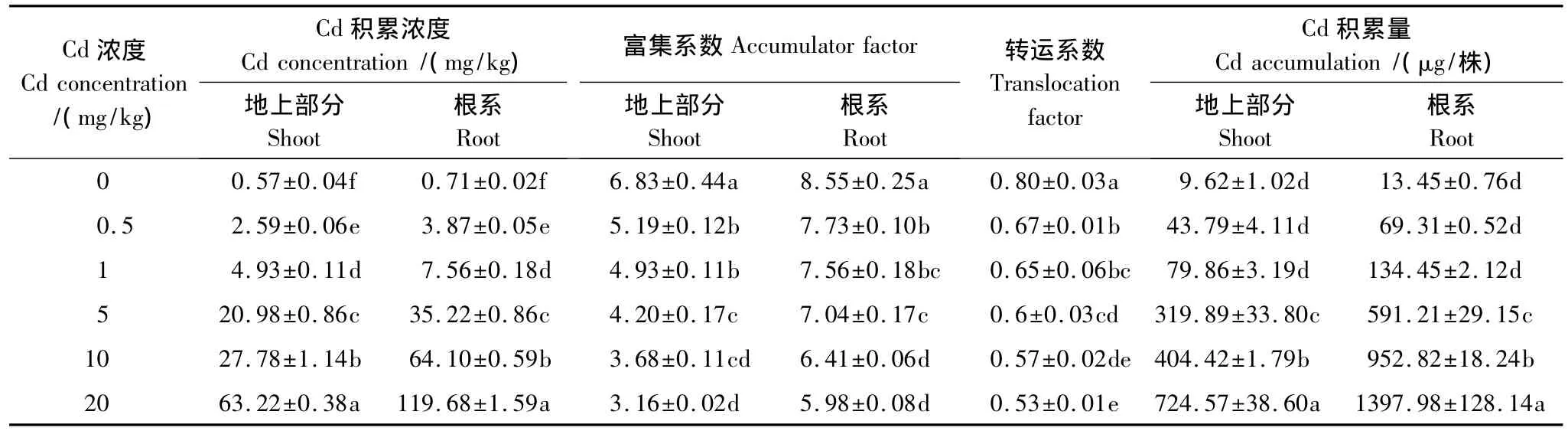
表4 Cd在德国鸢尾体内的积累和分布情况Table 4 Accumulation and distribution of Cd in Iris germanica L.
生态效应是地被植物选择与应用的重要依据。本试验Cd胁迫下德国鸢尾净光合速率和蒸腾速率均降低,与马新明[22]对烤烟的研究结果一致。净光合速率的降低导致吸碳、释氧量降低,蒸腾速率的降低导致降温、增湿量降低(表2)。本试验Cd胁迫下德国鸢尾叶片失水使保卫细胞膨压降低[23],引起气孔关闭、净光合速率和蒸腾速率降低。在光合作用的过程中,叶绿素b主要进行光能的收集,叶绿素a主要进行光能的转化,叶绿素a/b值越高,则植物对光能的利用效率越高[24]。本试验低浓度Cd对光合的抑制较蒸腾强烈,可见叶绿素含量和光能利用效率降低等非气孔因素是德国鸢尾净光合速率降低的主要原因。叶绿素含量降低的主要原因是叶绿体片层中捕光Chla/b-Pro复合体合成受抑制,同时Cd抑制叶绿素合成相关酶(原叶绿素脂还原酶、δ-氨基乙酰丙酸合成酶和胆色素原脱氨酶)的活性从而阻碍叶绿素的合成[25]。光能利用效率降低的原因是Cd胁迫下光合合成单位及膜结合电子传递进程被破坏,导致PSI和PSII电子传递速率降低[26];同时电子传递速率降低使反应中心激发的电子有更多传递给氧气的机会,这可能是导致植株体内活性氧积累的原因。Cd浓度为20 mg/kg时净同化量和蒸腾量降低程度相近(表2),可见高浓度Cd主要通过气孔因素抑制德国鸢尾的光合作用。
Cd累积能力的大小是修复物种选择与应用的重要指标。本试验Cd浓度为20 mg/kg时德国鸢尾地上部分对Cd的积累浓度最大,为63.22 mg/kg(表4),未达到超富集植物的标准[27]。随着Cd浓度的增大,德国鸢尾对Cd的富集系数逐渐降低,原因是Cd与琥珀酸脱氢酶结合降低了根系呼吸作用[28],导致根系活力降低(表3),抑制对Cd的吸收。德国鸢尾体内Cd分布格局为根系>地上部分,将有害离子积累于根部是植物阻止其对光合作用及新陈代谢活性毒害的一种策略[29],此策略是Cd对德国鸢尾根系生长的抑制较地上部分强烈的原因之一。随着Cd浓度的增大,德国鸢尾对Cd的转运系数逐渐降低,Cd在植物体内的运输是借ATPase(adenosine triphosphate enzyme,ATP酶)等的主动运输方式,随着Cd浓度的增大,ATPase活性降低抑制了Cd由根系向地上部分的转运。
由以上分析可知:Cd胁迫抑制了德国鸢尾的细胞分化、降低了光合和蒸腾作用,破坏了内环境的稳定性,使德国鸢尾的景观质量和生态效应降低;德国鸢尾对低浓度Cd有较强的耐性,适用于浓度小于5 mg/kg的Cd污染土壤的修复。低浓度Cd可以延长德国鸢尾的绿期和花期。德国鸢尾对Cd的积累能力一般且主要积累在根部,随着Cd浓度的增大德国鸢尾对Cd的富集系数和转运系数逐渐降低。
致谢:感谢李永强老师、李成亮老师对室内分析和写作给予的帮助。
[1]Moya J I,Ros R,Picazo I.Influence of cadmium and nickel on growth,net photosynthesis and carbohydrate distribution in rice plants.Photosynthesis Research,1993,36(2):75-80.
[2]Lu Y,Gong Z T,Zhang G L,Zhang B.Heavy metal concentration in Nanjing urban soils and their affecting factors.Chinese Journal of Applied Ecology,2004,15(1):123-126.
[3]Li Z P,Chen Y C,Yang X C,Wei S Q.Heavy Metals Contamination of Street Dusts in Core Zone of Chongqing Municipalit.Journal of Soil and Water Conservation,2006,20(1):114-116.
[4]Zhou Q X,Wei S H,Diao C Y.Basic principles and researching progresses in ecological remediation of contaminated soils.Journal of Agro-Environment Science,2007,26(2):419-424.
[5]Wang Q R,Cui Y S,Dong Y T.Phytoremediation-An effective approach of heavy metal cleanup from contaminated soil.Acta Ecologica Sinica,2001,21(2):326-331.
[6]Wang Q P.Study on Cultivars Ecological Evaluation and Fertilization and Weeding Control of Tall Bearded Iris[D].Tai'an:Shandong Agricultural University,2007.
[7]Huang S Z.Studies on Evaluation and Germplasm Innovation for Some Plant Resources of Iris L.[D].Nanjing:Nanjing Agricultural University,2004.
[8]Guo J Y,Zhang J Z,Sun G F,Shi L.Effects of 6-BA Application on Promotion of Offset Formation in Iris germanica.Acta Horticulturae Sinica,2007,34(2):461-464.
[9]Zhou Y.Studies on the Drought Resistance of 7 Iris Species[D].Urumqi:Xinjiang Agricultural University,2006.
[10]Liu W D.Studies on Ecological Effect and Selection of Roof Greening Plants in Chengdu City[D].Chengdu:Sichuan Agricultural University,2006.
[11]Bao S D.Soil and Agricultural Chemistry Analysis.3rd edition.Beijing:China Agriculture Press,2000.
[12]Zou Q.The Experimental Guide for Plant Physiology.Beijing:China Agriculture Press,2000.
[13]Yang S H.Urban Eco-environmental Science.Beijing:Science Press,2003:161-164.
[14]Chamberlain A C.Fallout of lead and uptake by crops.Atmospheric Environment,1983,17(4):693-706.
[15]Baker A J M,Reeves R D,Hajar A S M.Heavy metal accumulation and tolerance in British populations of the metal lophyte Thlaspicaerulescens J.& C.Presl(Brassicaceae).New Phytologist,1994,127(1):61-68.
[16]Zhou S B,Wang C J,Yang H J,Bi D,Li J H,Wang Y.Stress responses and bioaccumulation of heavy metals by Zizania latifolia and Acorus calamus.Acta Ecologica Sinica,2007,27(1):281-287.
[17]Yan A L,Wu T T,Wang Y B,Zhang X Q.The characteristics of cadmium tolerance and accumulation in three kinds of ornamental plants.Acta Ecologica Sinica,2010,30(9):2491-2498.
[18]Smimoff N.The role of active oxygen in the response of plants to water deficit and desiccation.New Phytologist,1993,125(1):27-58.
[19]ChenY,Burris J S.Role of carbohydrates in desiccation tolerance and membrane behavior in maturing maize seed.Corp Science,1990,30(5):971-975.
[20]Romanowska E,Wróblewska B,Dro˙zak A,Zienkiewicz M,Siedlecka M.Effect of Pb ions on superoxide dismutase and catalase activities in leaves of pea plants grown in high and low irradiance.Biologia Plantarum,2008,52(1):80-86.
[21]Wu K,Wu Z H,Tai F J,Han Y,Xie B E,Yuan Z L.Effects of cadmium on the contents of phytohormones,photosynthetic performance and fluorescent characteristics in tobacco leaves.Acta Ecologica Sinica,2011,31(16):4517-4524.
[22]Ma X M,Li C M,Tian Z Q,Yuan Z L.Effects of Cd pollution on photosynthetic characteristics,yield and quality of tobacco leaves.Acta Ecologica Sinica,2006,26(12):4039-4044.
[23]Cai H X,Wu F Z,Yang W Q.Effects of drought stress on the photosynthesis of Salix paraqplesia and Hippophae rhamnoides seedlings.Acta Ecologica Sinica,2011,31(9):2430-2436.
[24]Huff A.Peroxidase-catalysed oxidation of chlorophyll by hydrogen peroxide.Phytochemisty,1982,21(2):261-265.
[25]Somashekaraiah B V,Padamajaes K,Prasad A R K.Phytotoxicity of cadmium ions on germinating seedlings of mung bean(Phaseolus vulgarize):Involvement of lipid peroxides in chlorphyll degradation.Plant Physiology,1992,85(1):85-89.
[26]Biehler K,Migge A,Fock H P.The role of malate dehidrogenase in dissipating excess energy under water stress in two wheat species.Photosynthetica,1996,32(3):431-438.
[27]Baker A J M,Brooks R R.Terrestrial higher plants which hyperaccumulate metallic elements:a review of their distribution,ecology and phytochemistry.Biorecovery,1989,1(2):81-126.
[28]Bernal M P,McGrath S P.Effects of PH and heavy metal concentrations in solution culture on the proton release,growth and elemental composition of alyssum murale and raphanus sativus L.Plant and Soil,1994,116(1):83-92.
[29]Zurayk R,Sukkariyah B,Baalbaki R.Common hydrophytes as bioindicators of nickel,chromium and cadmium pollution.Water,Air,and Soil Pollution,2001,127(1/4):373-388.
参考文献:
[2]卢瑛,龚子同,张甘霖,张波.南京城市土壤重金属含量及其影响因素.应用生态学报,2004,15(1):123-126.
[3]李章平,陈玉成,杨学春,魏世强.重庆市主城区街道地表物中重金属的污染特征.水土保持学报,2006,20(1):114-116.
[4]周启星,魏树和,刁春燕.污染土壤生态修复基本原理及研究进展.农业环境科学学报,2007,26(2):419-424.
[5]王庆仁,崔岩山,董艺婷.植物修复-重金属污染土壤整治有效途径.生态学报,2001,21(2):326-331.
[6]王清萍.高型有髯鸢尾品种生态评价及其施肥、除草技术研究[D].泰安:山东农业大学,2007.
[7]黄苏珍.鸢尾属(Iris L.)部分植物资源评价及种质创新研究[D].南京:南京农业大学,2004.
[8]郭晋燕,张金政,孙国峰,石雷.喷施6-BA促进德国鸢尾根茎芽的萌发.园艺学报,2007,34(2):461-464.
[9]周源.七种鸢尾的抗旱性研究[D].乌鲁木齐:新疆农业大学,2006.
[10]刘维东.成都市屋顶绿化植物的选择及其生态效益研究[D].成都:四川农业大学,2006.
[11]鲍士旦.土壤农化分析(第三版).北京:中国农业出版社,2000.
[12]邹琦.植物生理学实验指导.北京:中国农业出版社,2000.
[13]杨士弘.城市生态环境学.北京:科学出版社,2003:161-164.
[16]周守标,王春景,杨海军,毕德,李金花,王影.菰和菖蒲对重金属的胁迫反应及其富集能力.生态学报,2007,27(1):281-287.
[17]燕傲蕾,吴亭亭,王友保,张旭情.三种观赏植物对重金属镉的耐性与积累特性.生态学报,2010,30(9):2491-2498.
[21]吴坤,吴中红,邰付菊,韩莹,谢宝恩,袁祖丽.镉胁迫对烟草叶激素水平、光合特性、荧光特性的影响.生态学报,2011,31(16):4517-4524.
[22]马新明,李春明,田志强,袁祖丽.镉污染对烤烟光合特性、产量及其品质的影响.生态学报,2006,26(12):4039-4044.
[23]蔡海霞,吴福忠,杨万勤.干旱胁迫对高山柳和沙棘幼苗光合生理特征的影响.生态学报,2011,31(9):2430-2436.

