纳米磁珠富集处理临床标本在分枝杆菌培养中的初步应用
王相栋 邵吉宝 施旭东
结核分枝杆菌的细菌学培养鉴定是结核病诊断的金标准,目前在我国各级结核病诊断实验室中,最常用的方法仍然是基于罗氏培养基的固体培养法。而标本的前处理是其关键步骤,常用的方式是NaOH去污染消化后直接接种或离心富集的方式。采用较好的标本处理方法能够提高阳性率、缩短检出时间以及减少实验室污染的发生[1]。纳米磁珠作为一种磁流体,既具有液体的流动性,又易于吸附分离,在生物医学上具有广泛的运用。本研究采用纳米磁珠富集的方式处理临床标本,并与直接接种法、离心法对比,以验证其在分枝杆菌罗氏培养检测中运用的可行性和优缺点。
材料和方法
一、 标本和试剂
1.标本来源和选取:选取我院2012年12月至2013年3月间门诊和病房送检的结核病患者送检标本,在选择痰液标本时用目视检查法[2]控制质量,即干酪痰、褐色血痰或含少量新鲜血液的血痰、黏液痰,标本量>2 ml。最终对103份临床标本(痰液93份,支气管灌洗液7份,胸腔积液3份)进行实验研究;其中男51例,平均年龄(49.20±18.71)岁;女52例,平均年龄(47.54±17.58)岁。标本中有94份标本来自于既往肺结核患者和研究期间最终被诊断为肺结核的患者,其余9份标本为肺部其他细菌感染。
2.仪器和试剂:D8401型多功能电动搅拌器(天津华兴伟业实验仪器有限公司)、雷磁pHSJ-3F pH计(上海雷磁创益仪器仪表有限公司)、超声波细胞破碎仪XO-650(南京先欧仪器制造有限公司)、超级恒温油槽YJ601(上海跃进医疗器械厂)、分析天平CP114(奥豪斯仪器上海有限公司)、磁力吸附分离试管架(自制)。0.22 μm的滤膜购自美国颇尔公司(Pall Corporation)。酸性罗氏培养基和中性罗氏培养基购自珠海贝索生物技术有限公司。以下试剂均为分析纯:FeCl2·4H2O购自上海强顺化学试剂有限公司;PEG600和浓氨水购自上海凌峰化学试剂有限公司;FeCl3·6H2O、NaOH、HCl、谷氨酸钠、KH2PO4、K2HPO4、柠檬酸、H3PO4购自国药集团化学试剂有限公司。
二、方法
1.PEG600纳米磁珠的制备:整个操作过程在通氮气去氧的环境中进行。按摩尔比[溶液中所含物质分子数(mol)的比值]1∶2将一定量FeCl2与FeCl3溶液加入100 ml去离子水中,机械搅拌(300 r/min)下加入PEG600(摩尔比为15),持续搅拌20 min。随后快速滴加氨水(浓氨水5倍稀释),并测量pH值达10.0以上,持续搅拌条件下反应10 min;然后置80 ℃条件下(恒温水槽中)持续搅拌,老化30 min。以强力磁铁吸附分离,用去离子水洗涤,450 W超声分散20 min,再用去离子水洗涤,共3次。用pH值为7.0的0.1 mol/L K2HPO4-柠檬酸缓冲液中和到中性。用0.22 μm的滤膜过滤。湿法保存[3]。
2.标本的去污染和消化:参考文献[2]和[4]作适当调整。痰、灌洗液和胸腔积液标本均各取2 ml加入含有碎玻璃的试管,加入2~4倍量的0.625 mol/L(2.5%)NaOH(终浓度为1.7%~2%),2 min后充分振荡,室温放置30 min进行消化。
3.直接接种法培养:取0.1 ml处理后的样品直接接种至酸性罗氏培养基斜面上,每份标本平行接种2管酸性罗氏培养基。置37 ℃温箱中斜面向上平放1 d后,培养8周,每周观察记录结果。
4.离心法培养:取消化好的标本2 ml,加入 0.23 mol/L 的H3PO43 ml,中和至pH 值6.5~7.5 之间,3000×g,离心 20 min。快速倾倒弃去上清,以残留上清(约0.2 ml)冲洗试管底部,全部接种至2管中性罗氏培养基斜面上。置37 ℃温箱中斜面向上平放1 d后,继续培养8周,每周观察记录结果。
5.磁珠富集法培养:取消化好的标本2 ml,加入0.23 mol/L的H3PO4溶液,中和至pH 值6.5~7.5之间;然后加入PEG600纳米磁珠悬液0.2 ml,加塞混匀,37 ℃放置40 min。快速倾倒弃去上清,以残留上清(0.2 ml)冲洗试管底部,全部接种至2管中性罗氏培养基斜面上。置37 ℃温箱中斜面向上平放1 d后,培养8周,每周观察记录结果[3]。
6.结果判断:(1)初生长时间的判定:以首次发现培养基斜面上有菌落生长的时间为标准。(2)污染率的判定:以标本的份数为计算单位,同一份标本的2个接种管均污染时认为污染,若只有单只接种管污染则不认为污染。污染率=污染份数/样本数×100%[5]。
7.统计学分析:采用SPSS 17.0统计软件进行分析,计数资料采用卡方检验进行分析比较,以 Kolmogorov-Smirnov法检测正态性,非正态分布的计量资料采用Wilcoxon秩和检验进行分析,P<0.05为差异有统计学意义。
结 果
1.各种标本处理方法的培养检测敏感度及比较:94份肺结核患者标本共有42份被检出阳性,9份肺部其他细菌感染的标本培养结果均为阴性(特异度100.00%);检测敏感度以阳性率表示。直接接种法检出28份,阳性率为29.79%(28/94),离心法和磁珠富集法阳性率分别为43.62%(41/94)、41.49%(39/94);所有直接接种法阳性的标本,离心法和磁珠富集法检测均为阳性,具体见表1。
3种方法间比较分析,采用配对卡方检验。磁珠富集法、离心法阳性率均高于直接接种法,差异均有统计学意义(χ2值分别为9.09、11.08,P值均<0.01);离心法与磁珠富集法间差异没有统计学意义(χ2=0.25,P=0.62)。直接接种法未检出的14份样本,磁珠富集法检出11份,离心法检出13份;11份生长的菌落数小于10个的标本(离心法与磁珠富集法检测),直接接种法仅检出2份。
2.污染率:直接接种法、离心法和磁珠富集法的污染率分别为:2.91%(3/103)、4.85%(5/103)、3.88%(4/103)。三者间采用配对卡方检验进行比较。直接接种法与离心法比较,χ2=0.50,P=0.48;磁珠富集法与离心法、直接接种法比较,χ2值均为0.00,P值均为1。三者间差异均无统计学意义。
3.平均初生长时间:具体见表2。离心法和磁珠富集法的初生长时间数据呈非正态分布(Kolmogorov-Smirnov正态性检验结果,P值均<0.01);直接接种法与离心法、磁珠富集法有28份样本共阳性,采用两配对样本的Wilcoxon秩和检验对28份共阳性标本3种方法的初生长天数进行比较。直接接种法与磁珠富集法比较:Z=-3.983,P<0.01,差异有统计学意义;直接接种法与离心法比较:Z=-3.980,P<0.01,差异有统计学意义。离心法与磁珠富集法间有38份样本共阳性,对初生长时间进行比较:Z=-0.557,P=0.577,差异无统计学意义(表2)。
讨 论
1. 标本去污染和消化步骤的改进:为了改善标本的前处理步骤,提高结果的阳性率、缩短检出周期、减少环境污染的发生。本研究采用磁珠富集法与实验室常用的离心法、直接接种法进行比较,以验证其可行性和优缺点。笔者根据患者标本的实际情况,在参考国家规范的基础上对标本去污染和消化步骤作了一定改变。我院临床标本中许多标本来自既往肺结核患者,大多已经经过治疗再复查,菌体已经有所损伤。对比观察中发现以1 mol/L(4%)NaOH浓度[2]相对偏高以致阳性率下降,而采用1996年的标准[4]污染率又相对偏高,因此采用0.625 mol/L(2.5%)的NaOH进行处理,能够得到较高的阳性率、较低的污染率和较好的液化效果。同时参考Ratnam等[6]的报道,简化了离心法的步骤, 加入 0.23 mol/L的H3PO4溶液3 ml可以使其与加入的NaOH形成pH值在7.0左右的缓冲体系,并且可以中和标本pH值在6.5~7.5之间,如此避免了使用大体积PBS中和的步骤,节省了操作时间;由于加入的原始样本量仅相当于0.40~0.67 ml(2 ml去污染消化后的样本为3~5倍稀释的),以残留上清(约0.2 ml)完全可以将沉淀全部重悬。实验中采用碎玻璃片取代玻璃珠是为了借助其切割力来更快的消化与均质样本。
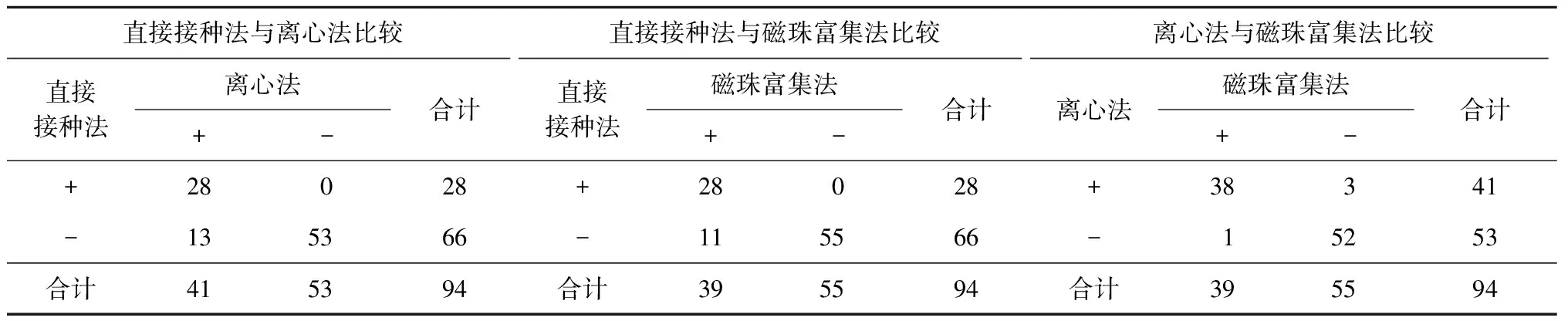
表1 94份肺结核患者标本3种处理方法培养结果对比(份)
注+:为培养阳性;-:为培养阴性

表2 标本不同处理方法处理后的分枝杆菌初生长时间
注由于数据呈非正态分布,用中位数及四分位数间距表示[M(P25,P75)]
2.本研究3种方法间检出阳性率的比较:94份肺结核患者标本以磁珠富集法和离心法前处理的阳性率要高于直接接种法,差异有统计学意义,而磁珠富集法和离心法间比较时差异无统计学意义。11份磁珠富集法和离心法检测阳性而菌落生长数小于10个的样本,直接接种法仅检测出2份,可见经过离心或者磁珠富集后,培养检测的敏感度有很大的提高。国内赵立平等[5]报道了离心法与直接涂片法差异不显著, Liu等[7]报道了磁珠法、离心法用于涂片镜检的阳性率要高于直接涂片法,这可能与标本的选取有关。在Liu等[7]的研究中不对标本的性状作判断,惟一标准是标本量>2.5 ml,这样有利于观察比较检测方法的敏感度,而赵立平等[5]所选取标本来自国家结核病临床实验室,直接涂片阳性率就高达50.0%(99/198),可能标本中结核分枝杆菌数量较多;这样使得离心法与直接涂片法均能得到阳性结果,再以阳性率比较就不能很好体现离心法的富集作用。国外Wilson等[8]对比了离心法和磁珠富集法用于涂片镜检的结果,两种方法阳性率相似;Mitarai等[9]在标本经过去污染和消化后,以TRICORE试剂吸附分离样本中分枝杆菌后直接接种于固体和液体培养基,发现以液体培养基培养时两者阳性率相似,但在Ogawa固体培养基上磁珠富集法要优于离心法。笔者根据相似相溶原则,以亲脂性的PEG600包被磁珠,制备成纳米颗粒以增加表面积,增强吸附能力。吸附后沉淀直接接种以减少洗脱过程可能会有的损失。研究中3种处理方法的污染率均未超过5%,三者间差异没有统计学意义,说明磁珠富集法与离心法并没有在增加阳性率的同时,造成标本污染概率的加大。
3.本研究3种方法间初生长时间的比较:对3种处理方法的初生长时间比较,发现直接接种法的平均初生长时间[M(P25,P75)]最长[28(21,40) d],磁珠富集法与离心法培养所需的初生长时间均短于直接接种法,差异均具有统计学意义,而磁珠富集法与离心法两者间的初生长时间差异没有统计学意义,说明这2种方法均可缩短报告结果的时间。需要补充说明的是本次研究没有对阳性菌株作进一步鉴定,其中可能包括了非结核分枝杆菌感染的情况,但对平均初生长时间的比较是在共阳性标本间进行的,所以并不影响磁珠富集法、离心法可以缩短培养检测周期的判断。
本研究结果显示,本室自制磁珠能够较好地富集样本中分枝杆菌并提高阳性率,与传统离心的富集方式比较,有不需要离心设备、不受离心机通量影响的优点;与免疫磁珠法比较[10],成本十分低廉;制备方法简单,其性能可以比拟类似的进口磁珠富集分枝杆菌试剂盒;由于操作过程几乎全在生物安全柜内进行,对环境的污染几率也较小,也不存在离心过程会产生气溶胶的问题。其阳性检出率与离心法差异无统计学意义,说明磁珠富集法可以作为一种标本的富集方法,具有一定的临床实用性;并且其有可能在未来的全自动化封闭操作中发挥重要作用。
[1] Rodrigues C,Vadwai V. Tuberculosis: laboratory diagnosis. Clin Lab Med,2012,32(2):111-127.
[2] 赵雁林,王黎霞,成诗明,等.分枝杆菌分离培养标准化操作规程及质量保证手册.北京:人民卫生出版社,2013:16-34.
[3] 王相栋,邵吉宝,施旭东,等.用纳米磁珠吸附富集样本中结核分枝杆菌.临床检验杂志,2013,31(2):87-89.
[4] 中国防痨协会. 结核病诊断细菌学检验规程.中国防痨杂志,1996,18(1):28-31.
[5] 赵立平,朱玛,姜广路,等.不同痰标本处理方法对结核分枝杆菌罗氏培养检测结果的影响.中国防痨杂志,2013,35(2):93-96.
[6] Ratnam S,Stead FA,Howes M. Simplified acetylcysteine-alkali digestion-decontamination procedure for isolation of Mycobacteria from clinical specimens. J Clin Microbiol,1987,25(8):1428-1432.
[7] Liu J,Sun ZQ,Pei H. Increased case finding of tuberculosis from sputum and sputum deposits after magnetic bead concentration of mycobacteria. J Microbiol Methods,2013,93(2):144-147.
[8] Wilson S,Lane A,Rosedale R, et al. Concentration ofMycobacteriumtuberculosisfrom sputum using ligand-coated magne-tic beads. Int J Tuberc Lung Dis,2010,14(9):1164-1168.
[9] Mitarai S, Karinaga R,Yamada H, et al. TRICORE, a novel bead-based specimen concentration method for the culturing ofMycobacteriumtuberculosis. J Microbiol Methods,2012,90(3):152-155.
[10] 杨江华,王文杰,何自芳,等.免疫磁珠捕获法分离抗酸杆菌的实验研究.中国病原生物学杂志,2011,6(3):168-169.

