斑马鱼CFL基因的克隆、多克隆抗体的制备及分析
王盼盼,彭夕洋,易 珍,江志刚,邓 云,吴秀山,万永奇
斑马鱼CFL基因的克隆、多克隆抗体的制备及分析
王盼盼,彭夕洋,易 珍,江志刚,邓 云,吴秀山,万永奇*
(湖南师范大学 蛋白质化学及鱼类发育生物学教育部重点实验室 心脏发育研究中心, 湖南 长沙, 410081)
在心脏发育过程中,相关基因的正常表达是有功能心脏形成的关键.斑马鱼CFL基因是从斑马鱼胚胎的cDNA文库中克隆出来的一个心脏发育候选基因. 生物信息学分析表明: CFL基因编码278个氨基酸, 含有一个CXXC结构域. 为进一步研究该基因的功能, 采用生物信息学结合RT-PCR的方法获得了该基因. 将所得片段插入原核表达载体pET-28a载体中, 经测序鉴定正确后转化入Rosetta菌株中, 用IPTG诱导表达出pET- 28a-CFL融合蛋白, 表达的融合蛋白占菌体总蛋白的71%, 融合蛋白相对分子质量约为30 kD. 经包涵体纯化后, 免疫新西兰大白兔制备了多克隆抗体. 经验证, 具有较好的特异性和较高的效价, 可以用作western-blot免疫印迹等实验分析.
CFL基因; 融合蛋白; 多克隆抗体
随着医学的发展和医学知识的普及, 人类健康状况发生了显著改善, 平均寿命得到延长. 在工业发达地区, 常见的致残或者致死的疾病曾经是以传染病及营养缺乏疾病为主, 目前却逐步向慢性疾病转变, 比如心血管疾病和肿瘤等. 据世界卫生组织的资料, 全球近1/3的死亡人数是由心血管疾病所致, 心血管疾病是中低收入国家面临的一个重大问题. 并且越来越多的人正在受到高血压和糖尿病等病症的威胁[1]. 在我国, 心血管疾病的发病率和死亡率一直呈持续上升趋势, 估计全国心血管病患者达2.3亿人, 而我国每年死于心血管病的人数约300万, 几乎每死亡3个人中就有1人是心血管病, 平均每小时心血管病死亡340人[2]. 更令人不安的是, 据世界卫生组织统计, 到2020年, 我国每年因心血管疾病死亡的人数将可能达到400万. 然而随着新诊断技术的不断出现以及分子生物学的发展, 对一些心血管病的病因及发病机制在基因和蛋白质组学的水平上有了新的认识, 其对心脏病的治疗前景将会有很大改观.
脊椎动物的心脏由侧板中胚层中的脏壁中胚层与邻近组织相互作用发育而成, 脊椎动物心脏发育的过程异常复杂[3-4]. 心血管系统在诸多生理系统中, 是第一个行使功能的系统, 其它各器官的发育和生长都要依靠心血管系统运输营养物质、氧气, 以及各种远距离调节信号, 内分泌调控信号和代谢物[5].
斑马鱼CFL基因是本实验室克隆的一个新的与心脏发育相关的基因, 含有CXXC锌指结构域, 其生物学功能未知. 但是经过生物信息学分析得知, CFL的启动子区域含有与心脏发育相关的Nkx2.5、ISL-1、AP-1等标志基因的结合位点, 这为研究CFL在斑马鱼心脏发育中的作用提供了理论基础.
斑马鱼为新发现的基因的功能鉴定提供了一个几乎理想的动物模型[5—6]. 本实验以斑马鱼为模式生物, 以斑马鱼cDNA文库为模板克隆了CFL基因, 并对其序列进行BLAST比对, 用生物信息学软件对其编码蛋白的理化参数、二级结构、抗原表位等进行分析和预测, 制备了CFL全长的抗体, 为CFL在心脏发育中的相关功能研究奠定了基础.
1 材料和方法
1.1 材料
斑马鱼由本实验室饲养, 大肠杆菌E.coli TOP10和E.coli Rosetta菌株由本实验室保存; 限制性内切酶EcoR I、Xho I及Taq DNA聚合酶购自深圳晶美公司; pMD18-T载体、pET-28a载体、T4连接酶购自大连TaKaRa公司; 质粒提取试剂盒(离心柱型)购自OMEGA公司; 新西兰大白兔购自中南大学湘雅医学院第二附属医院实验动物中心.
1.2 方法
1.2.1 CFL基因的生物信息学分析及克隆
根据 NCBI 基因库中CFL编码区序列以及原核表达载体pET-28a上的多克隆位点, 运用Primer5.0软件设计了上下游特异性引物, Sense: 5'-GTCACCATCTTACC-3'(下划线处为XhoI 酶切位点); Antisense: 5'-CCATGTCTGCCAGC-3'(下划线处为EcoRⅠ酶切位点). 引物由上海生物公司合成. 以野生型斑马鱼的RNA反转录产物为模板进行PCR扩增, 具体反应条件如下: 95 ℃ 5 min, 94 ℃ 1 min, 55 ℃ 1 min, 72 ℃ 1 min, 共28次循环; 72 ℃延伸5 min. 所得PCR产物约为837 bp, 酶切纯化后插入pMD-18T载体中, 通过转化大肠杆菌TOP10感受态细胞, 挑取阳性单克隆, 转种摇菌后提质粒. 重组质粒经XhoⅠ和 EcoRⅠ双酶切验证正确后, 由上海美吉生物医药科技有限公司测序鉴定.
1.2.2 重组表达质粒的构建
将测序正确的CFL目的片段连入带有XhoⅠ和 EcoRⅠ酶切位点线性化的pET-28a载体, 转入大肠杆菌TOP10感受态细胞中, 挑取阳性单克隆, 转种摇菌后提质粒,用XhoⅠ和 EcoRⅠ进行双酶切检测.
1.2.3 融合蛋白的表达和纯化
将酶切正确的pET-28a-CFL转化大肠杆菌Rosetta菌株, 菌落PCR验证转化成功之后, 在含100 mg/L 氨苄青霉素的LB培养基中于37 ℃培养过夜. 然后按1%转种并在37 ℃培养至OD 600 nm = 0.5~0.6后加入IPTG 至最终浓度为0.1 mmol/L, 在28 ℃诱导6 h, 不加IPTG作为对照. 诱导结束后离心收集菌体, 用1/50培养基体积的缓冲液悬浮细菌, 经超声波破碎后, 于4 ℃以13 000 r/min离心20 min, 收集包涵体. 包涵体经纯化得到的蛋白质进一步通过SDS-PAGE 分离纯化, 切胶回收CFL特异性的蛋白条带. 再经溶解、透析浓缩后用Bredford方法测定蛋白质浓度, 用于抗体制备[7].
1.2.4 CFL多抗血清的制备
取饲养1周的新西兰大白兔2只, 120 μg 融合蛋白作为抗原与弗氏完全佐剂(Sigma)按 1: 1(/)比例完全混合, 经乳化后在背部进行皮下多点注射. 以后每间隔14 d, 取120 μg 的抗原和弗氏不完全佐剂按1: 1(/)比例完全混合, 用同样方法加强免疫3次. 第4次免疫7 d后心脏取血, 25 ℃静置过夜, 次日以最大转速离心取上清[7].
1.2.5 Western blotting 分析抗体特异性
将含pET-28a-CFL重组子的Rosetta菌株在LB培养液中37 ℃培养, 按1: 50 比例接种于200 mL新鲜培养基中, 用IPTG 在37 ℃条件下诱导5 h后, 收集细菌, PBS重悬, SDS-PAGE电泳分离. 将得到的CFL抗体分别按照1: 200、1: 500、1: 800、1: 1 000、1: 1 500及1: 2 000(/)的比例稀释, 以His抗体作为对照, 采用Western blotting方法检测抗体的特异性.
2 实验结果
2.1 CFL基因的生物信息学分析
斑马鱼CFL基因位于第14号染色体上, 全基因在基因组上长达28.23 kb, 含两个外显子, 一个内含子. 其mRNA为1 115 bp, 成熟肽编码区含有837 bp, 该转录本编码一个长为278个氨基酸的蛋白质, 蛋白相对分子质量为29.186 kD. 从279 bp到1 115 bp为开放阅读框, 其编码的蛋白质第218到259个氨基酸之间预测含有CXXC结构域. 进一步通过蛋白质3D结构分析软件对其编码的氨基酸进行分析, 确定其氨基酸中含有CXXC锌指结构域(如图1). 利用斑马鱼CFL基因序列在NCB I数据库中进行Homologene搜索, 发现在人类、小鼠、大鼠、猩猩、狗、原鸡、果蝇中都存在斑马鱼CFL的同源基因.
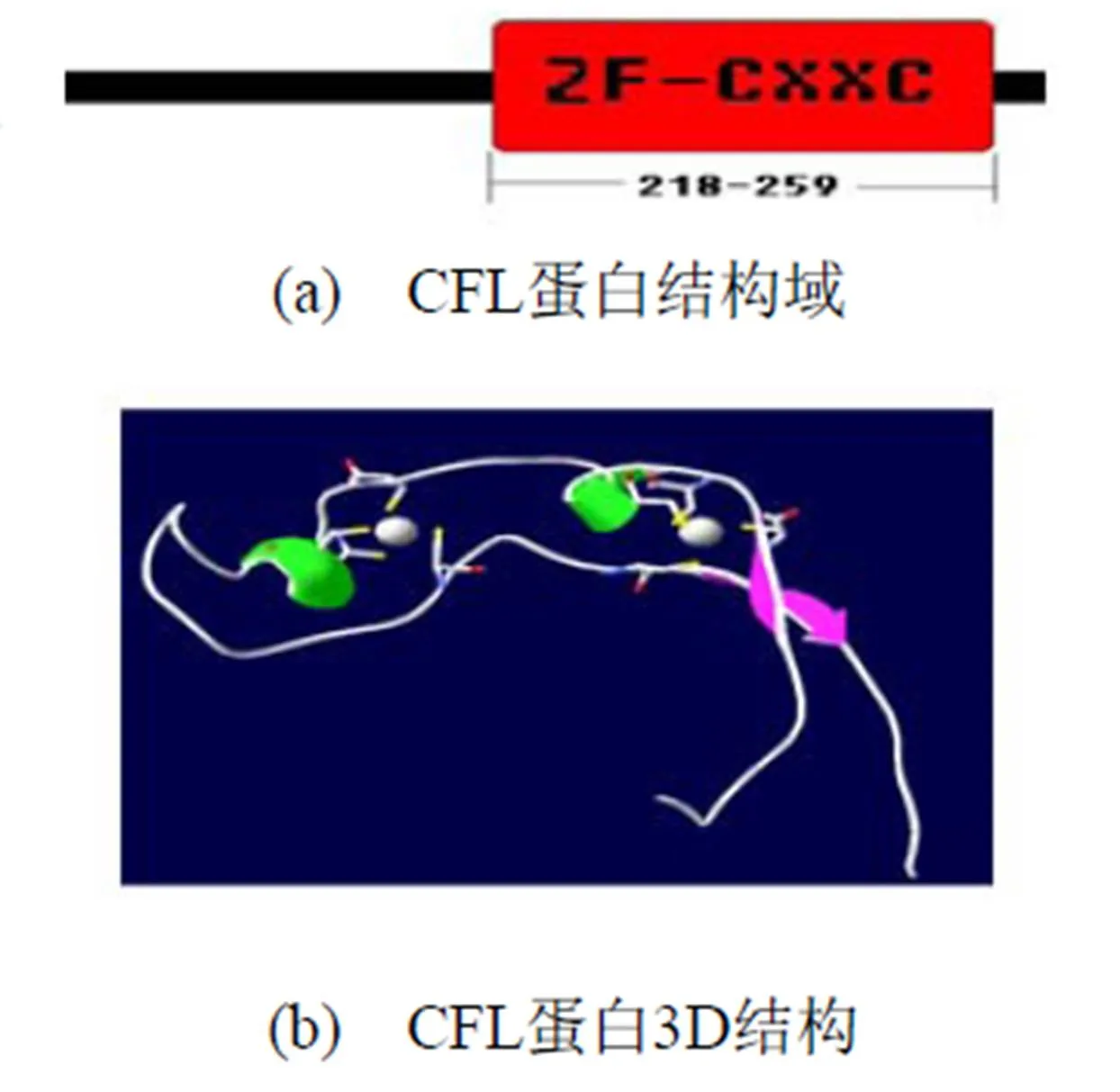
图1 CFL蛋白结构图.
2. 2 CFL基因的克隆及重组表达质粒的构建
经PCR技术扩增出CFL基因的全长(图2A), 将纯化回收后的目的片段连入pMD-18T载体中. 通过转化TOP10感受态, 用Xho I和EcoR I双酶切pMD-18T-CFL重组质粒, 筛选出阳性单克隆后进行测序. 测序结果显示, 所克隆的CFL基因与NCB I数据库中报道的基因片段是一致的.

图2 CFL克隆及pET-28a-CFL质粒鉴定图.
将从pMD-18T-CFL质粒上切取下来的斑马鱼CFL基因片段插入到pET-28a载体中, 构建成pET-28a-CFL质粒, 质粒以XhoI和EcoR I酶切产生与CFL基因大小一致的酶切片段(图2B), 表明斑马鱼CFL基因已成功插入到pET-28a载体中.

图3 His-CFL融合蛋白的表达. M: 蛋白Marker; WT: pET-28a-CFL诱导前; IPTG:37 ℃诱导.
2.3 CFL融合蛋白的诱导表达及纯化
将pET-28a-CFL重组表达质粒转化Rosetta感受态, 以0.1 mmol/mL浓度的IPTG分别在17℃、25℃及37℃恒温摇床上进行诱导. SDS-PAGE凝胶电泳结果显示, 在诱导6 h后出现1条大小为37 kD的特异性条带, 并且3个温度的诱导条件下都可以诱导出目的蛋白. 然而在37 ℃时, 蛋白的诱导量最多(图3).
同时研究发现在37 ℃时蛋白大量的表达在沉淀中. 然后用包涵体纯化方法对沉淀中的蛋白进行纯化, 考马斯亮兰染色检测分别用8 mol/L、4 mol/L和2 mol/L尿素洗脱后的蛋白, 发现8 mol/L和4 mol/L尿素洗脱后的上清的蛋白比较纯, 但是浓度较低, 达不到注射的量. 而用2 mol/L尿素洗脱后, 杂蛋白去除的较干净, 并且经过检测, 蛋白量大于5 mg/mL, 可以用作免疫(如图4).

图4 pET-28a-CFL蛋白诱导纯化图. M: 蛋白Marker; 1, 3, 5分别为: 8、4、2 mol/L尿素洗脱后的上清; 2, 4, 6分别为: 8、4、2 mol/L尿素洗脱后的沉淀.

图5 Western blot 检测抗体效价
2.4 CFL多克隆抗体Western blot检测效价
用纯化后的CFL蛋白作为抗原, 免疫已在本实验室饲养1周的生命力旺盛的新西兰大白兔. 3次加强免疫之后收获血清, 得到兔抗斑马鱼CFL抗体, 稀释6个浓度梯度作为一抗进行效价检测. 结果发现抗体在稀释浓度为1: 1 500(/)时仍然可以检测到杂交信号(图5).
2.5 CFL多克隆抗体特异性检测
利用制备的CFL多克隆抗体分别对pET-28a空载体及重组子pET-28a-CFL两种菌株经IPTG所诱导表达的蛋白进行Western blot检测. 同时运用His抗体对上述两种蛋白进行Western blot检测, 以作为对照实验. 两组实验结果表明: 在His抗体检测的这组中, 在pET-28a-CFL所诱导的37 kD处和pET-28a空载体所诱导的8 kD左右均有目的条带出现. 而在CFL抗体检测的实验组中, 则只在pET-28a-CFL菌株所诱导的37 kD处有目的条带(图6). 说明利用pET-28a-CFL融合蛋白制备的CFL多克隆抗体对CFL蛋白有抗性, 而对pET-28a载体所表达的His蛋白没有抗性.

图6 CFL抗体特异性检测. 1:Myc-CFL融合蛋白;2:His蛋白空白对照.
3 讨论
心脏形态发生包括细胞决定、迁移和分化, 且伴随着一系列关键的形态发生事件. 在心脏发生的每个阶段, 都有特异性的转录因子在起调控作用[5]. 其中一些转录因子中含有一个保守的CXXC(Cys- Xaa-Xaa-Cys)锌指结构. 锌指结构(zinc finger)是蛋白质与DNA双螺旋结构之间相互结合的一种方式, 结构上相对保守, 能够高度识别特异的DNA序列, 并且与DNA之间的作用相对简单, 是由螺旋(或折叠)-环-螺旋(或折叠)所构成的超二级结构, 以及络合Zn离子所形成的空间构象[5, 8].
目前, 国内有关CXXC家族蛋白的研究正处于起步阶段, 尚未见CFL蛋白的相关研究报道. 为了深入地研究斑马鱼CFL基因的功能, 需要获得其纯化的蛋白. 在制备CFL抗体时, 选用了CFL基因的全长所表达的蛋白作为免疫原, 从而降低了抗体的多效性. 另外, 本实验选用了带有His标签的pET-28a表达载体, 是因为与带有GST标签的表达载体相比, His标签的序列较短, 对抗体特异性的影响较低. 采用了3个不同温度、IPTG浓度及诱导时间来研究在哪种条件下蛋白更容易被诱导到上清中. 因为在诱导过程中, 蛋白极易以包涵体的形式表达在沉淀中, 不易纯化. 由于本实验所用的是CFL基因的全长作为抗原, 亲水性和疏水性的选择就受到了限制, 因此上清中的蛋白量非常少, 达不到注射浓度, 最终在包涵体中纯化了抗原, 实验还发现在包涵体洗涤时增加NaCl浓度到0.5 mol/L, 有助于包涵体中杂蛋白的溶解.
斑马鱼CFL锌指蛋白的表达和纯化是本研究的目的. CFL蛋白的理论值是29.186 kD, pET-28a表达载体上包含6个组氨酸的理论值是0.84 kD. 计算pET-28a-CFL的理论分子量约为30 kD. 然而在SDS-PAGE上电泳后, 发现其目的条带在37 kD左右, 与理论值相差7 kD. 这可能是由于His-tag的强电荷作用, 这种强电荷作用可能是造成许多其他His-tag 融合蛋白在SDS-PAGE 中表观分子量偏大的原因[9].
在用IPTG诱导抗原大量表达的时候, 可以通过结果部分图3及图4的诱导图看出, 在72 kD左右也有被诱导出的新条带, 但是浓度非常低, 猜测这是因为CFL蛋白被sumo化所导致的, 具体的原因需要相关的实验进一步证实. 另外, 兔子的饲养是实验中比较关键的一个环节, 在免疫新西兰大白兔时, 要首先确保兔子的身体状况良好, 并且注意将抗原与弗氏佐剂完全混匀, 否则没有溶解的包涵体会阻塞针管, 导致抗原不能完全注射进去.
[1] Hu D S, Gu D F. Epidemiological studies for cardiovascular diseases in China from 1980 to 2010[J]. Zhonghua Liu Xing Bing Xue Za Zhi, 2011, 32:1059—1064.
[2] Kathiresan S, Srivastava D..Genetics of human cardiovascular disease[J]. Cell, 2012, 148: 1242—1257.
[3] WU Xiushan. Signaling Regulation and Heart Development[M]. Hunan Normal University; Chemical Industry Press, 2002.
[4] Buckingham M, Meilhac S, Zaffran S. Building the mammalian heart from two sources of myocardial cells[J]. Nat Rev Genet, 2005, 6: 826—835.
[5] 吴秀山, 王跃群, 袁婺洲, 等. 心脏发育概论[M]. 北京: 科学出版社, 2006: 141—158.
[6] Ackermann G E, Paw B H. Zebrafish: a genetic model for vertebrate organogenesis and human disorders. Front Biosci, 2003, 8: 1227—1253.
[7] 姚力群, 李志, 江志刚, 等.人类新基因Bzw2的克隆、抗体制备及表达分析[J]. 激光生物学报, 2011, 20(6): 798—801.
[8] WANG Xijun, LIAO Peng. A Preparation of Polyclonal Antibody and Expression of Human CXXC5 Gene[J]. Acta Laser Biology Sinica, 2011, 20(3): 334—337.
[9] Tang W H, Zhang J L, Wang Z Y, et al. The cause of deviation made in determining the molecular weight of his-tag fusion proteins by SDS-PAGE[J]. Acta Phytophysiologica Sinica, 2000, 26(1): 64—68.
Prokaryotic expression and purification of the zebrafish CFL gene and preparation of its polyclonal antibody
WANG Pan-pan, PENG Xi-yang,YI Zhen, JIANG Zhi-gang, DENG Yun, WU Xiu-shan, WAN Yong-qi
(The Center for Heart Development, Key Lab of MOE for Development Biology and Protein Chemistry, Hunan Normal University, Changsha 410081, China)
The normal expression of related genes is critical in the heart development process. To explore the heart development related genes, to provide the basis to understand the pathogenesis of congenital heart disease and interventional treatment. CFL gene is a candidate gene for heart development from Zebrafish cDNA library. Bioinformatics analysis revealed that it contains CXXC domain, and encoding 278 amino acids. To further investigate the possible functions of CFL in the process of heart development, the full length of CFL gene was cloned and inserted into pET-28a vector.The His-CFL fusion protein was induced by IPTG, the expression of fusion protein accounts for 71 of total bacteria protein.The relative molecular mass is about 30 kD. After inclusion body purification, immune the New Zealand white rabbit to prepared polyclonal antibody and was indentifited by western blot. These results demonstrate that the high titer polyclonal antibody was obtained.
CFL; fusion protein; polyclonal antibody
10.3969/j.issn.1672-6146.2013.04.006
Q 75
1672-6146(2013)04-0024-05
email: wanyongqi@aliyun.com.
2013-09-30
国家自然科学基金项目(30900851)
(责任编校:谭长贵)

