UV-B辐射对香樟凋落叶化学组成和分解的影响
卢 娟,卜 涛,郭宝华,朱鹏飞,江 洪,宋新章*
(1. 浙江农林大学 亚热带森林培育国家重点实验室培育基地,浙江省森林生态系统碳循环与固碳减排重点实验室,浙江 临安 311300;2. 国际竹藤中心,北京 100102)
UV-B辐射对香樟凋落叶化学组成和分解的影响
卢 娟1,卜 涛1,郭宝华2,朱鹏飞1,江 洪1,宋新章1*
(1. 浙江农林大学 亚热带森林培育国家重点实验室培育基地,浙江省森林生态系统碳循环与固碳减排重点实验室,浙江 临安 311300;2. 国际竹藤中心,北京 100102)
采用模拟UV-B辐射增强方法研究了UV-B辐射香樟(Cinnamanun camphora)叶片化学组成及其凋落后分解和养分释放的影响。结果表明:UV-B辐射增强导致香樟凋落叶中的N、P、K和C含量分别比对照组显著减少了36.0%、14.3%、42.7%和7.4%(p < 0.05),致使凋落叶中的C:N、木质素:N和C:P比分别显著增加了44.7%、77.1%和7.3%(P < 0.05),木质素含量显著增加13.3%;在之后1 a分解过程中,生长期间接受增强UV-B辐射的凋落叶分解的更快,但与对照组差异不显著(P > 0.05)。
UV-B辐射;香樟;凋落叶分解;化学组成
由于氟氯烃类化合物(CFCs)的大量排放,近10年来北半球中纬度地区的臭氧层损耗正以2% ~ 3%的速度增加。臭氧层的削减导致太阳紫外辐射(尤其是UV-B)显著增强。按照目前的发展速度,未来30年内地球上的UV-B辐射将比现在增加30%左右。由其造成的影响已成为当前全球变化生态学和生物地球化学循环研究中的重点问题之一[1~2]。陆地生态系统物质循环和能量转换的主要途径是森林凋落物分解,它对森林生态系统的碳预算具有重要的科学意义[3]。因此,研究UV-B辐射变化对凋落物分解的影响,对于阐述生态系统中凋落物的周转、生物地球化学循环和土壤营养动态极其重要,也是当前生态系统对全球环境变化响应研究中一个重要组成部分[4~7]。
凋落物分解过程受到分解时照射的UV-B的直接影响和植物生长时照射的UV-B的间接影响。UV-B通过对木质素的光降解作用或者改变生物分解者的群落组成、数量和活性直接影响凋落物的分解过程,也可通过影响植物生长期间叶片的化学成分而间接影响凋落物分解过程[8]。国内外部分学者已对UV-B辐射增强对凋落物分解的影响进行了研究[9],取得了一些初步认识。但研究对象大多为草本植物或农作物[10],有关UV-B辐射对木本植物凋落物分解的影响研究的还很少,国内仅见宋新章等[11~13]关于UV-B辐射对亚热带常见树种凋落叶直接影响的研究报道,而关于木本植物生长期间接受UV-B辐射对叶片凋落后分解的影响的研究尚未见报道。
常绿阔叶林是我国亚热带地区的顶极植被群落。基于全球UV-B辐射不断增强的背景,我们采用模拟UV-B辐射增强方法研究了我国亚热带常绿阔叶林常见种香樟(Cinnamomum camphora)幼苗生长在UV-B辐射增强环境下叶片化学组成发生的变化,以及这种改变对叶片凋落后分解和养分释放的影响,期望解决以下两个问题:①UV-B辐射增强是否改变常绿阔叶林叶片的化学组成。②如果发生这种变化,这种变化又将如何影响叶片凋落后的分解和养分释放。研究结果将为深入认识和理解UV-B辐射变化对我国亚热带森林生态系统的影响提供基础数据和科学依据。
2 材料与方法
2.1 研究区概况
本实验在浙江省临安市(119° 42′ E,30° 14′ N)的野外科研试验基地内进行。该区地处中亚热带季风气候区的北缘,四季分明,气候温和,雨量充沛,年均降水量在1 420 mm左右,年均气温15.6℃,无霜期230 d左右。土壤为黄红壤。
2.2 UV-B 辐射环境模拟
设置UV-B辐射增强和自然光照(对照)2个UV-B辐射环境。UV-B辐射增强环境模拟采用方波处理方法,该方法因操作简便,成本较低而在同类研究中受到广泛应用[14]。用波长峰值为313 nm的紫外灯管为光源,紫外灯用125 cm厚的三醋酸纤维薄膜包裹,以滤除UV-C但透过UV-B和UV-A。在宽2 m、长4 m的灯架上装12支紫外灯管,沿灯架按照余弦分布设置灯管间距,并在每支灯管中心部位裹一条铝箔,以保证紫外辐射的均匀性。每天照射7 h(09:00-16:00),阴雨天除外。UV-B辐射对照组同增强组类似,在灯架上装12支灯罩但不安装灯管,用于消除灯架本身遮蔽的影响。用北京师范大学光电仪器厂生产的双通道UV-B辐照计来测定灯架下的辐照强度,经Caldwell[15]的公式转换为生物有效辐射(UV-BBE)。通过调节灯管与幼苗冠层的距离来调节幼苗接受的UV-B辐射强度,使之比对照组增强10%[16]。
2.3 幼苗及凋落叶分解处理
2007年6月,将20株长势一致的2年生香樟幼苗随机移植到两种UV-B处理组。在移植前先对移植样地进行整地,以保证两处理样地土壤基质的一致性。缓苗3个月后开始UV-B照射处理。在两种UV-B辐射环境下生长1年后,收集两组处理样地上的凋落叶,测定其化学成分。将收集到的两组凋落叶风干后分别装入由尼龙网制成的孔径为1.0 mm×1.5 mm,大小为15 cm×15 cm的分解袋中,每袋5 g。于2008年12月将分解袋放到常绿阔叶林下3个环境条件一致的样地中进行自然分解,即3个重复。2009年2月起每2个月取回一次分解袋,带回实验室清除凋落物表面附着的泥沙和其他杂质,在80℃烘箱中烘干至恒重,测定剩余凋落物的质量。然后粉碎,进行化学组成的分析测定。
2.4 化学组成分析方法
木质素含量用Van Soest中性洗涤纤维(NDF)及酸性洗涤纤维(ADF)方法测定;碳含量用重铬酸钾容量法-外加热(油浴加热)法测定;氮、磷和钾含量分别用半微量凯氏法、钼锑抗比色法和火焰光度计法测定。
2.5 数据分析
凋落叶的分解用干重剩余率表示,Mt/M0,Mt表示时间t时的凋落叶干重(g),M0表示凋落叶的初始干重(g)。养分元素的释放用元素剩余率表示[6,17],计算公式为:
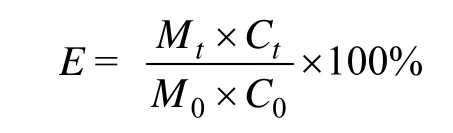
式中,E为养分元素的剩余率(%),C0为初始凋落叶养分含量(g/kg),Ct为t时刻凋落叶养分含量(g/kg)。
采用单因素方差分析(One-Way ANOVA)和最小显著差异法(LSD)比较两种处理环境下凋落叶化学成分及其随后分解和养分释放的差异,统计分析用SPSS 13.0实现。
3 结果与分析
3.1 凋落叶化学成分的变化
与对照组相比,在UV-B辐射增强环境下的香樟幼苗叶片凋落后氮(N)和钾(K)含量显著降低了(P <0.001)(表1),其中K含量显著降低了42.7%;N含量显著降低了36.0%(P < 0.05);C含量和C:P的变化不显著;凋落叶中的C:N和木质素:N分别显著增加了44.7%和77.1%(P < 0.001)。

表1 生长在UV-B辐射增强和对照环境下香樟凋落叶化学组成的差异Table 1 Leaf litter chemical composition(mean SD, n=6) of C. camphora growing under ambient and elevated UV-B radiation treatments
3.2 干重剩余率的变化
在分解开始的前两个月内,来源于不同 UV-B处理组的香樟凋落叶分解速度一致(图1)。两个月后两组凋落叶分解速度有所不同但差异不大,第10个月时两组处理凋落叶干重剩余率的差异最大,达到8.8%,之后差异逐渐缩小。在1 a的分解过程中,尽管生长期间接受UV-B辐射的凋落叶失重的更快,但统计分析结果表明,两组处理间凋落叶分解的差异没有达到显著水平(P > 0.05)。
3.3 元素释放动态
生长在两组UV-B辐射处理下的香樟凋落叶在1 a的分解过程中均发生了N元素的富集,尤其是UV-B辐射增强处理组凋落叶在分解第4个月时N素富集即达到301.6%,之后则逐步下降。对照处理组凋落叶在1a的分解期间N素富集则一直稳定在163.6% ~ 207.6%。统计分析显示在1 a分解期间两组处理间凋落叶的N素富集差异显著(P < 0.05)。
由图2可见,生长在两组UV-B辐射处理下的香樟凋落叶在前2个月的分解过程中均呈现出K元素的快速释放,之后K元素的释放基本稳定,对照处理下K元素的释放速度显著高于UV-B辐射处理(P < 0.05)。
由图2可见,生长在两组UV-B辐射处理下的香樟凋落叶在1 a的分解过程中均发生了P元素的释放,其中对照组凋落叶P元素的释放速度显著高于UV-B辐射增强处理组(P < 0.05)。
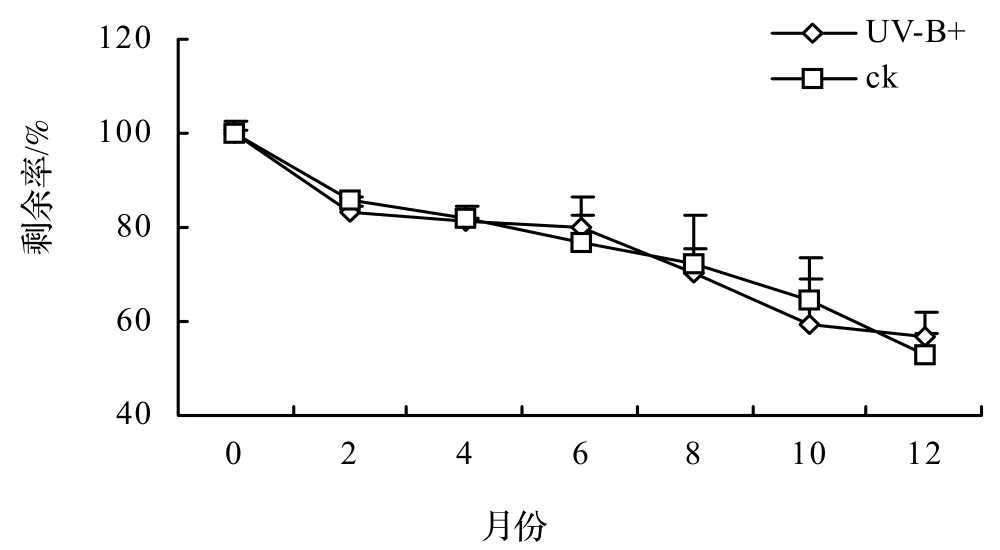
图1 香樟凋落叶分解过程中干重剩余率的变化Figure 1 Percentage of remaining mass to initial mass during litter decomposition of C. camphora growing under elevated (UV-B+) and ambient (ck) UV-B radiation treatments
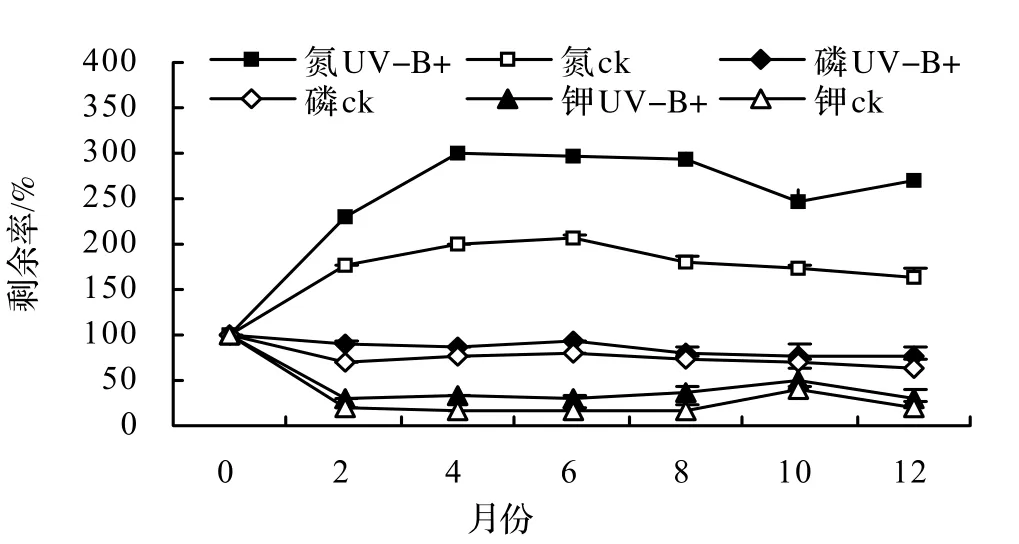
图2 两种UV-B辐射处理下香樟凋落叶分解过程中氮、钾、磷元素释放率Figure 2 Release rate of N, P and K during leaf litter decomposition of C. camphora growing under elevated and ambient UV-B radiation
4 小结与讨论
4.1 UV-B 辐射对凋落叶化学成分的影响
植物生长过程中接受的UV-B辐射能够改变植物各部分化学组成和形态特征,包括增加叶片的α纤维素[18]和吸收UV-B的化合物如类黄酮和多酚[19]、减少可溶性碳水化合物而增加N含量[20]。Cybulski等[21]观测到生长在强UV-B辐射下的植物的凋落物中木质素含量增加,分解速率加快。也有一些研究认为植物生长期间的UV-B辐射对凋落物的化学组成没有影响。如苏格兰松(Pinus sylvestris)和挪威云杉(Picea abies),它们在UV-B辐射增强环境下其针叶中的酚醛等次生化合物含量没有发生改变[22]。UV-B辐射增强没有影响到欧洲越桔(Vaccinium myrtillus)和欧石楠(Calluna vulgaris)叶片的N、P、K含量[23],UV-B辐射对英国栎凋落叶化学成分的影响也可以忽略不计[24]。此次研究结果表明生长在增强UV-B辐射环境下的香樟凋落物中的N、K和P含量显著降低了,C:N、木质素:N和C:P值显著增加了。上述研究结果之间的差异可能与试验材料、试验方法及试验时间的不同有关。
4.2 UV-B 辐射对凋落叶分解的影响
对高UV-B辐射环境下生长的春小麦的分解试验表明,春小麦茎、根和穗的N含量显著增加,叶片中Mg、Fe、Zn的含量显著增加,叶和茎的分解速率加快[20,9~10]。但Gallo等[25]发现,在6个月的试验中,UV-B辐射对Pinus edulis和Juniperus monosperma凋落物的分解无明显作用。Moody等[26]也发现增强的UV-B辐射对石南灌丛中悬钩子(Rubus chamaemorus)叶片的分解没有显著影响。
此次研究显示,尽管UV-B辐射增强显著改变了香樟凋落叶的化学组成,但对其分解速度的影响并不显著。我们关于亚热带7个常见树种凋落叶分解的前期研究结果表明[27],凋落叶分解速率与P、N含量呈显著正相关(P< 0.01),与C:N呈显著负相关(P < 0.05)。照此推断,UV-B辐射显著降低了香樟凋落叶的P、N含量而增加了C:N值,应显著减缓凋落叶的分解速度,而本次结果表明尽管分解速度缓慢,但与对照组之间的差异不显著。分析其主要原因可能在于实验研究时间较短(仅1年)。凋落物分解是一个复杂的过程,在分解前期物理过程如淋溶、粉碎等占主导作用,在分解后期凋落物的化学组成和分解者活性等生物因素的影响才居于支配地位。实验地点丰沛的降水无疑加大了淋溶作用的强度,使得在香樟凋落叶第1年的分解过程中淋溶作用掩盖了化学成分的作用。随着分解时间的延长,化学成分的主导作用将逐渐显现出来。
4.3 UV-B 辐射对凋落叶养分释放的影响
UV-B辐射对凋落物分解过程影响的生态学意义在于通过影响养分元素和碳释放的进程,影响生态系统的养分循环、初级生产力、碳储量以及土壤与大气间的碳通量[28~29]。在凋落物分解过程中,养分的富集与释放主要由凋落物初始组成中碳与养分元素的比值控制。如N的释放与凋落物的N含量和C:N比关系密切,N含量在0.3% ~1.4%范围内时会出现N的固定[30],在C:N值高于5 ~ 15时会一直发生N元素的富集,低于5 ~ 15时N才会开始释放[31~32]。此次实验研究中,两种UV-B处理下香樟凋落叶的N含量和C:N均在上述阈值范围内,无法满足微生物分解者的N需求,微生物分解者必须从土壤中富集N来满足自身的需要,因此发生了N富集[33]。而且由于UV-B辐射增强组香樟凋落叶比对照组有显著更低的N含量和更高的C:N值,因此N富集的程度也比较强。可见,生长期间接受增强的UV-B辐射加快了香樟凋落叶分解时的N富集。
凋落物的C:P值通常被认为是决定P元素释放与富集的一个重要因子,其阈值范围一般为200 ~ 480[34~35]。本研究中,两种UV-B辐射处理下香樟凋落叶的初始C:P值均在480附近,因而均表现出P释放。但UV-B增强组凋落叶的初始C:P值高于对照组,因而表现出更慢的P释放速率,这同上述的阈值理论是一致的,表明生长期间接受增强的UV-B辐射阻碍了凋落叶分解时P的释放。钾元素易于通过淋溶作用而流失。UV-B辐射增强处理下香樟凋落叶K元素的释放比对照组显著更慢,表明生长期间接受增强的UV-B辐射延缓了香樟凋落叶K元素的释放。
[1] Li F R, Peng S L, Chen B M, et al. A meta-analysis of the responses of woody and herbaceous plants to elevated ultraviolet-B radiation[J]. Acta Oecologica, 2010, 36(1):1-9.
[2] Flint S D, Ryel R J, Caldwell M M. Ecosystem UV-B experiments in terrestrial communities: A review of recent findings and methodologies[J]. Agr For Meteor, 2003(120):177-189
[3] Parton W, Silver W L, Burke I C, et al. Global-scale similarities in nitrogen release patterns during long-term decomposition[J]. Science, 2007, 315(5810): 361-364.
[4] Austin AT, Vivanco L. Plant litter decomposition in a semi-arid ecosystem controlled by photodegradation[J]. Nature, 2006(442): 555-558.
[5] 宋新章,江洪,张慧玲,等. 全球环境变化对森林凋落物分解的影响[J]. 生态学报,2008,28(9):4 414-4 423.
[6] Brandt L A, King J Y, Hobbie S E, et al. The role of photodegradation in surface litter decomposition across a grassland ecosystem precipitation gradient[J]. Ecosystems, 2010 (13): 1-17.
[7] 张慧玲,宋新章,张智婷,等. UV-B辐射对杉木凋落叶分解的影响[J]. 应用生态学报,2011,22(4):845-850.
[8] Pancotto V A, Sala O E, Robson T M, et al. Direct and indirect effects of solar ultraviolet-B radiation on longterm decomposition[J]. Glob Chang Biol, 2005 (11): 1 982-1 989.
[9] 李元,王勋陵,胡之德. 增强的UV-B 辐射对麦田生态系统锰和锌累积和循环的影响[J]. 生态学杂志,2001,20(1):26-29.
[10] 李元,王勋陵. UV-B 辐射对麦田生态系统氮磷累积和循环的影响[J]. 农业环境保护,2000,19(3):129-132.
[11] 宋新章,张慧玲,江洪,等. UV-B辐射对马尾松凋落叶分解和养分释放的影响[J]. 生态学报,2011,31(8):2 106-2 114.
[12] 宋新章,张慧玲,江洪,等. UV-B辐射对亚热带森林凋落叶氮、磷元素释放的影响[J]. 环境科学,2012,33(2):545-550.
[13] 宋新章,张慧玲,江洪,等. UV-B辐射对亚热带森林凋落叶分解的影响[J]. 林业科学,2012,48(1):13-17.
[14] Flint S D, Ryel R J, Caldwell M M. Ecosystem UV-B experiments in terrestrial communities: a review of recent findings and methodologies[J]. Agr For Meteor, 2003, 120 (1~4): 177-189.
[15] Caldwell M M. Solar ultlaviolet radiation and the growth and development of higher plant. Giese A C. Photophysiol[M]. New York: Aeademic Press, 1971.
[16] 黄梅玲,江洪,金清,等. UV-B辐射胁迫下不同起源时期的3种木本植物幼苗的生长及光合特性[J]. 生态学报,2010,30(8):1 998-2 009.
[17] Pancotto V A, Sala O E, Cabello M, et al. Solar UV-B decreases decomposition in herbaceous plant litter in Tierra del Fuego, Argentina: potential role of an altered decomposer community[J]. Glob Chang Biol, 2003, 9 (10): 1 465-1 474.
[18] Rozema J, TosseramsM, Nelissen H J, et al. Stratospheric ozone reduction and ecosystem p rocesses: enhanced UV-B radiation affects chemical quality and decomposition of leaves of the dune grassland species Calam agrostis epigeios[J]. Plant Ecol, 1997 (128): 284-294.
[19] Gehrke C, Johanson U, Callaghan T V, et al. The impact of enhanced ultraviolet-B radiation on litter quality and decomposition processes in Vaccinium leaves from the Subarctic[J]. Oikos, 1995 (72): 213-222.
[20] Yue M, Li Y, Wang X. Effects of enhanced ultraviolet-B radiation on plant nutrients and decomposition of sp ring wheat under field conditions[J]. Envir Exp Bot, 1998 (40): 187-196.
[21] Cybulski IIIW J, PeterjohnW T, Sullivan J H. The influence of elevated ultraviolet-B radiation (UV-B) on tissue quality and decomposition of loblolly pine ( Pinus taeda L. ) needles[J]. Envir Exper Bot, 2000 (44): 231-241.
[22] Turtola S, Sallas L, Holopainen J K, et al. Long-term exposure to enhanced UV-B radiation has no significant effects on growth or secondary compounds of outdoor-grown Scots pine and Norway spruce seedlings[J]. Envir Pollut, 2006, 144 (1): 166-171.
[23] Bjorn L O, Callaghan T V, Johanson I, et al. The effects of UV-B radiation on European heathland species[J]. Plant Ecol, 1997, 128(1~2): 253-264.
[24] Newsham K K, Splatt P, Coward P A, et al. Negligible influence of elevated UV-B radiation on leaf litter quality of Quercus robur[J]. Soil Biol Biochem, 2001, 33 (4~5): 659-665.
[25] Gallo M E, Sinsabaugh R L, Cabaniss S E. The role of ultraviolet radiation in litter decomposition in arid ecosystems[J]. Appl Soil Ecol, 2006 (34): 82-91.
[26] Moody S A, Coop D J S, Oaul N D. Effects of elevated UV-B on heathland communities[J]. J Exper Bot, 1996, 24 (supp 1): 19.
[27] 宋新章,江洪,余树全,等. 中亚热带不同演替阶段植被优势种凋落物分解试验[J]. 应用生态学报,2009,20(3):537-542.
[28] Robson T M, Pancotto V A, Scopel A L, et al. Solar UV-B influences microfaunal community composition in a Tierra del Fuego peatland[J]. Soil Biol Biochem, 2005(37):2 205-2 215.
[29] Niemi R, Martikainen P, Silvola J, et al. Elevated UV-B radiation alters fluxes of methane and carbon dioxide in peatlands microcosms[J]. Glob Chang Biol, 2002(8):361-371.
[30] Berg B, Staaf H. Leaching, accumulation and release of nitrogen in decomposing forest litter[J]. Ecol Bull, 1981, 33(1): 163-178.
[31] Manzoni S, Jackson R B, Trofymow J A. The global stoichiometry of litter nitrogen mineralization[J]. Science, 2008, 321(5889): 684-486.
[32] Mcclaugherty C A, Pastor J, Aber J D. Forest litter decomposition in relation to soil nitrogen dynamics and litter quality[J]. Ecology, 1985, 66 (1): 266-275.
[33] Manzoni S, Trofymow J A, Jackson R B, et al. Stoichiometric controls on carbon, nitrogen, and phosphorus dynamics in decomposing litter[J]. Ecol Monogr, 2010, 80(1):89-106.
[34] Gosz J, Likens G, Bormann F. Nutrient release from decomposing leaf and branch litter in the Hubbard Brook Forest, New Hampshire[J]. Ecol Monogr, 1973, 43(2):173-191.
[35] Dziadowiec H. The decomposition of plant litterfall in an oak-linden-hornbeam forest and an oak-pine mixed forest of the Bialoweza national Park[J]. Acta Societ Bot Polon, 1987, 56(1):169-185.
Effect of UV-B Radiation on Chemical Composition and Subsequent Decomposition of Leaf Litter of Cinnamomum camphora
LU Juan1,BU Tao1,GUO Bao-hua2,ZHU Peng-fei1,JIANG Hong1,SONG Xin-zhang1*
(1. Zhejiang Provincial Key Laboratory of Carbon Cycling and Carbon Sequestration in Forest Ecosystems, Zhejiang A & F University, Lin’an 311300, China; 2. International Center for Bamboo and Rattan, Beijing 100102, China)
An experiment was carried out on the effects of UV-B radiation on leaf litter chemical composition and subsequent decomposition in humid subtropical forest systems. The leaf litter was derived from Cinnamomum camphora seedlings exposed to elevated and ambient ultraviolet B (UV-B) radiation treatments during growth for one year. The results showed that UV-B treatment significantly decreased the original N, P, K and C content in leaf litter by 36.0%, 14.3%, 42.7% and 7.4%, and increased the ratios of C:N, lignin:N and C:P in leaf litter by 44.7%, 77.1% and 7.3%. The decomposition of leaf litter derived from seedlings exposed to elevated UV-B treatment during growth was faster, but did not show significant difference with that of the control.
UV-B radiation; Cinnamomum camphora; leaf litter decomposition; chemical composition
S789.4
B
1001-3776(2013)04-0068-06
2013-04-09;
2013-06-10
国家自然科学基金项目(31070440,30800152);浙江省自然科学基金项目(Y5090007);浙江农林大学人才启动项目(2012FR023)
卢娟(1989-),女,河南信阳人,从事森林生态学研究;*通讯作者。

