脑胶质瘤磁敏感信号及表观扩散系数与病理分级的相关性研究
郭 军GUO Jun
孟 郊2MENG Jiao
韩 彤1HAN Tong
脑胶质瘤磁敏感信号及表观扩散系数与病理分级的相关性研究
郭 军1GUO Jun
孟 郊2MENG Jiao
韩 彤1HAN Tong
目的分析磁敏感加权成像磁敏感信号(ITSS)及扩散加权成像表观扩散系数(ADC)与不同级别脑胶质瘤的相关性,探讨ITSS及ADC值在脑胶质瘤术前分级中的应用价值。资料与方法52例脑胶质瘤患者均行磁敏感加权成像和扩散加权成像扫描,根据脑肿瘤分级标准分为低级别胶质瘤组(18例)和高级别胶质瘤组(34例),比较ITSS分级、ADC值与病理分级之间的相关性,采用ROC曲线评价ITSS和ADC值在脑胶质瘤病理分级中的诊断效能。结果不同级别脑胶质瘤的ITSS分级差异有统计学意义(χ2=27.458, P<0.01);不同级别脑胶质瘤的ADC值差异有统计学意义(U=689.000, P<0.01);ITSS分级与病理分级呈显著正相关(r=0.727, P<0.001),ADC值与病理分级呈显著负相关(r=-0.622, P<0.001),不同级别脑胶质瘤ITSS分级与ADC值呈显著负相关(r=-0.617, P<0.001)。以病理分级为标准,ITSS在脑胶质瘤术前分级中的诊断敏感度、特异度、准确度、阳性预测值、阴性预测值分别为85.29%、77.78%、82.69%、87.88%、73.68%,ADC值在脑胶质瘤术前分级中的诊断敏感度、特异度、准确度、阳性预测值、阴性预测值分别为97.06%、88.89%、94.23%、94.29%、94.12%。结论ITSS分级、ADC值与脑胶质瘤病理分级之间有很高的相关性,联合应用ITSS和ADC值可以显著提高脑胶质瘤术前分级的准确性。
神经胶质瘤;磁共振成像,弥散;磁敏感加权成像;扩散加权成像;表观扩散系数;病理学,外科
胶质瘤是较常见的中枢神经系统肿瘤,尤其是高级别的胶质瘤常为致命性的伤害,术前通过影像学方法对胶质瘤进行准确分级能够为临床制订合理的治疗方案及评价预后起到重要的作用。扩散加权成像(DWI)表观扩散系数(ADC)与胶质瘤的级别明显相关,不同级别的胶质瘤其ADC值有显著差异[1,2]。磁敏感加权成像(susceptibility weighted imaging, SWI)通过检测胶质瘤内的出血量及新生血管结构等来评估胶质瘤的级别[3,4]。既往研究多为单独评价两者对胶质瘤术前分级的诊断效能,而两者对胶质瘤分级诊断效能的对比研究及联合应用两者对胶质瘤分级的诊断效能报道较少。本研究拟探讨SWI肿瘤磁敏感信号(intratumoral susceptibility signal intensity, ITSS)分级、ADC值与脑胶质瘤病理分级的相关性,并分析两者对脑胶质瘤术前分级的诊断效能,为临床提供更为准确的脑胶质瘤术前分级信息。
1 资料与方法
1.1 研究对象 选择2011-10~2013-02天津市环湖医院经手术及病理证实的52例脑胶质瘤患者,其中男32例,女20例;年龄18~76岁,平均(47.3±14.4岁)。所有患者于术前行MR平扫和增强扫描、SWI检查,所有患者均未行放、化疗,无脑部手术史。根据WHO 2007年脑肿瘤的分类分级标准[5],I级星形细胞瘤1例,II级17例,III级15例,IV级19例,I、II级18例为低级别胶质瘤组,III、IV级34例为高级别胶质瘤组。
1.2 仪器与方法 采用Siemens TrioTim 3.0T MRI仪,应用自旋回波(SE)和快速自旋回波(FSE)脉冲序列扫描技术,常规行矢状位(T1WI)、横轴位(T2WI及FLAIR)、冠状位(T1WI)扫描,扫描参数:T1WI:TR 325 ms,TE 11 ms;T2WI:TR 5000 ms,TE 106 ms;FLAIR:TR 9810 ms,TE 104 ms。层厚6.0 mm,层间距2~6 mm,视野240 mm×240 mm。DWI:应用平面回波(EPI)序列,b值取0、1000 s/mm2。SWI采用三维高分辨率磁敏感成像技术,TE 15 ms,TR 26 ms,激发角度15°,层厚2 mm,无间隔,矩阵448×384,扫描时间6~9 min。
1.3 图像分析 SWI图像通过SWI软件自动得到磁矩图、相位图及最小密度投影(MinIP)图。参照Park等[6]的方法在SWI图像上将ITSS分为4级:无ITSS为0级;1~5个点样或线条状ITSS为1级;6~10个点样或线条状ITSS为2级;肿瘤连续层面内≥11个点样或线条状ITSS为3级。ADC值的测量:在ADC图上将感兴趣区(ROI,大小为40 mm2)分别置于肿瘤实质部(避开粗大血管及肿瘤囊变、坏死、出血区)及相应对侧正常脑白质,各区分别放置3个ROI,取其平均值。所有SWI及ADC图均由2名影像科主任医师在不知道病理结果的情况下进行分析。
1.4 统计学方法 采用SPSS 17.0软件,不同级别脑胶质瘤ITSS及ADC值比较采用Wilcoxon符号秩检验,脑胶质瘤ITSS分级、ADC值与病理分级之间的相关性采用Spearman等级相关分析。将ITSS为0、1级时定为低级别胶质瘤,2、3级时定为高级别胶质瘤作为诊断指标,参照苗延巍等[7]的研究结果并结合本组资料的数据特点,将ADC值为1.3×10-3mm2/s作为诊断指标,分别分析ITSS及ADC值对高、低级别脑胶质瘤的诊断敏感度、特异度、准确度、阳性预测值、阴性预测值。绘制ROC曲线分析ITSS、ADC值及两者联合应用对脑胶质瘤术前分级的诊断效能,P<0.05表示差异有统计学意义。
2 结果
2.1 不同级别脑胶质瘤的ITSS分级及形态特点 本组中15例低级别胶质瘤的ITSS表现为较散在的点状或少许细线样低信号影,1例病灶内未见ITSS(图1C),2例伴有出血的肿瘤ITSS呈片状低信号改变。13例高级别胶质瘤的ITSS表现为较多的点状和线状低信号影(图2C),23例肿瘤的TISS表现为点状低信号与线状低信号聚集或融合,甚至融合呈大片状。不同级别脑胶质瘤ITSS分级比较,差异有统计学意义(χ2=27.458, P<0.01)。见表1。

图1 患者女,49岁,左侧额叶胶质瘤(WHO II级)。A.左侧额叶片状异常信号影,T2WI呈稍高、高信号改变,边界欠清,周围未见明显水肿影;B. ADC图示病灶呈高和稍低信号改变;C. SWI显示左侧额叶病灶呈等信号改变(箭),病灶内未见明显的血管流空影,ITSS为0级

图2 患者男,72岁,右侧颞叶胶质母细胞瘤(WHO IV级)。A. T2WI示右侧颞叶病灶呈稍高、高信号改变;B. ADC图示病灶部分区域呈明显低信号改变;C. SWI图上可见ITSS呈点状(箭头)和线状(箭),数量>11,ITSS为3级
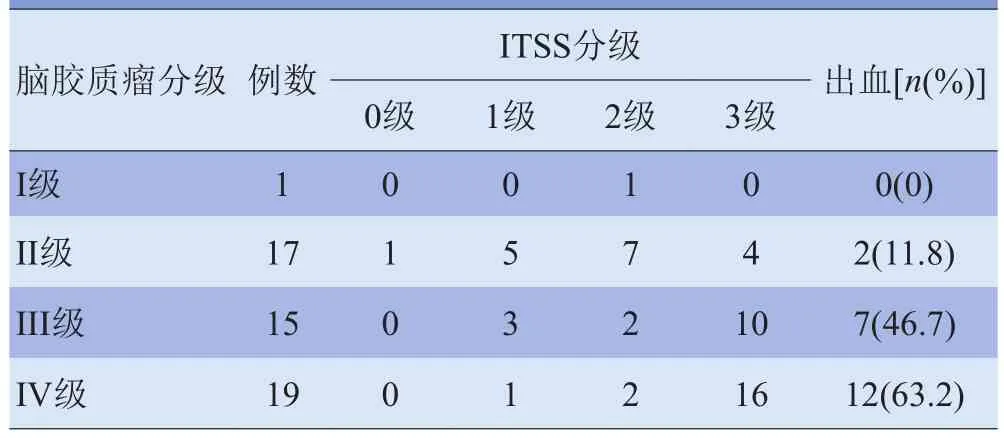
表1 不同级别脑胶质瘤ITSS分级及出血情况
2.2 不同级别脑胶质瘤ADC值比较 低级别胶质瘤及高级别胶质瘤实质部分平均ADC值均显著大于对侧正常区域,差异有统计学意义(Z=-5.270、-6.930, P<0.01),且低级别胶质瘤实质部分平均ADC值显著高于高级别胶质瘤,差异有统计学意义(U=689.000, P<0.01)。见表2。
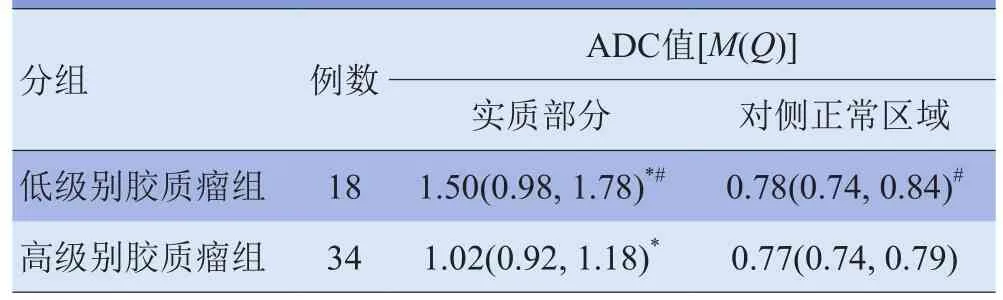
表2 不同级别脑胶质瘤ADC值比较(×10-3mm2/s)
2.3 ITSS分级、ADC值与病理分级的相关性Spearman相关分析发现,ITSS分级与病理分级呈显著正相关(r=0.727, P<0.001),ADC值与病理分级呈显著负相关(r=-0.622, P<0.001),不同级别脑胶质瘤ITSS分级与ADC值呈显著负相关(r=-0.617, P<0.001)。
2.4 ITSS分级与ADC值在脑胶质瘤术前分级中的诊断效能 将ITSS为0、1级定为低级别胶质瘤,2、3级定为高级别胶质瘤,取ADC值为1.3×10-3mm2/s作为阈值时,ADC值在脑胶质瘤术前分级中的诊断敏感度、特异度、准确度、阳性预测值及阴性预测值均显著高于ITSS分级。见表3、4。

表3 脑胶质瘤ITSS分级、ADC值分级与病理分级比较
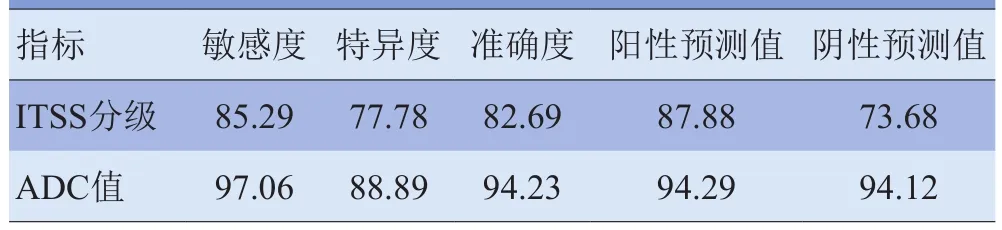
表4 ITSS分级与ADC值在脑胶质瘤术前分级中的诊断效能(%)
2.5 ROC曲线分析 ITSS的ROC曲线下面积为0.917,标准误为0.037,95% CI为0.846~0.989;ADC值的ROC曲线下面积为0.946,标准误为0.039,95% CI为0.869~1.000;联合应用ITSS和ADC值的ROC曲线下面积为0.993,面积的标准误分别为0.009,面积的95% CI为0.975~1.000。见图3。

图3 ITSS分级、ADC值及两者联合诊断脑胶质瘤术前分级的ROC曲线
3 讨论
3.1 SWI对脑胶质瘤术前分级的价值 肿瘤的生长主要依赖新生血管的形成,SWI在显示肿瘤内部结构细节方面较常规MRI和增强扫描具有显著优势,如显示肿瘤的微血管结构、肿瘤内出血及其代谢物、引流静脉等,与病理结果有较高的一致性[6,8],尤其在MinIP图上可以更好地显示条形或迂曲走行的血管结构,而肿瘤内出血则表现为点状或片状,分布不均匀,上下层面也不连续[4,9]。
本研究结果显示,低级别胶质瘤的ITSS多表现为较散在的点状或少许细线样低信号影,其中2例伴有出血;高级别胶质瘤的ITSS多表现为较多的线状低信号影,且点状低信号与线状低信号常聚集或融合,甚至融合呈大片状,其中19例伴有出血,主要与高级别胶质瘤具有血管增长迅速、多发微出血倾向有关。脑胶质瘤内的出血及其代谢产物与其病理分级显著相关[10-12]。本研究发现,随着肿瘤级别的升高,ITSS的数量也随之增加,ITSS级别在不同级别肿瘤中有显著差异,并与病理分级呈显著相关。Kim等[13]的研究结果显示,肿瘤内ITSS的数量和形态可以用于鉴别高、低级别的胶质瘤。Park等[6]对41例胶质瘤的ITSS研究发现,低级别胶质瘤内ITSS为0级;7例Ⅲ级胶质瘤中有3例可见不同级别的ITSS,且呈细线样结构;22例Ⅳ级胶质瘤内均可见ITSS并且级别最高,ITSS呈点状、线条状混合存在,甚至融合呈大片状,ITSS分级与胶质瘤的病理分级呈显著相关。易自生等[14]研究显示,SWI对星形细胞瘤的分级,尤其是高、低级别的判断具有重要价值。
3.2 ADC值在脑胶质瘤术前分级中的价值 ADC值可以反映组织内水分子的扩散情况,与组织内水分子的扩散能力成正比。肿瘤细胞的构成是影响肿瘤组织水扩散运动的重要因素,因此ADC值可以间接地反映肿瘤细胞的增殖情况。肿瘤与正常脑组织细胞结构的差异导致ADC值不同,甚至肿瘤内部不同区域细胞结构的差异也会造成ADC值的差异。脑实质内胶质瘤的细胞密度与ADC值具有良好的相关性。由于不同级别的胶质瘤内部细胞构成不同,其ADC值也存在明显的差异。本组中低级别胶质瘤ADC值为1.50(0.98, 1.78)×10-3mm2/s,显著高于高级别胶质瘤的1.02(0.92, 1.18)×10-3mm2/s,同时ADC值与病理分级呈显著负相关(r=-0.622, P<0.001),与既往研究结果一致[2]。
3.3 ADC值与ITSS的相关性 肿瘤细胞的增殖能力及细胞构成与血供密切相关[15-17]。ADC值与肿瘤细胞的密度具有较好的相关性,而ITSS能很好地反映肿瘤内部的微血管结构。本研究发现,不同级别脑胶质瘤ITSS分级与ADC值呈显著负相关(r=-0.617, P<0.001),即低级别胶质瘤ADC值较高而ITSS级别相对较低,高级别胶质瘤ADC值较低而ITSS级别则相对较高,进一步提示肿瘤血管的生成与肿瘤细胞的增殖能力密切相关。
3.4 ITSS和ADC值诊断脑胶质瘤术前分级的效能本研究将ITSS为0、1级定为低级别胶质瘤,2、3级定为高级别胶质瘤,取ADC值为1.3×10-3mm2/s为阈值时,发现ADC值对胶质瘤术前分级的敏感度、特异度、准确度、阳性预测值及阴性预测值均明显高于ITSS分级。本研究中关于ADC值阈值选取的标准主要是尽量减少被错误归类的病例数,提高对高级别胶质瘤的诊断敏感度、阳性预测值及准确度。在临床工作中,尽管在提高敏感度、阳性预测值的同时会降低诊断特异度,但由于高级别胶质瘤较低级别者更为常见,因此假阴性的可能性较小。即使低级别胶质瘤被误诊为高级别也会进行积极的手术治疗,其效果更佳。ROC曲线分析发现,ADC值较ITSS对脑胶质瘤分级的诊断效能更高,可能是因为本组17例II级胶质瘤患者中,ITSS分级为0~1级6例,ITSS分级为2~3级11例,其中2例伴有出血,提示尽管胶质瘤的级别较低,但是往往也能表现出与高级别胶质瘤相当的血管增殖能力及出血等生物学行为。ADC值通过反映肿瘤细胞的密度来评价脑胶质瘤的分级较ITSS的诊断效能更高,说明通过肿瘤细胞的增殖程度评价肿瘤的分级较肿瘤血管的增殖程度更为可靠。联合应用ITSS分级和ADC值对脑胶质瘤术前分级的诊断效能较单独使用其中一种方法诊断效能明显提高,与Park等[18]的研究结果一致。因此,ITSS分级和ADC值联合应用可以相互补充,能够进一步提高诊断准确性,为患者的治疗提供更有价值的信息。
总之,脑胶质瘤的病理分级与ITSS分级、ADC值均有很高的相关性。SWI可以从更微观的角度评价肿瘤的血供及其内部微血管的结构,ADC值可以间接地反映肿瘤细胞的增殖情况。联合应用ITSS分级和ADC值可以明显提高对脑胶质瘤术前分级的诊断效能,但对脑胶质瘤患者治疗效果的良性影响程度还有待进一步研究。
[1] Sadeghi N, D'Haene N, Decaestecker C, et al. Apparent diffusion coefficient and cerebral blood volume in braingliomas: relation to tumor cell density and tumor microvessel density based on stereotactic biopsies. Am J Neuroradiol, 2008, 29(3): 476-482.
[2] 李茂, 邓德茂, 李荣富, 等. 扩散系数值在脑星形细胞肿瘤病理学分级中的应用. 中华放射学杂志, 2007, 41(10): 1057-1061.
[3] 曾飞雁, 余永强, 王昌新, 等. 神经胶质瘤磁敏感加权成像与灌注成像和病理分级对比研究. 临床放射学杂志, 2011, 30(12): 1730-1735.
[4] Robinson RJ, Bhuta S. Susceptibility-weighted imaging of the brain: current utility and potential applications. J Neuroimaging, 2011, 21(4): e189-e204.
[5] Louis DN, Ohgaki H, Wiestler OD, et al. The 2007 WHO classification of tumors of the central nervous system. Acta Neuropathol, 2007, 114(2): 97-109.
[6] Park MJ, Kim HS, Jahng GH, et al. Semiquantitative assessment of intratumoral susceptibility signals using noncontrast-enhanced high-field high-resolution susceptibilityweighted imaging in patients with gliomas: comparison with MR perfusion imaging. Am J Neuroradiol, 2009, 30(7): 1402-1408.
[7] 苗延巍, 何立岩, 张竞文, 等. MR弥散加权成像对胶质瘤分级的临床应用. 中国医学影像技术, 2005, 21(1): 57-61.
[8] Wieczorek-Pastusiak J, Kociński M, Raźniewski M, et al. An attempt toward objective assessment of brain tumor vascularization using susceptibility weighted imaging and dedicated computer program - a preliminary study. Pol J Radiol 2013, 78(1): 50-56.
[9] Hori M, Ishigame K, Kabasawa H, et al. Precontrast and postcontrast susceptibility-weighted imaging in the assessment of brain neoplasms at 1.5 T. Jpn J Radiol, 2010, 28(4): 299-304.
[10] Ong BC, Stuckey SL. Susceptibility weighted imaging: a pictorial review. J Med Imaging Radiat Oncol, 2010, 54(5): 435-449.
[11] Li C, Ai B, Li Y, et al. Susceptibility-weighted imaging in grading brain astrocytomas. Eur J Radiol, 2010, 75(1): e81-85.
[12] Hori M, Mori H, Aoki S, et al. Three-dimensional susceptibility-weighted imaging at 3 T using various image analysis methods in the estimation of grading intracranial gliomas. Magn Reson Imaging, 2010, 28(4): 594-598.
[13] Kim HS, Jahng GH, Ryu CW, et al. Added value and diagnostic performance of intratumoral susceptibility signals in the differential diagnosis of solitary enhancing brain lesions: preliminary study. Am J Neuroradiol, 2009, 30(8): 1574-1579.
[14] 易自生, 刘一平, 郭文彬, 等. 磁敏感成像在脑星形细胞瘤分级中的价值. 中国医学影像学杂志, 2009, 17(6): 424-427.
[15] 张仙海, 周新韩. 磁敏感加权成像和灌注加权成像在脑肿瘤中的临床应用进展. 国际医学放射学杂志, 2012, 35(2): 120-124.
[16] 刘碧英, 曹代荣, 李银官, 等. 磁敏感加权成像及波谱成像在脑星形细胞瘤分级诊断中的价值研究. 临床放射学杂志, 2012, 31(5): 616-621.
[17] 陈向荣, 许淑惠, 蔡建忠, 等. 联合磁敏感加权成像及多体素质子波谱成像对脑星形细胞瘤分级诊断的研究. 中国医学影像学杂志, 2012, 20(2): 92-96.
[18] Park SM, Kim HS, Jahng GH, et al. Combination of highresolution susceptibility-weighted imaging and the apparent diffusion coefficient: added value to brain tumour imaging and clinical feasibility of non-contrast MRI at 3 T. Br J Radiol, 2010, 83(990): 466-475.
(责任编辑 张春辉)
Correlation of Intratumoral Susceptibility Signal Intensity and Apparent Diffusion Coefficient with Pathological Grading of Brain Glioma
PurposeTo analyze the relevance between magnetic susceptibility weighted imaging intratumoral susceptibility signal intensity (ITSS) and diffusion weighted imaging apparent diffusion coefficient (ADC) with different grade gliomas, and to explore the value of ITSS and ADC in the preoperative grading of gliomas.Materials and MethodsFifty-two cases of glioma patients underwent magnetic susceptibility weighted imaging and diffusion weighted imaging scans, all subjects were divided into low-grade glioma group (18 cases) and high-grade glioma group (34 cases) according to brain tumor grading standard, correlation between ITSS grade and ADC values with tumor grade was analyzed, and ROC curve was used to evaluate the diagnostic efficacy of ITSS and ADC values in the grading of brain glioma.ResultsDifference of ITSS grading was statistically significant (χ2=27.458, P<0.01) among different grade gliomas; difference of ADC values between different grade gliomas was also statistically significant (U=689.000, P<0.01); there was a significant positive correlation (r=0.727, P<0.001) between ITSS grading and pathological grading, ADC values were significantly negatively correlated (r=-0.622, P<0.001) with tumor grading, and ITSS grading was significantly negatively correlated (r=-0.617, P<0.001) with ADC values among different grade brain gliomas. With pathological grading as reference standard, the diagnostic sensitivity, specificity, accuracy, positive predictive value and negative predictive value of ITSS for preoperative glioma grading was 85.29%, 77.78%, 82.69%, 87.88% and 73.68%, respectively, while the diagnostic sensitivity, specificity, accuracy, positive predictive value and negative predictive value of ADC values for preoperative glioma grading was 97.06%, 88.89%, 94.23%, 94.29% and 94.12%, respectively.ConclusionThere is a significant correlation between ITSS grading, ADC values and pathological grading of gliomas, the combination use of ITSS and ADC values can significantly improve the preoperative grading accuracy of brain glioma.
Glioma; Diffusion magnetic resonance imaging; Susceptibility weighted imaging; Diffusion weighted imaging; Apparent diffusion coefficient; Pathology, surgical
1. 天津市环湖医院核磁共振室 天津300060
2.天津市疾病预防控制中心 天津 300011
郭 军
Department of MRI, Tianjin Huanhu Hospital, Tianjin 300060, China
Address Correspondence to: GUO Jun
E-mail: junguomr@163.com
R739.41;R730.42
2013-08-09
修回日期:2013-11-19
中国医学影像学杂志
2013年 第21卷 第12期:894-898
Chinese Journal of Medical Imaging
2013 Volume 21(12): 894-898
10.3969/j.issn.1005-5185.2013.12.004

