3.0T MRI多b值扩散加权成像对女性盆腔良、恶性病变的鉴别诊断价值
乔敏霞 QIAO Minxia
时惠平 SHI Huiping
秦 丹 QIN Dan
周旭嘉 ZHOU Xujia
董世博 DONG Shibo
杨 帆 YANG Fan
梁 鹏 LIANG Peng
3.0T MRI多b值扩散加权成像对女性盆腔良、恶性病变的鉴别诊断价值
乔敏霞 QIAO Minxia
时惠平 SHI Huiping
秦 丹 QIN Dan
周旭嘉 ZHOU Xujia
董世博 DONG Shibo
杨 帆 YANG Fan
梁 鹏 LIANG Peng
目的采用3.0T MRI诊断盆腔病变,确定双指数模型对盆腔病变的诊断价值。资料与方法50例盆腔占位患者(良性30例,恶性20例)行MR750-扩散加权成像(DWI)扫描,b值取0、50、300、600、800、1200 s/mm2,在AW 451工作站,利用Functool-MADC软件进行处理,分别记录并比较良、恶性病变Slow ADC值、Fast ADC值、Standard ADC值、Fraction of fast ADC值,并将Standard ADC图与轴位T2脂肪抑制图像融合。结果良性病变Slow ADC值[(1.83±0.86)×10-3mm2/s]及Standard ADC值[(1.79±0.78)×10-3mm2/s]均大于恶性病变[Slow ADC值:(1.05±0.31)×10-3mm2/s;Standard ADC值:(1.13±0.39)×10-3mm2/s](t=3.90、3.51, P<0.01),且Slow ADC值在良、恶性病变间差异最大。良性病变及恶性病变Slow ADC值均显著小于Fast ADC值[良性:Slow ADC值为(1.83±0.86)×10-3mm2/s,Fast ADC值为(16.95±8.63)×10-3mm2/s;恶性:SlowADC值为(1.05±0.31) ×10-3mm2/s,Fast ADC值为(15.12±9.90)×10-3mm2/s](t=-10.40、-6.29, P<0.01)。结论双指数衰减模型能很好地鉴别诊断良、恶性盆腔肿瘤,对临床术前诊断意义重大。
盆腔肿瘤;磁共振成像,弥散;扩散加权成像;双指数衰减模型;诊断,鉴别;女(雌)性
近年,扩散加权成像(DWI)技术逐渐成为一种常规的影像学检查,尤其在盆腔疾病的诊断中逐渐得到肯定[1]。常用的单指数模型描述水分子扩散在单一的环境中,而人体由不同的组织构成,各组织的细胞类型、细胞密度及血供情况均有差异,因此,用单指数模型描述人体内水分子的运动有一定的偏差。本研究采用多b值双指数模型,通过多参数测量,反映活体组织的扩散和灌注信息,为盆腔肿瘤良、恶性鉴别、后期随访及预后提供可靠的依据[2],为临床诊断和制订治疗方案提供指导。
1 资料与方法
1.1 研究对象 2013-03~07于北京空军总医院就诊的50例女性盆腔病变患者,其中良性病变30例,经常规MRI T1、T2及T1脂肪抑制增强扫描确诊,年龄17~71岁,平均(46.30±15.15)岁;子宫肌瘤11例,囊肿10例,巧克力囊肿6例,卵巢囊腺瘤3例。恶性病变20例,均经手术病理证实,年龄35~74岁,平均(54.80±10.14)岁;宫颈癌11例,子宫内膜癌6例,卵巢癌3例。临床表现:腹痛35例,腹胀5例,绝经后阴道流血15例,6例经体格检查发现。
1.2 仪器与方法 采用GE Discovery MR750 3.0T MRI扫描仪,采用8通道体部线圈(3.0T HD8-CH TORSO ARRAY),快速自旋回波序列(FSE)行常规轴位、矢状位扫描,T1WI:TR 380 ms,TE 8.5 ms;T2WI:TR 5469 ms,TE 85.6 ms,视野280 mm×280 mm,矩阵256×256,激励次数1.5,回波次数1,接受带宽83.3 Hz。增强扫描:经肘正中静脉高压注射钆喷酸葡胺(0.5 mmol/ml),速度2 ml/s,剂量0.1 mmol/kg,注射后行轴位、矢状位、冠状位T1脂肪抑制扫描。扫描范围:自耻骨联合向上至髂骨嵴共24层;失状位,以子宫正中矢状位为基础,向左右各12层。
多b值DWI扫描:自旋回波-回波平面(SE-EPI)序列;全部扩散方向;当b值取50、300、600 s/mm2时,激励次数为2;当b值取800、1200 s/mm2时,激励次数为4;TR 2400 ms,TE 59.5 ms,层厚5 mm,层间距1 mm,视野280 mm×280 mm,矩阵128×160,回波次数1,接受带宽250 Hz。
1.3 图像分析 由2名具有5年MRI工作经验的MRI医师采用双盲法进行分析,在AW 451工作站,利用Functool-MADC软件进行处理,分别记录Slow ADC值、Fast ADC值、Standard ADC值、Fraction of fast ADC值,并将Standard ADC图与轴位T2脂肪抑制图像融合,融合图像可以清楚地显示盆腔的解剖结构(图1B),使肿瘤的定位更加准确。每个病灶测量3次取平均值(图1A),每次设定感兴趣区(ROI)面积尽量一致(每次浮动范围不超过20 mm2),尽量避开坏死、出血及纤维化等信号不均匀区。
1.4 统计学方法 采用SPSS 17.0软件,良、恶性病变组间平均Standard ADC值、Slow ADC值、Fast ADC值、Fraction of fast ADC值比较采用成组t检验,组内各ADC值比较采用配对t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 良、恶性肿瘤的DWI及ADC图特征 DWI图:当b=50 s/mm2时,宫颈癌和囊肿均呈高信号(图2),囊肿的信号高于宫颈癌,随着b值的增加,宫颈癌的高信号衰减不明显,而囊肿的信号衰减很快。

图1 A为DWI图,显示选取的ROI内密度均匀,3次测量的ROI范围大致相同;B为DWI图与T2脂肪抑制图像的融合,清楚地显示盆腔内的解剖结构:髂骨(箭)、肌肉群(星号)、肠管(箭头)及病灶

图2 A、B分别为b=50 s/mm2时宫颈癌(箭)和囊肿(箭头)的DWI图。宫颈癌信号明显低于囊肿

图3 A、B分别为宫颈癌(箭)和囊肿(箭头)的Standard ADC图。宫颈癌呈浅蓝色,而囊肿呈红色

图4 A、B分别为宫颈癌(箭)和囊肿(箭头)的Slow ADC图。宫颈癌呈浅蓝色,而囊肿呈均匀红色
Standard ADC图(图3)显示,宫颈癌呈浅蓝色,囊肿呈红色;由良性肿瘤到恶性肿瘤,肿瘤颜色由红色变为蓝色。Slow ADC图(图4)与Standard ADC图比较相似,宫颈癌内颜色不均一,出现点状浅蓝色,可能与宫颈癌内细胞形态、大小及大分子物质不同有关;囊肿内颜色均一。Fast ADC图(图5)显示,由良性肿瘤到恶性肿瘤,随着血流增多,肿瘤颜色由红色变为蓝色。Fraction of fast ADC图(图6)显示,恶性肿瘤由于血供丰富,其内主要呈浅蓝色;良性肿瘤内血流灌注少,其内浅蓝色信号逐渐减少,囊肿由于无血流,其内无颜色填充。
2.2 良、恶性肿瘤各ADC值比较 良性肿瘤Slow ADC值及Standard ADC值均显著大于恶性肿瘤,差异有统计学意义(t=3.90、3.51, P<0.01),且Slow ADC值在良、恶性肿瘤间差异较大;良性肿瘤Fast ADC值略大于恶性肿瘤,Fraction of fast ADC值略小于恶性肿瘤,提示良性肿瘤的微循环灌注分数小于恶性肿瘤,但差异均无统计学意义(t=0.69、-1.15, P>0.05)。
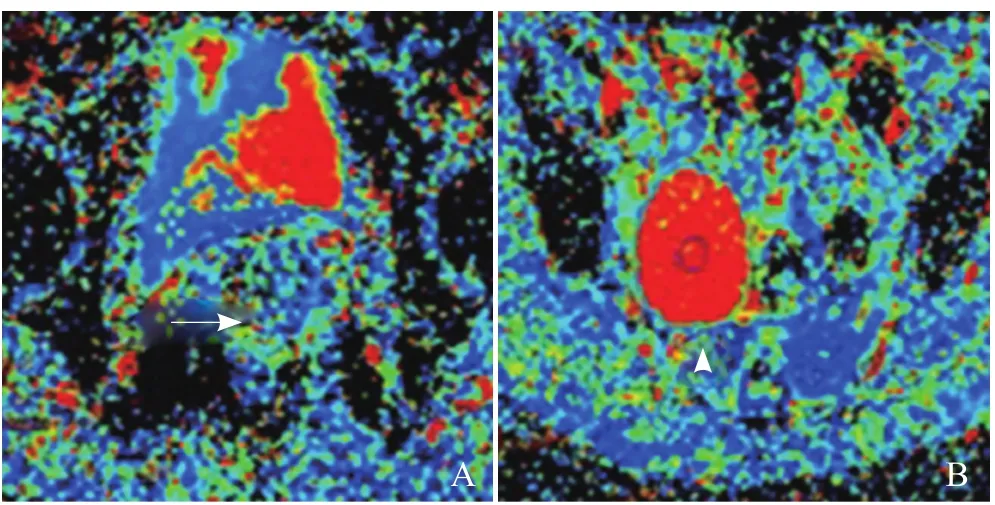
图5 A、B分别为宫颈癌(箭)和囊肿(箭头)的Fast ADC图。宫颈癌由于有血流灌注,呈浅蓝色;囊肿无血流灌注,呈红色
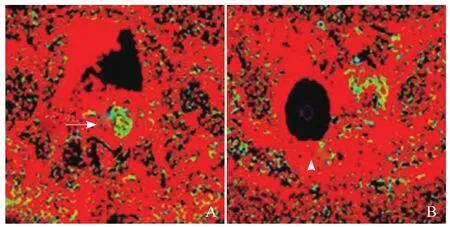
图6 A、B分别为宫颈癌(箭)和囊肿(箭头)的Fraction of fast ADC图,即灌注分数。宫颈癌血流丰富;囊肿无血流灌注,图像显示无信号,即Fraction of fast ADC为0
良性肿瘤及恶性肿瘤组内比较,Slow ADC值与Fast ADC值、Fast ADC值与Standard ADC值间差异均有统计学意义(良性:t=-10.40、10.23, P<0.01;恶性:t=-6.29、6.29, P<0.01),Slow ADC值与Standard ADC值间差异无统计学意义(良性:t=0.57, P>0.05;恶性:t=-1.30, P>0.05),说明Slow ADC值更接近Standard ADC值。见表1。
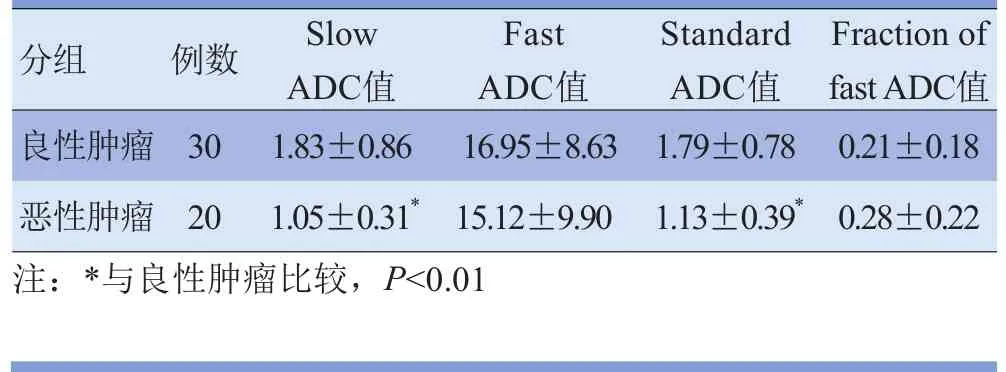
表1 盆腔良、恶性肿瘤各ADC值比较(×10-3mm2/s)
3 讨论
3.1 DWI概述 DWI应用二维平面回波扩散加权序列(EPI2DWI)技术,在自旋回波T2加权序列180°脉冲两侧各加上一个扩散敏感梯度脉冲即扩散梯度,使自由运动的水分子失相位,扩散受限的水分子失相位较少而呈高信号。DWI通过不同组织间的水分子扩散差异造成信号衰减不同来成像[3],可以从分子水平反映组织结构、功能和代谢异常[4],反映活体组织微观结构的改变。以37℃体温下自由水为标准,水分子在50 ms内的平均位移为30 μm[5],这远远大于人体内细胞的大小,因此,人体内细胞膜、大分子物质阻碍了水分子的运动。DWI技术中把施加的扩散敏感梯度场参数称为扩散敏感系数,即b值,人体内水分子的扩散状态用ADC表示,分子扩散越受限,ADC越低;反之则较高。
3.2 双指数模型在鉴别诊断良、恶性病变中的价值双指数衰减模型是在体素内不相干运动技术基础上把人体内的水分成血管内水和血管外水[6,7],血管外水即细胞内水和细胞间液,流动比较缓慢,这种移动称为表观扩散。血管内水即人体内流动的血液中的水,这种水伴随着血液流动很快,相对于血管外水,这种水运动称为假扩散,即灌注[8]。灌注对单一的曲线衰减有影响,但经常被忽视。双指数模型能弥补这一点,它能分离体内水分子的扩散和灌注,分别用Slow ADC值、Fast ADC值表示。Standard ADC值是计算机算出来的一个综合ADC值;Fraction of fast ADC代表Fast ADC值所占比例,即灌注系数f。
本研究结果显示,良性肿瘤各ADC值均大于恶性肿瘤,且Slow ADC值在良、恶性肿瘤间的差异较大,提示恶性肿瘤的血管外水(即细胞内水和细胞间液)和血管内水扩散较良性肿瘤均受限,且描述血管外水分子扩散状态的Slow ADC值对鉴别盆腔肿瘤的良、恶性意义较大。良、恶性肿瘤的差别主要是细胞类型及细胞密度不同,Matsumoto等[9]研究表明,ADC值与细胞所处的温度、细胞密度、细胞膜的完整性有关,细胞所处的温度从27℃升高到45℃时以及细胞膜破坏时,ADC值均升高;细胞密度增加时,ADC值减低。恶性肿瘤代谢快,需要更多的细胞器提供能量,细胞核大,排列紧密,细胞外间隙窄,因此对细胞内和细胞间水分子的扩散更受限。良性肿瘤Fraction of fast ADC值小于恶性肿瘤,提示良性肿瘤的微循环灌注小于恶性肿瘤,与恶性肿瘤生长速度快、血管密集、血流丰富,即与微循环灌注活跃有关[10]。
良、恶性肿瘤间Fast ADC值差异无统计学意义(P>0.05)。由于Fast ADC代表局部血流微灌注,与良性肿瘤有一些重叠,也可能是由于本研究所选用的良性肿瘤种类不同、血供不同所致。良、恶性肿瘤Slow ADC值与Standard ADC值间差异无统计学意义(P>0.05),提示Slow ADC值更接近Standard ADC值。无论是良性肿瘤还是恶性肿瘤,其Slow ADC值均小于Fast ADC值,说明血管外水比血管内水扩散更受限,且血管外水的扩散状态更接近组织整体的扩散状态,而血管内水的扩散状态即灌注只占很小一部分[良性为(0.21±0.18)×10-3mm2/s,恶性为(0.28±0.22)×10-3mm2/s]。既往研究认为b值≥150 s/mm2可以消除灌注对组织扩散状态的影响[5,11]。因此,应用双指数衰减模型可以定量描述细胞水分子的扩散状态和组织血流灌注情况,较好地鉴别肿瘤的良、恶性,还可以进一步确定肿瘤分级。King等[12]的研究表明,肿瘤恶性程度越高,ADC值越低 。
3.3 双指数模型的意义 相对于单指数衰减模型,多b值双指数模型不仅可以用多个参数描述肿瘤的特性,为肿瘤良、恶性的鉴别诊断提供充分的依据,还可以提供肿瘤的血流灌注情况,有望代替增强扫描,避免造影剂的过敏反应和后期的肝肾损害,适用于有造影剂禁忌证的患者。在后期的肿瘤随访中,可以鉴别肿瘤复发和术后改变,作为一种早期的无创方法监测肿瘤对癌症治疗的反应。
总之,DWI多b值双指数模型作为一种无创的扫描技术,从分子水平描述肿瘤组织的特性,有助于临床诊断及肿瘤良、恶性的鉴别诊断,可以作为一种常规的影像学检查技术应用于临床。然而由于本研究样本量较少,还需增加样本量进一步研究,以确定DWI双指数模型的应用前景。
[1] Sala E, Rockall A, Rangarajan D, et al. The role of dynamic contrast-enhanced and diffusion weighted magnetic resonance imaging in the female pelvis. Eur J Radiol, 2010, 76(3): 367-385.
[2] 王岳, 蔡文超, 叶锦棠, 等. 多b值DWI序列检测前列腺癌扩散和灌注信息的初步研究. 实用放射学杂志, 2012, 28(12): 1835-1837.
[3] 郭靖, 汪俊萍, 李威. 扩散加权成像在鉴别诊断子宫内膜癌盆腔淋巴结性质中的应用. 中国医学影像学杂志, 2013, 21(3): 227-230.
[4] Charles-Edwards EM, de Souza NM. Diffusion-weighted magnetic resonance imaging and its application to cancer. Cancer Imaging, 2006, 6: 135-143.
[5] Padhani AR, Liu G, Koh DM, et al. Diffusion-weighted magnetic resonance imaging as a cancer biomarker: consensus and recommendations. Neoplasia, 2009, 11(2): 102-125.
[6] 任静, 宦怡, 常英娟, 等. 前列腺癌多b值扩散加权成像研究. 实用放射学杂志, 2008, 24(4): 502-504, 576.
[7] Giannarini G, Petralia G, Thoeny HC. Potential and limitations of diffusion-weighted magnetic resonance imaging in kidney, prostate, and bladder cancer including pelvic lymph node staging: a critical analysis of the literature. Eur Urol, 2012, 61(2): 326-340.
[8] Riches SF, Hawtin K, Charles-Edwards EM, et al. Diffusionweighted imaging of the prostate and rectal wall: comparison of biexponential and monoexponential modelled diffusion and associated perfusion coefficients. NMR Biomed, 2009, 22(3): 318-325.
[9] Matsumoto Y, Kuroda M, Matsuya R, et al. In vitro experimental study of the relationship between the apparent diffusion coefficient and changes in cellularity and cell morphology. Oncol Rep, 2009, 22(3): 641-648.
[10] Rheinheimer S, Stieltjes B, Schneider F, et al. Investigation of renal lesions by diffusion-weighted magnetic resonance imaging applying intravoxel incoherent motion-derived parameters--initial experience. Eur J Radiol, 2012, 81(3): 310-316.
[11] Thoeny HC, Ross BD. Predicting and monitoring cancer treatment response with diffusion-weighted MRI. J Magn Reson Imaging, 2010, 32(1): 2-16.
[12] King AD, Ahuja AT, Yeung DK, et al. Malignant cervical lymphadenopathy: diagnostic accuracy of diffusion-weighted MR imaging. Radiology, 2007, 245(3): 806-813.
(责任编辑 张春辉)
3.0T MRI Multi-b-value Diffusion Weighted Imaging in the Differential Diagnosis of Female Pelvic Benign and Malignant Lesions
PurposeTo explore the diagnostic value of double exponential model for pelvic lesions using 3.0T MRI for the diagnosis of pelvic lesion.Materials and MethodsFifty patients with pelvic lesions (30 benign cases and 20 malignant cases) underwent MR750-diffusion weighted imaging (DWI) scans, with b values of 0, 50, 300, 600, 800 and 1200 s/mm2, Functool-MADC software was used on AW 451 workstations for data processing, Slow ADC value, Fast ADC value, Standard ADC value, Fraction of fast ADC value were recorded and compared between benign and malignant lesions, and Standard ADC images were fused with axial T2 fat-suppressed images.ResultsSlow ADC values [(1.83±0.86)×10-3mm2/s] and Standard ADC values [(1.79±0.78)×10-3mm2/ s] of benign lesions were larger than those of the malignant lesions [Slow ADC values: (1.05±0.31)×10-3mm2/s; Standard ADC values: (1.13±0.39)×10-3mm2/s] (t=3.90, 3.51; P<0.01), and the difference of Slow ADC value was largest between benign and malignant lesions. Slow ADC values of both benign and malignant lesions were significantly less than the Fast ADC values [benign: Slow ADC value=(1.83±0.86)×10-3mm2/s, Fast ADC value=(16.95±8.63)×10-3mm2/s; malignant: Slow ADC value=(1.05±0.31)×10-3mm2/ s, Fast ADC value=(15.12±9.90)×10-3mm2/s] (t=-10.40, -6.29; P<0.01).ConclusionDouble exponential decay model is capable of differentiating benign and malignant pelvic tumors, thus is of great significance for clinical preoperative diagnosis.
Pelvic neoplasms; Diffusion magnetic resonance imaging; Diffusion weighted imaging; Biexponential decay model; Diagnosis, differential; Female
空军总医院放射科 北京 100142
时惠平
Department of Radiology, Air Force General Hospital, Beijing 100142, China
Address Correspondence to: SHI Huiping
E-mail: 1684743648@qq.com
R737.3;R445.2
2013-08-11
修回日期:2013-11-19
中国医学影像学杂志
2013年 第21卷 第12期:951-954
Chinese Journal of Medical Imaging
2013 Volume 21(12): 951-954
10.3969/j.issn.1005-5185.2013.12.020

