鸡源唾液乳杆菌的分离鉴定及生物学特性研究
武香玉,徐海燕,辛国芹,赵 影,谷 巍
(山东宝来利来生物工程股份有限公司,山东 泰安 271000)
乳杆菌作为动物肠道的优势菌群之一,其对生物体的益生作用已被许多研究结果证实。而目前对乳杆菌特性的研究多限于乳品、植物等来源的乳杆菌,动物源乳杆菌虽然也被应用,但对其生物特性研究和筛选的报道却不系统和全面。本试验以鸡肠道黏膜为分离源分离乳酸菌并鉴定,并对其生物学特性进行了研究,以期为微生态制剂的开发应用提供依据。
1 材料与方法
1.1 试验材料
1.1.1 分离源
泰安鸡的肠道黏膜。
1.1.2 培养基
乳酸菌发酵培养基:改良的MRS培养基,添加CaCO31%[1]。
1.2 试验方法
1.2.1 乳酸菌的分离筛选
初筛:健康鸡解剖后无菌剪开小肠,无菌棉拭子蘸取小肠黏膜黏液,将棉拭子置于无菌水(带玻璃珠)中震荡,将样品充分打散混匀,取振荡液依次稀释至10-2、10-3、10-4,各稀释度取0.1mL涂平板(MRS),2个重复,于37℃培养箱培养。分离纯化菌株,4℃保藏备用。
复筛测定产酸性能,将分离的菌种以2%接种量接种于改良的MRS培养基中,37℃静置培养,测定发酵液的pH。
1.2.2 菌种的鉴定
生理生化试验、分子鉴定(16S rRNA)[2-4]。PCR扩增引物为 1492r 5'-ggttaccttgttacgactt-3',27f 5'-agagttgatcctggctcag-3'。菌落PCR反应条件为94℃预变性5min,94℃变性1min,52℃退火1 min,72℃延伸2min,25个循环,72℃延伸10 min。PCR产物经salt-free纯化后,测序由博尚生物技术有限公司完成,要求双向测通。将拼接后的序列结果输入www.NCBI.nlm.nih.gov/blast,与Gen-Bank数据库中的序列进行同源性比对。
1.2.3 菌株特性研究
生长曲线的测定:以2%接种量将G-2-1接种于改良的MRS培养基中,37℃静置培养,于0、4、8、10、12、14、16、18、20、22、24、28、32 h取样测定pH以及活菌数,以培养时间为横坐标,相应的活菌数与pH为纵坐标,绘制生长曲线,找出最佳培养时间。
耐酸性试验:取发酵22 h的菌液,离心,弃上清,生理盐水洗涤,加入生理盐水5mL,盐酸调节使其pH分别为2.0、3.0、4.0、5.5(对照),再定容至10mL,37℃培养2 h。平板计数,计算存活率(%)。
耐胆盐试验:在MRS培养基中加入猪胆酸盐,使其质量分数分别为0.1%、0.2%、0.3%、0.4%,不加胆盐的MRS培养基为对照,菌液按1%的接种量接种,37℃培养30min。平板计数,计算存活率(%)。
体外抑菌试验参照徐海燕等方法[5]。
1.3 数据分析
试验结果与Genbank数据库的序列作比对,采用MEGA软件构建系统发育树。
2 结果与分析
2.1 菌株筛选结果
从5份鸡样品中分出14株在添加CaCO3的MRS平板上能够有透明圈的菌株,各菌株发酵液pH见表1。由表1可以看出,14株菌产酸能力均较好,有13株菌的发酵液pH<4,其中以G-2-1发酵液pH最低,为3.60。
2.2 菌株鉴定结果
菌株G-2-1生理生化特征分析结果见表2。

表1 G-2-1等菌株发酵液的pH
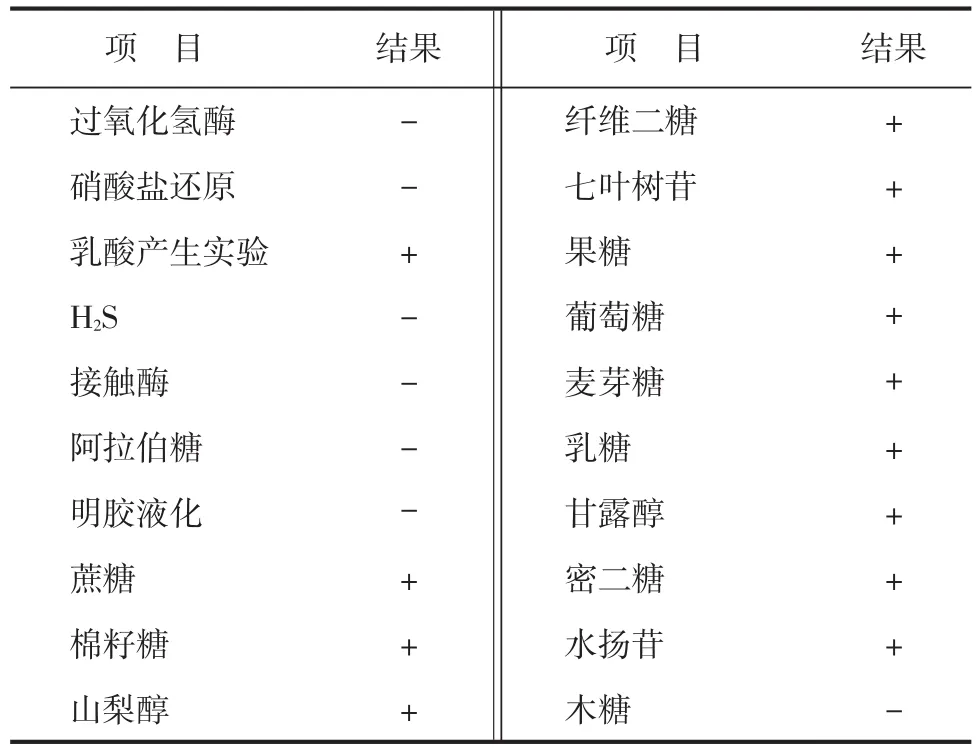
表2 G-2-1生理生化特性结果
菌株G-2-1的16S rRNA PCR电泳图见图1,条带在1 000~2 000 bp,约为1 500 bp。由测序结果可知,其序列长度为1 437 bp。其具体序列见图2。

图1 G-2-1PCR电泳图
将图2序列输入www.NCBI.nlm.nih.gov/blast,与Genbank数据库的序列作比对,进行同源性分析,得到最相似的物种名,登录号及其相似率,见表3。

图2 菌株G-2-1的序列

表3 G-2-1的16S rRNA同源性比较
根据BLAST比对的结果初步鉴定G-2-1为Lactobacillus salivarius,然后从EMBL等数据库中筛选相关模式菌株的16S rRNA序列,将G-2-1序列与模式菌株序列一起经Clusta X1.83软件进行多序列比对,采用软件MEGA构建系统发育树,见图3。从图3可以看出,G-2-1与AF089108在1个分支,Bootstrap值为99,是可信的。因此将菌株G-2-1鉴定为唾液乳杆菌。
2.3 菌株特性试验研究结果
2.3.1 生长曲线的绘制
生长曲线见图4。由图4可见,G-2-1约在4 h进入对数期,10 h后稳定增长,在20 h活菌数达最高26.5×108cfu·mL-1。G-2-1在进入对数期后pH急剧降低,稳定期时,pH较低,产酸能力较强。
2.3.2 耐酸性试验结果
耐酸性试验结果见表4。
由表4结果可知,在pH>3时G-2-1生长良好,存活率菌>100%,酸度对其生长无影响,可能会促进其生长,在pH 2.0时存活率为27.6%。
2.3.3 耐胆盐试验结果
乳酸菌的另一个重要特征是对胆汁的耐受程度,乳酸菌要到达并定植于肠道,必须对胆盐有一定的耐受性,对胆盐的耐受程度决定了其在肠道中的存活能力。耐胆盐试验结果见表5。
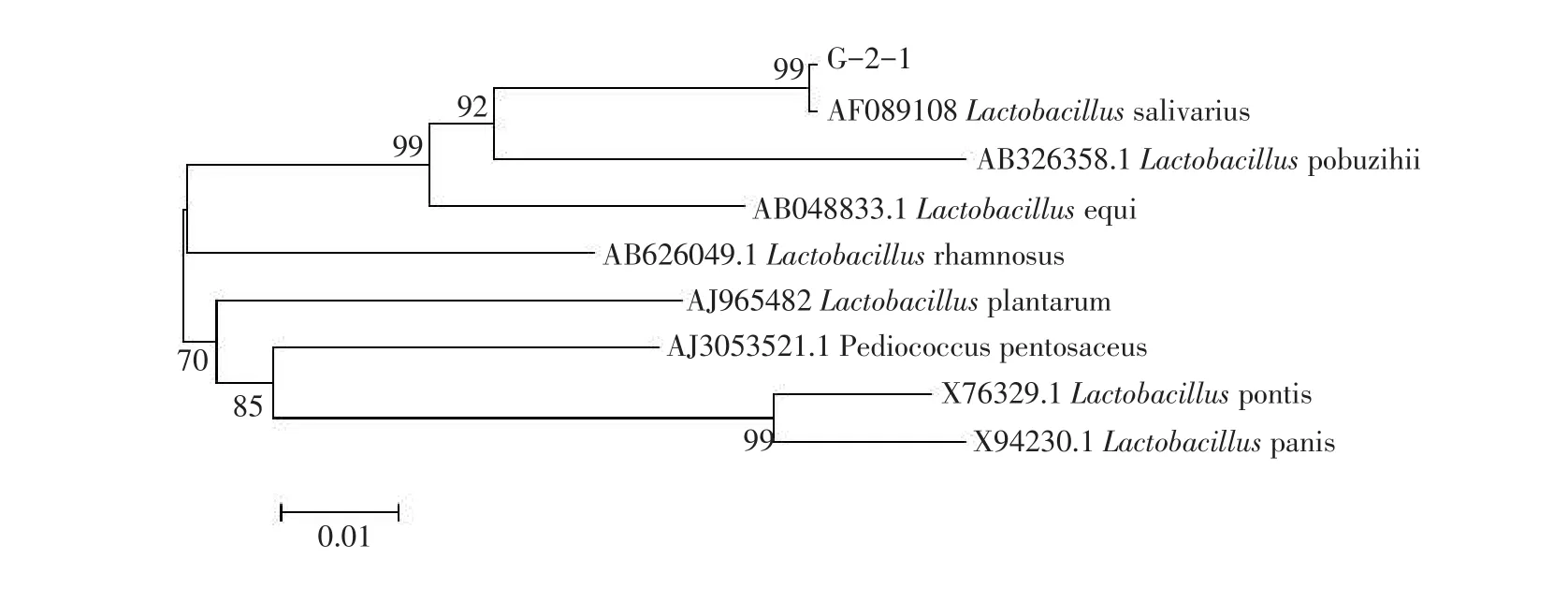
图3 菌株G-2-1系统发育树
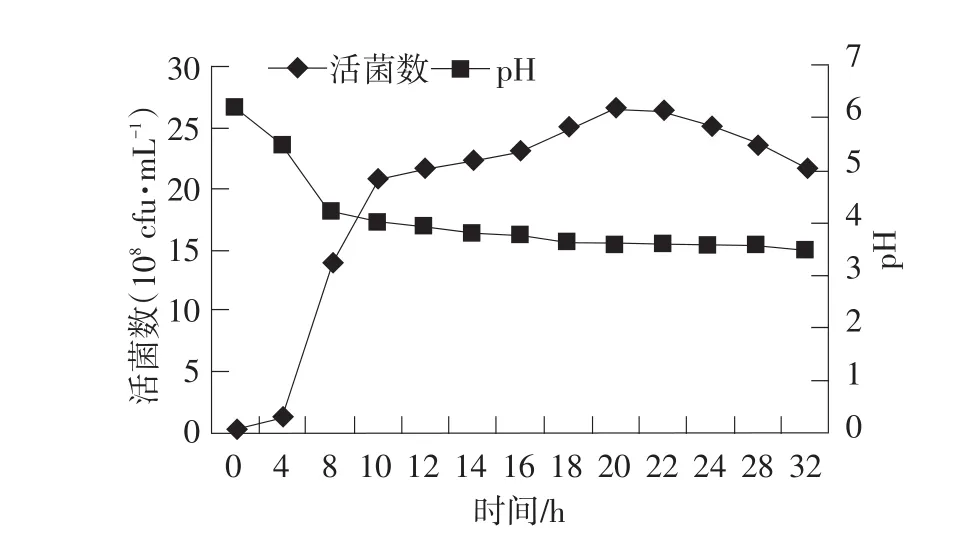
图4 G-2-1的生长曲线

表4 G-2-1的耐酸性试验结果

表5 G-2-1在不同浓度胆盐中的生长情况
由表5结果可知,在胆盐浓度>0.2%时严重影响菌株生长,存活率<5.1%,胆盐浓度0.1%时对其生长基本无影响,存活率达99.2%,G-2-1的耐胆盐能力一般。
2.3.4 体外抑菌试验结果
通过测量抑菌圈直径的大小测量G-2-1对致病菌的体外抑制程度,结果见表6。
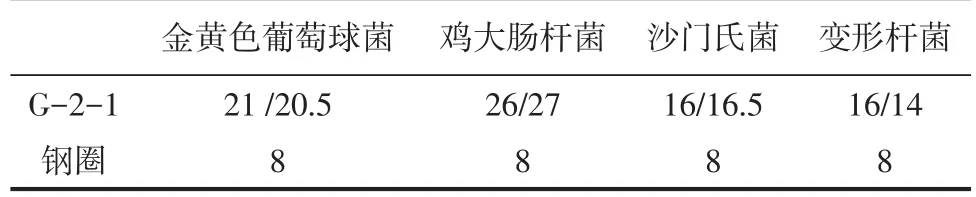
表6 G-2-1的抑菌圈直径mm
由表6可以看出,G-2-1对4种致病菌均有抑制作用,尤其是对大肠杆菌,抑制效果较好。这可能是营养竞争、产生H2O2以及细菌素等多方面综合作用的结果。
3 结 论
本试验以鸡肠道黏膜为分离源分离筛选到一株产酸性能良好菌株G-2-1,结合形态观察、生理生化特性分析以及16S rRNA基因序列分析,将此菌株鉴定为唾液乳杆菌。生物学特性试验研究结果表明,G-2-1具有良好的生物学特性,G-2-1在MRS培养基中生长旺盛,20 h时活菌数>109cfu·mL-1;耐酸效果良好;在胆盐浓度为0.1%时存活率为99.2%;抑菌效果较好。
本试验筛选的鸡源唾液乳杆菌是健康鸡本身分离得到的菌株,耐酸好,对常见致病菌均有抑制作用,预期可作为微生态制剂用菌株,应用效果有待于在研究和生产实践中检验。
[1] 张刚.乳酸细菌——基础、技术和应用[M].北京:化学工业出版社,2007.
[2] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[3]雷正瑜.16SrDNA序列分析技术在微生物分类鉴定中的应用[J].湖北生态工程职业技术学院学报,2006,4(1):4-7.
[4] 武香玉,陈存社.微生物絮凝剂产生菌的筛选鉴定[J].中国酿造,2009(9):79-82.
[5] 徐海燕,曹斌,杨军方.鸡源嗜酸乳杆菌的筛选[J].中国饲料,2006(19):32-34.

