宰后牦牛肉成熟过程中钙激活酶与嫩度指标的相关性分析
师希雄 余群力 党欣
摘 要:以10头甘南牦牛为研究对象,对宰后8d 成熟期间肌原纤维小片化指数、剪切力、肌纤维直径、μ-钙蛋白酶(μ-calpain)、m-钙蛋白酶(m-calpain)、钙蛋白酶抑素(calpastatin)的活力进行了测定,同时研究了3种酶活力与肌原纤维小片化指数、剪切力、肌纤维直径3个嫩度指标之间的相关性。结果表明:μ-calpain、m-calpain、calpastatin 3种酶与剪切力值及肌纤维直径均呈正相关;3种酶与肌原纤维小片化指数呈负相关,其中μ-calpain与calpastatin呈显著负相关(P<0.05)。因此,钙激活酶活力的变化可能导致了肌原纤维小片化指数的增加,肌原纤维的弱化和肉的嫩化,μ-calpain可能是牦牛肉嫩化的主要贡献者。
关键词:牦牛肉;成熟;钙激活酶;嫩度
中图分类号:TS251.1 文献标志码:A 文章编号:1001-8123(2013)06-0001-04
肉的嫩度是所有肉品质中最重要的指标之一,它将决定肉是否被重复购买[1-2]。成熟是改善肉嫩度的有效方法之一。肉的最终嫩度取决于由内源蛋白酶引起的肌原纤维结构改变和弱化的程度,这些内源蛋白酶包括钙激活酶、组织蛋白酶、细胞凋亡酶、蛋白酶体等[3]。目前,普遍认为,钙激活酶在肉的嫩化中起着重要的作用[4]。骨骼肌中的钙蛋白酶包括钙蛋白酶1(μ-calpain)、钙蛋白酶2(m-calpain)、钙蛋白酶3(p94)以及钙激活酶的内源性的专一抑制蛋白(calpastatin)[5]。
李诚等[6]研究表明,杜长大三元杂交猪的背最长肌(longissimus dorsi,LDM)、腰大肌(psoas major,PM)两种不同部位猪肉在宰后0~4℃冷却成熟过程中钙蛋白酶粗酶液活性、肌原纤维小片化指数(myofibril fragmentation index,MFI)和剪切力之间呈现较高的相关性。田甲春等[7]研究发现,青海牦牛肉成熟过程中MFI 和钙激活酶活性相关性极显著,与组织蛋白酶L活性相关性显著,钙激活酶活性与组织蛋白酶L活性呈显著负相关。郭兆斌等[8]研究了甘南牦牛肉成熟过程中食用品质、钙激活酶粗酶活性、肌原纤维超微结构的变化规律。关于宰后牦牛肉成熟过程中μ-calpain、m-calpain及calpastatin的变化报道极少,特别是甘南牦牛肉成熟过程中μ-calpain,m-calpain及calpastatin的变化及其与嫩度指标的相关性未见报道。本实验旨在研究甘南牦牛肉宰后成熟过程中μ-calpain、m-calpain及calpastatin的变化及其与嫩度指标的相关性,以便为构建牦牛肉嫩度的预测模型提供参考。
1 材料与方法
1.1 材料及试剂
随机选取甘南藏族自治州夏河县,自然放牧条件下,发育正常健康无病、年龄3岁左右的黑牦牛12头,进行屠宰,宰后牦牛的背最长肌立即被移除,分割成平均质量为50g的样品,带回实验室,在0~4℃的条件下成熟0、1、3、5、7、8d,不同成熟时间点收集的样品,一部分在-80℃的条件下冷冻用于测定钙激活酶的活性,另一部分测定剪切力、肌原纤维小片化指数及肌纤维直径。酪蛋白、Tris、MCE、亮肽素、PMSF、卵类黏蛋白抑制剂、EDTA均购自Sigma公司。
1.2 仪器与设备
C-LM型数显式肌肉嫩度仪 北京阳光亿事达贸易有限公司;PPS-2蛋白纯化系统 上海金达生化仪器公司;XSP-8CA显微镜 上海光学仪器一厂。
1.3 方法
1.3.1 肌原纤维小片化指数测定
参考Kriese等[9]的方法进行测定。
1.3.2 剪切力测定
沿着肌纤维方向取厚度3cm的肉样,在80℃水浴锅中恒温加热至肉样中心温度达75℃,取出冷却至室温后,用直径1.27cm的取样器沿肌纤维方向钻取3个肉柱测定样,用嫩度仪测定剪切力值,剪切力值以N表示。每个肉样平行测定3次,取平均值。
1.3.3 肌纤维直径测定
参考李鹏等[10]的方法,取背最长肌的中央部位 3cm×2cm×1cm肉块3块,浸泡到1:10(V/V)甲醛溶液中,然后在10×40倍显微镜下随机计数200根肌纤维直径,求其平均值。
1.3.4 钙激活酶活性的测定
1.3.4.1 酶的分离与纯化
参考Delgado等[11]的方法并稍做改动。取宰后不同时间点的牦牛肉样品,准确记录其质量,绞碎后于4℃匀浆,加入150mL抽提液(pH8.3、100mmol/L Tris-HCl,10mmol/L EDTA,10mmol/L β-巯基乙醇(MCE),100mg/L 卵類黏蛋白抑制剂,2mmol/L苯甲基磺酰氟(PMSF),5mg/L亮抑酶肽),以匀浆3min,间隔3min模式运行,共5次。然后离心(4℃,18000×g,120min),去沉淀,取上清,并以0.45μm针式滤膜过滤。对过滤后的上清取(NH4)2SO4分级沉淀部分,用25mL匀浆缓冲液溶解沉淀部分并用25倍体积的透析液(4℃,40mmol/L Tris-HCl,pH7.35;5mmol/L EDTA;10mmol/L MCE)进行透析。透析后的溶液离心(4℃,18000×g,60min)取上清,并以0.45μm针式滤膜过滤后上柱。
DEAE-Sephacel离子交换柱(1.6cm×20cm),首先用平衡缓冲液(TEMA)(4℃,50mmol/L Tris-HCl,pH7.5;0.5mmol/L EDTA;10mmol/L MCE)进行平衡,用TEMA将杂蛋白洗脱至基线,目标蛋白用0→400mmol/L NaCl的TEMA溶液进行线性梯度洗脱,流速0.5mL/min,每管3mL被收集,calpastatin在20~110mmol/L NaCl浓度的范围被洗脱下来,μ-calpain在110~165mmol/L NaCl浓度的范围被洗脱下来,m-calpain在220~330mmol/L NaCl浓度的范围被洗脱下来。
1.3.4.2 钙激活酶活性测定
参考Morton等[12]的方法。
1.4 数据处理与统计分析
用SPSS16.0对数据进行方差分析,并用Duncan 法进行多重比较。
2 结果与分析
2.1 宰后牦牛肉成熟过程中钙激活酶活性的变化
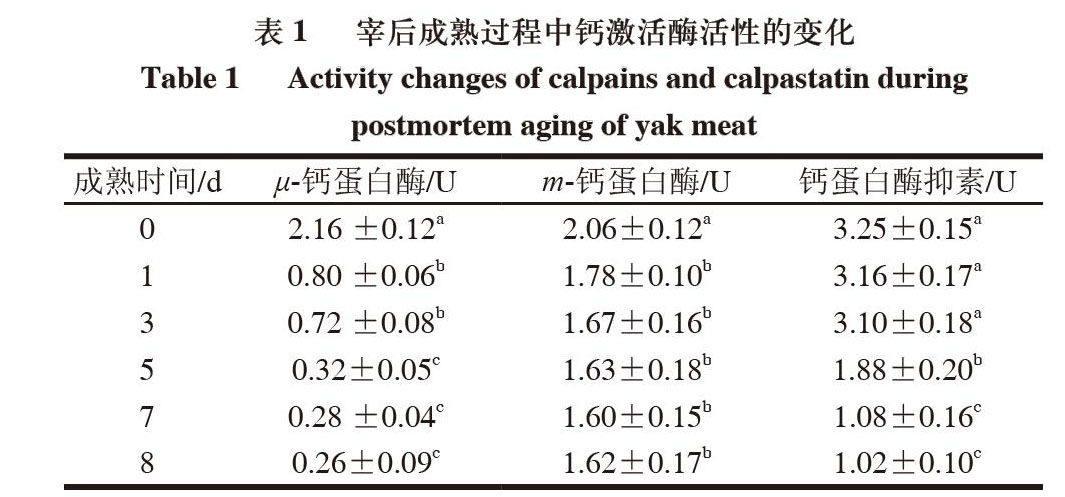
由表1可知,在宰后牦牛肉成熟过程中,μ-calpain的活性在宰后5d之内显著降低,5d后,μ-calpain活性变化不显著,m-calpain的活性在宰后1d之内稍有降低,之后,变化不显著,calpastatin的活性在宰后3d内差异不显著,3d之后活性不断降低。3种酶在宰后成熟过程中的变化趋势与Delgado等[11]的报道基本一致。
μ-calpain与m-calpain需要足够的钙离子才能激活,激活后酶将遭受自溶,μ-calpain的自溶导致了酶的不稳定,最终导致了活力的丧失[13]。calpastatin活力的降低是由于钙激活酶抑制蛋白多肽的降解造成的[14]。
2.2 宰后牦牛肉成熟过程中嫩度指标的变化
2.2.1 剪切力值的变化
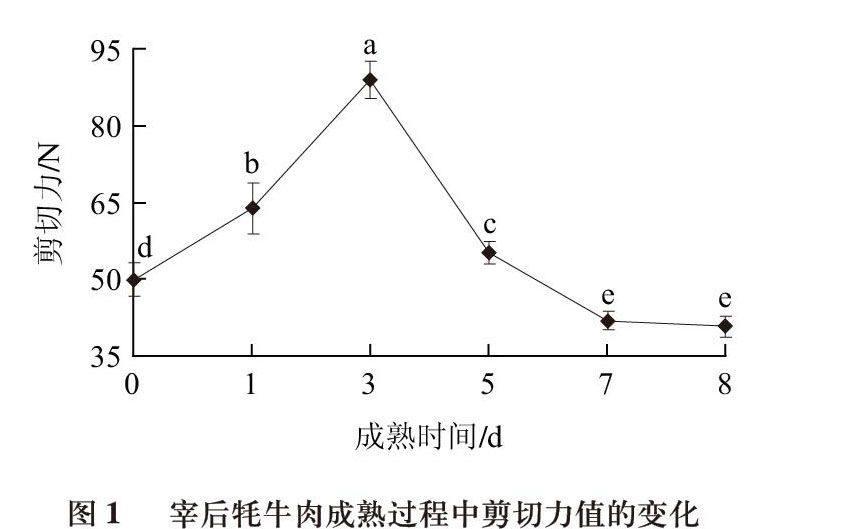
肉的嫩度又称为肉的柔软性,指肉在食用时口感的老嫩,反映了肉的质地。它在本质上取决于肌纤维直径、肌纤维密度、肌纤维类型、肌纤维完整性、肌内脂肪含量、结缔组织含量及类型等[15]。肉嫩度评定最常用的方法是用嫩度仪测定剪切力,剪切力值越低,肌肉越嫩。图1反映宰后牦牛肉在成熟8d的过程中剪切力值的变化,在宰后0~3d内,剪切力值显著升高,在3~5d内,剪切力值显著降低,7d后变化不显著。最初剪切力值的逐渐增加是肌肉僵直的典型特征,随后剪切力值的逐渐变小是逐渐成熟的过程[16]。
2.2.2 肌原纤维小片化指数
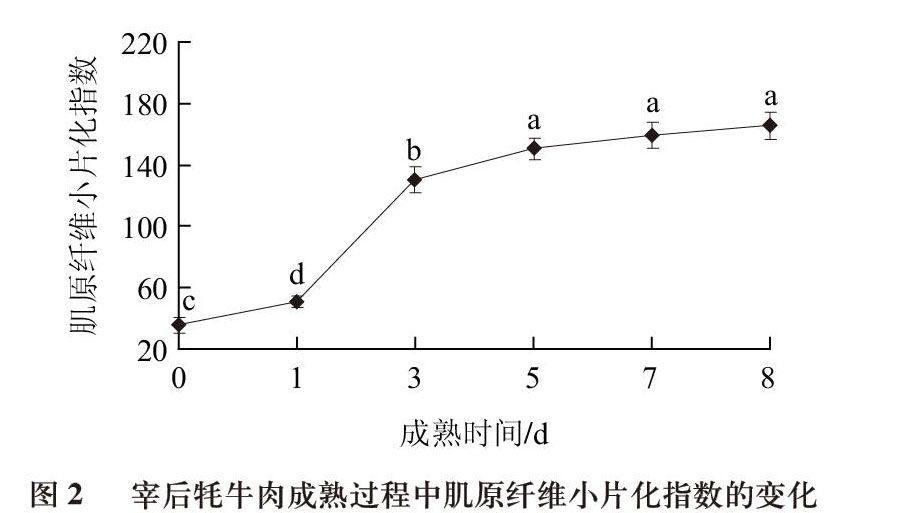
肌原纤维小片化指数是反映肌原纤维蛋白降解程度的有用标志,MFI值越大表明降解的越多,肉会变得越嫩[17]。从图2可以看出,肌原纤维小片化指数呈现显著增加的趋势,在前3d增加的速度较快,3d后增加的速度有所降低,成熟5d后不再发生显著变化。牦牛肉成熟过程中肌原纤维小片化指数的变化趋势与Watanabe等[18]的研究结果相一致。
2.2.3 肌纤维直径
图3反映了宰后牦牛肉成熟过程中,肌纤维直径的变化,在宰后0d时,肌纤维直径为48.23μm,随着成熟时间的延长,不断降低,前3d变化不显著,后5d明显降低,但是第7天与第8天差异不显著。
肌纤维直径是决定肉嫩度的重要因素,肌纤维越细,肌纤维密度越大,系水力越强,表现为肉质细嫩,在成熟过程中,由于肌纤维与肌内膜发生分离及汁液的流失,导致肌纤维直径下降[19]。
2.3 钙激活酶与嫩度指标的相关性
表2反映了宰后牦牛肉成熟过程中,μ-calpain、m-calpain、calpastatin 3种钙激活酶与剪切力、肌纖维直径、MFI 3个嫩度指标之间的相关性。从表2可以看出,μ-calpain、m-calpain、calpastatin与剪切力值、MFI均呈正相关性,但是,相关性不显著;3种酶均与肌原纤维小片化指数呈负相关,其中,μ-calpain与calpastatin呈显著负相关(P<0.05)。由此可以推断,钙激活酶活力的变化可能导致了肌原纤维小片化指数的增加,肌原纤维的弱化和肉的嫩化,μ-calpain可能是牦牛肉嫩化的主要贡献者。
3 结 论
3.1 宰后牦牛肉成熟过程中,μ-calpain与calpastatin的活力显著降低,m-calpain活力稍有降低;剪切力值先增大后减小,肌原纤维直径显著降低,MFI显著增加。
3.2 μ-calpain、m-calpain、calpastatin 3种酶与剪切力值及肌纤维直径均呈正相关,与肌原纤维小片化指数呈负相关,其中,μ-calpain与calpastatin呈显著负相关。因此,钙激活酶活力的变化可能导致了肌原纤维小片化指数的增加,肌原纤维的弱化和肉的嫩化,μ-calpain可能是牦牛肉嫩化的主要贡献者。
参考文献:
[1] MILLER M F, CARRM A, RAMSEY C B, et al. Consumer thresholds for establishing the value of beef tenderness[J]. Journal Animal Science, 2001, 79(12): 3062-3068.
[2] MORGAN J B, SAVELL J W, HALE D S, et al. National beef tenderness survey[J]. Journal Animal Science, 1991, 69(8): 3274-283.
[3] KEMP C M, SENSKY P L, BARDSLEY R G, et al. Tenderness-An enzymatic view[J]. Meat Science, 2010, 84(2): 248-256.
[4] KOOHMARAIE M, GEESINK G H. Contribution of postmortem muscle biochemistry to the delivery of consistent meat quality with particular focus on the calpain system[J]. Meat Science, 2006, 74(1): 34-43.
[5] WENDT A, THOMPSON V F, GOLL D E. Interaction of calpastatin with calpain: A review[J]. Biological Chemistry, 2004, 385(6): 465-472.
[6] 李诚, 谢婷, 付刚, 等. 猪肉宰后冷却成熟过程中嫩度指标的相关性研究[J]. 食品科学, 2009, 30(17): 163-166.
[7] 田甲春, 韩玲, 刘昕, 等. 牦牛肉宰后成熟机理与肉用品质研究[J]. 2012, 43(12): 146-150.
[8] 郭兆斌, 韩玲, 余群力. 牦牛肉成熟过程中肉用品质及结构变化特点[J]. 肉类研究, 2012, 26(2): 8-11.
[9] KRIESE P R, SOARES A L, GUARNIERI P D, et al. Biochemical and sensorial evaluation of intact and boned broiler breast meat tenderness during ageing[J]. Food Chemistry, 2007, 104(4): 1618-1621.
[10] 李鹏, 王存堂, 韩玲, 等. 甘南牦牛肉质特性和营养成分分析[J]. 食品科学,2010, 31(2): 414-416.
[11] DELGADO E F, GEESINK G H, MARCHELLO J A, et al. The calpain system in three muscles of normal and callipyge sheep[J]. Journal Animal Science, 2001, 79(2): 398-412.
[12] MORTON J D, BICKERSTAFFE R, KENT M P, et al. Calpain-calpastatin and toughness in M. longissimus from electrically stimulated lamb and beef carcasses[J]. Meat Science, 1999, 52(1): 71-79.
[13] GOLL D E, THOMPSON V F, LI H, et al. The calpain system[J]. Physiological Reviews, 2003, 83(3): 731-801.
[14] KOOHMARAIE M, SEIDEMAN S C, SCHOLLMEYER J E, et al. Effect of postmortem storage on Ca2+-dependent proteases, their inhibitor and myofibril fragmentation[J]. Meat Science, 1987, 19(3): 187-196.
[15] 周光宏. 肉品加工學[M]. 北京: 中国农业出版社, 2008.
[16] THOMAS A R, GONDOZA H, HOFFMAN L C, et al. The roles of the proteasome, and cathepsins B, L, H and D, in ostrich meat tenderization[J]. Meat Science, 2004, 67(1): 113-120.
[17] OLSON D G, PARRISH F C, STROMER M H. Myofibril fragmentation and shear resistance of three bovine muscles during post-mortem storage[J]. Journal of Food Science, 1976, 41(5): 1036-1041
[18] WATANABE A, DEVINE C. Effect of meat ultimate pH on rate of titin and nebulin degradation[J]. Meat Science, 1996, 42(4): 407-413.
[19] 徐舶. 花·马杂交Fl鹿肉的品质特性研究[D]. 南京: 南京农业大学, 2006.

