自发性脊髓硬膜外出血患者神经功能预后影响因素研究
金 铂,苏亦兵,张 岩,王汉斌,王科大
自发性脊髓硬膜外出血(spontaneous spinal epidural hematoma,SSEH)是一种较为罕见的疾病,它是指在没有明显脊椎外伤或手术的情况下出现的脊髓硬膜外自发性出血。1963年Jackson[1]首次发现此病,迄今为止全世界共有490余例相关报道。在所有脊髓硬膜外病变中,自发性出血的比例为0.3%~0.9%[2]。尽管发病率低,但如果未采取适当的治疗措施,将导致患者永久性脊髓神经功能障碍和丧失,严重影响患者的生活质量。目前,影响SSEH患者神经功能预后的相关因素仍未得到充分论证。本研究通过对我院18例手术治疗的SSEH患者进行回顾性分析,探讨SSEH患者神经功能预后的影响因素。
1 资料与方法
1.1 一般资料 选取2009年8月—2013年1月北京积水潭医院收治的18例因SSEH而接受外科手术的患者,均排除:(1)有明确脊柱外伤史者;(2)既往有脊柱、脊髓手术史者;(3)血肿位于脊髓内、硬脊膜下或蛛网膜下腔者。18例患者中,男11例,女7例;平均年龄为(40.1±14.6)岁;手术时间间隔(从起病到手术的时间)为5.5~165.0 h。
1.2 方法 18例患者的手术均由两名临床经验丰富的神经外科医师进行。回顾性分析患者的临床症状、影像学资料以及手术方法。统计患者的年龄、性别、术前与术后的神经功能状况、脊髓受压程度、血肿位置和范围以及手术时间间隔。
1.2.1 不同神经功能状况患者的神经功能恢复率的比较 按照日本骨科科学协会(JOA)脊髓功能评分表[3]对患者进行神经功能状况评价。依据术前JOA评分,将患者分为神经功能完全丧失组(JOA评分=0分,6例)和神经功能未完全丧失组(JOA评分>0分,12例)。比较两组患者术后的神经功能恢复率,公式如下:

1.2.2 不同手术时间间隔患者的神经功能恢复率的比较 依据手术时间间隔,将患者分为3组:<12 h组(7例)、12~24 h组(3例)和>24 h组(8例)。比较3组患者术后的神经功能恢复率。
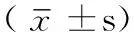
2 结果
2.1 回顾性分析结果
2.1.1 临床症状 18例患者中,4例出现单纯急性背部疼痛,14例除疼痛外还伴有不同程度的肌力下降以及病变平面以下的深、浅感觉障碍,其中8例还出现大、小便功能障碍。
2.1.2 影像学检查 18例患者均行MRI检查。在MRI的矢状位上,以血肿最大直径和椎管直径之间的关系来评估脊髓受压情况。血肿位置在MRI的矢状位像上分为颈段、颈胸段、胸段、胸腰段和腰段。在MRI的轴位像上将血肿分为腹侧、背侧和后外侧。16例患者的血肿范围超过2个椎体水平,只有2例患者局限于1个椎体水平。血肿的平均分布范围是1~5个椎体水平。4例颈段血肿,2例颈胸段血肿,7例胸段血肿,1例胸腰段血肿,4例腰段血肿。12例背侧血肿,3例腹侧血肿以及3例背/腹外侧血肿。血肿对脊髓压迫的程度为23.3%~81.1%,平均为(50.4±14.2)%(见表1)。血肿在T1和T2加权像为混杂信号。17例患者的血肿呈纺锤状,1例患者的血肿形状不规则;2例合并脊髓水肿。
2.1.3 手术方法 全麻满意后,患者取俯卧位,采用后正中入路。依据MRI上血肿的位置,定位相应椎体节段,以咬骨钳咬除相应椎体的棘突及部分椎板,充分暴露血肿后,留取部分病变组织送病理检查,其余血肿予以清除,达到脊髓充分减压。18例患者棘突均不复位,均未行内固定术。术后无一例死亡,也未出现感染、脑脊液漏等并发症。
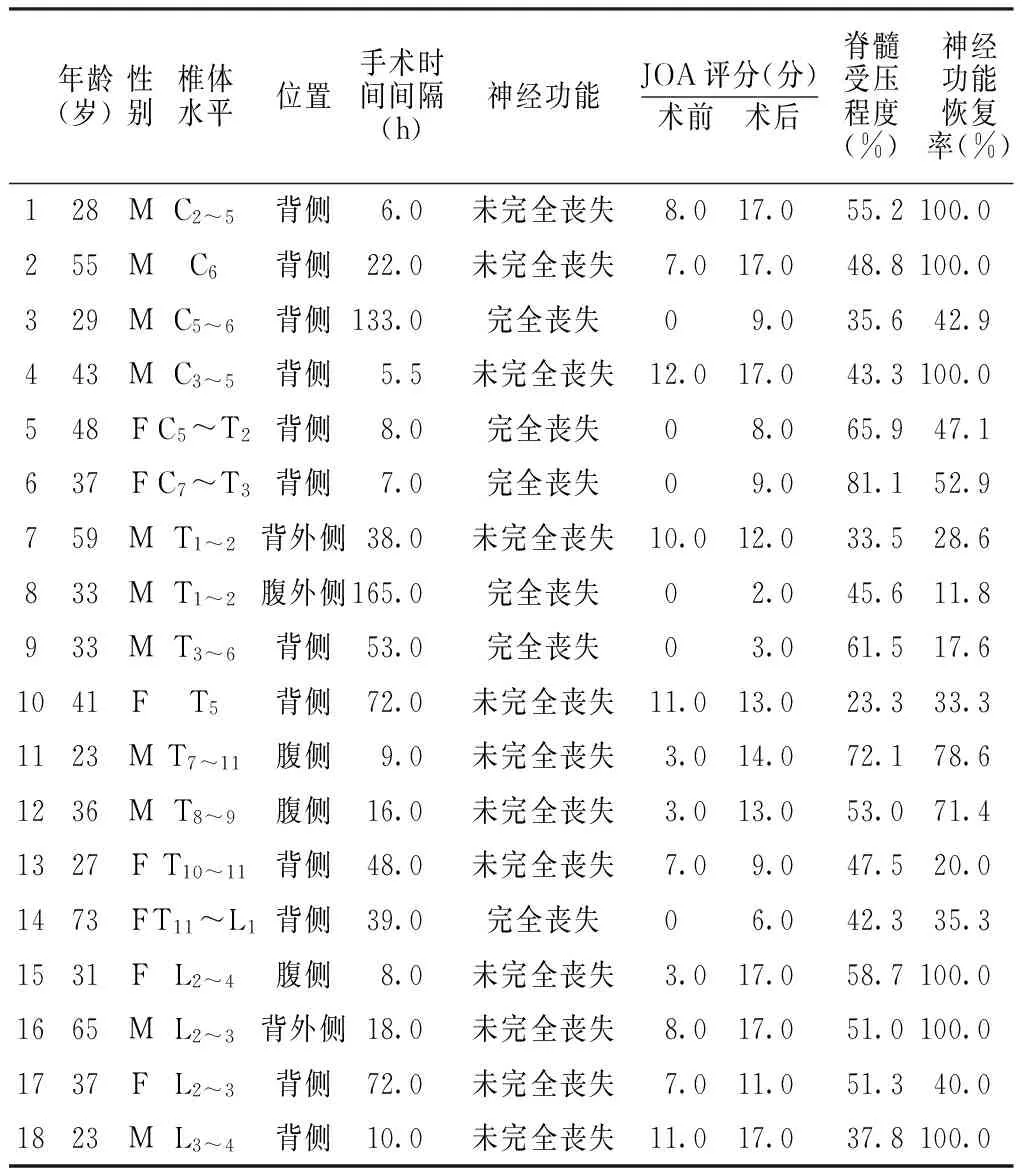
表1 18例SSEH患者的临床资料
注:M=男性,F=女性,JOA=日本骨科科学协会
2.2 不同神经功能状况的患者神经功能恢复率比较 18例患者术前、术后JOA评分分别为(5.0±4.5)分和(11.7±4.9)分,差异有统计学意义(t=7.645,P<0.01)。患者神经功能恢复率为20.0%~100.0%,平均为(60.0±33.4)%。神经功能完全丧失组、神经功能未完全丧失组患者术后神经功能恢复率分别为(34.6±14.5)%和(72.7±32.8)%,差异有统计学意义(t=6.832,P<0.01)。
2.3 不同手术时间间隔的患者神经功能恢复率比较 <12 h组患者术后神经功能恢复率为(82.7±23.7)%,其中4例神经功能完全恢复;12~24 h组患者术后神经功能恢复率为(90.5±16.5)%,其中2例神经功能完全恢复;>24 h组患者术后神经功能恢复率为(28.7±11.2)%,无一例神经功能完全恢复。3组患者术后神经功能恢复率比较,差异有统计学意义(F=22.253,P<0.01);其中>24 h组患者术后神经功能恢复率与<12 h组、12~24 h组比较,差异均有统计学意义(P<0.01);而<12 h组与12~24 h组比较,差异无统计学意义(P>0.05)。
3 讨论
SSEH的发生率很低,但一旦发生,便会导致严重的神经功能障碍。SSEH的临床症状通常是初期急性的局部剧烈疼痛且常伴有神经根性感觉异常。在数分钟或数小时内,大部分患者会出现脊髓受压症状,表现为进行性肢体瘫痪、深浅感觉丧失以及大小便功能障碍。症状和体征出现的时间从数分钟到数小时不等。利用MRI可以很快做出诊断,并且从图像上非常清晰地看到血肿位置、范围以及脊髓受压情况。尽管术前做出诊断并不困难,但是SSEH患者的预后却并不乐观,而且关于预后的影响因素尚无统一认识。
3.1 手术治疗对患者术后神经功能恢复率的影响 一些学者报道,保守治疗SSEH是有效的;但也有学者提出,SSEH的标准治疗是快速诊断和外科手术清除血肿[4]。本组患者大多出现严重的进行性神经功能恶化,故均需外科手术治疗。患者术后JOA评分高于术前,提示术后的神经功能较术前提高。故认为手术减压将会减少因压迫而产生的脊髓缺血和水肿,并减少随之而来的神经元再损伤,及时、合理的手术治疗是促进SSEH患者康复的因素之一。
3.2 术前神经功能状况对神经功能预后的影响 Lo等[5]报道患者术前的神经功能状况是影响预后的重要因素。Hsieh等[6]报道,术前神经功能完全丧失的患者中,有45.3%可以恢复到正常,但是术前神经功能未完全丧失的患者恢复正常的比例可以达到95%。本研究结果显示,术前神经功能未完全丧失组患者术后神经功能恢复率显著高于神经功能完全丧失组,术前神经功能完全丧失组无一例患者术后神经功能完全恢复。因此,我们认为术前神经功能状况也是影响术后神经功能预后的重要因素。术前神经功能评分代表脊髓受损程度,一旦发生神经元的不可逆损伤,即便予以手术减压,其神经功能也难以得到满意的恢复。所以外科手术应该在神经功能完全丧失前进行。
3.3 手术时间间隔对神经功能预后的影响 大多数学者认为手术时间间隔是影响神经功能预后的重要因素之一[7]。然而,也有学者认为手术减压的时间与神经功能预后无关系[8]。目前,对SSEH患者脊髓减压的时间间隔尚存争议。Grollmus等[9]报道,如果手术在8 h内进行,患者的预后最好;Sung等[10]报道,如果手术在24 h内进行,50%的患者瘫痪症状可以缓解;Sarubbo等[11]报道,若患者在出现症状36 h内还未接受手术减压,常预后欠佳。另有多项研究报道,术前神经功能未完全丧失的患者在36 h内接受手术以及术前神经功能完全丧失的患者在48 h内接受手术,其神经功能恢复是良好的[12-14]。本研究结果显示,手术时间间隔<12 h和12~24 h的患者,术后神经功能恢复率均高于手术时间间隔>24 h的患者。故若想取得神经功能的良好预后,在24 h内进行手术是必要的,尤其是神经功能未完全丧失的患者如果在12 h内进行手术,其神经功能可能完全恢复到正常水平。相对而言,神经功能完全丧失的患者即便在12 h内接受手术,也几乎没有完全恢复的可能。换言之,若想取得良好的预后,就要在神经功能完全丧失前尽早进行有效的手术减压。
手术改善神经功能预后的机制可以通过脊髓损伤动物模型来了解。Mazensky等[15]发现兔子脊髓受压会引起神经纤维、血管内皮和微循环的巨大改变。压力会导致出血,髓鞘和轴突周围出现坏死和水肿。脊髓受压时间越长,引起损伤的范围越大,这被称为继发损伤。我们推测,脊髓受压12 h内的早期减压会降低脊髓缺血的发生率,因此神经功能的恢复是完全的。然而,如果脊髓持续受压并且超过24 h,将会发生继发损害,脊髓功能将不能恢复到正常水平。
总之,SSEH有神经功能进行性恶化的趋势。患者术前神经功能状况以及接受手术的时间间隔是影响预后的重要因素。因此,在尽可能短的时间内、在患者脊髓神经功能完全丧失之前进行有效的外科手术减压,是取得良好预后的保证。
1 Jackson FE.Spontaneous spinal epidural hematoma coincident with whooping cough.Case Report[J].J Neurosurg,1963,20(4):715-717.
2 Vitali AM,Steinbok P.Spontaneous spinal epidural hematoma following weight lifting[J].Can J Neurol Sci,2008,35(2):262-264.
3 Fukui M,Chiba K,Kawakami M,et al.JOA Back Pain Evaluation Questionnaire(JOABPEQ)/JOA Cervical Myelopathy Evaluation Questionnaire(JOACMEQ).The report on the development of revised versions.April 16,2007[J].J Orthop Sci,2009,14(3):348-365.
4 Qiu W,Sun W,Guo C,et al.Diagnosis and microsurgery of symptomatic spontaneous spinal epidural hematoma[J].Ir J Med Sci,2011,180(1):241-245.
5 Lo MD.Spinal cord injury from spontaneous epidural hematoma:report of 2 cases[J].Pediatr Emerg Care,2010,26(6):445-447.
6 Hsieh CF,Lin HJ,Chen KT,et al.Acute spontaneous cervical spinal epidural hematoma with hemiparesis as the initial presentation[J].Eur J Emerg Med,2006,13(1):36-38.
7 Sirin S,Arslan E,Yasar S,et al.Is spontaneous spinal epidural hematoma in elderly patients an emergency surgical case?[J].Turk Neurosurg,2010,20(4):557-560.
8 Kunizawa A,Fujioka M,Suzuki S,et al.Spontaneous spinal epidural hematoma inducing acute anterior spinal cord syndrome[J].J Neurosurg Spine,2009,10(6):574-577.
9 Grollmus J,J Hoff.Spontaneous spinal epidural haemorrhage:good results after early treatment[J].J Neurol Neurosurg Psychiatry,1975,38(1):89-90.
10 Sung JH,Hong JT,Son BC,et al.Clopidogrel-induced spontaneous spinal epidural hematoma[J].J Korean Med Sci,2007,22(3):577-579.
11 Sarubbo S,Garofano F,Maida G,et al.Spontaneous and idiopathic chronic spinal epidural hematoma: two case reports and review of the literature[J].Eur Spine J,2009,18(11):1055-1061.
12 Ko JI,Kim T,Jwa CS,et al.Spontaneous spinal epidural hematoma and Brown-Sequard syndrome[J].Rev Neurol,2009,48(7):374-375.
13 Liu WH,Hsieh CT,Chiang YH,et al.Spontaneous spinal epidural hematoma of thoracic spine:a rare case report and review of literature[J].Am J Emerg Med,2008,26(3):384.e1-2.
14 Matsubara S,Inoue H,Takamura K,et al.Spontaneous spinal epidural hematoma at the 16th week of a twin pregnancy[J].J Obstet Gynaecol Res,2011,28(6):411-413.
15 Mazensky D,Radonak J,Danko J,et al.Anatomical study of blood supply to the spinal cord in the rabbit[J].Spinal Cord,2011,49(4):525-528.

