血清缺氧诱导因子1α与2型糖尿病肾病的相关性分析
刘云涛,简 磊,李建伟
缺氧诱导因子1α(HIF-1α)是缺氧状态下特异性发挥活性的核转录因子,可调控一系列靶基因的表达,具有许多重要的生物学效应。已发现其在糖尿病大鼠肾脏中表达增加,而减少HIF-1α的表达可减少糖尿病大鼠尿蛋白,降低肌酐水平,改善肾功能,抑制肾间质纤维化从而保护肾脏[1-2]。本研究测定2型糖尿病(T2DM)及糖尿病肾病(DN)患者空腹血清HIF-1α水平,旨在了解其与T2DM及DN的相关性及影响因素,为T2DM微血管病变的防治提供新的理论依据。
1 对象与方法
1.1研究对象选择2011年11月—2013年1月我院门诊、肾内科、内分泌科门诊及住院部患者、体检中心体检者为研究对象。健康体检者46例为对照组(NC组),口服葡萄糖耐量试验(OGTT)排除T2DM,平均年龄为(58±7)岁,男25例,女21例。1年之内新诊断的单纯T2DM(SDM组)45例,男26例,女19例,平均年龄为(54±7)岁。早期DN组(EDN组)44例,平均年龄为(55±7)岁,男24例,女20例,20 μg/min≤尿清蛋白排泄率(UAER)≤200 μg/min。临床DN组(CDN组)43例,平均年龄为(58±7)岁,男24例,女19例,UAER>200 μg/min。所有T2DM患者均符合1999年WHO对T2DM的诊断标准[3],未给予降糖药物及其他药物治疗。入选者均排除1型糖尿病、特殊类型糖尿病,排除心脏、肝脏疾病,及肿瘤、感染、其他类型肾病。在3个月内未发生糖尿病酮症酸中毒及其他急性并发症。
1.2研究方法
1.2.1相关生化指标测定受试者禁食8 h后于清晨抽取空腹肘静脉血测空腹血糖(FPG)、血脂、糖化血红蛋白(HbA1c)。HbA1c采用日本ARKRAY HA8160糖化血红蛋白分析仪及其配套试剂检测;FPG、肾功能、血脂、UAER使用美国雅培ARCHITECT C8000全自动生化分析仪检测。超氧化物歧化酶(SOD)测试盒由南京建成生物研究所提供,采用羟胺法测定。类胰岛素样生长因子-1(IGF-1)采用酶联免疫吸附(ELISA)法测定,使用美国DSL公司试剂盒。胰岛素使用德国罗氏Cobas e411全自动电化学发光分析仪检测。高敏C反应蛋白(hs-CRP)采用韩国Bodi Tech Med免疫荧光分析仪通过免疫荧光干式定量法检测。
1.2.2HIF-1α测定所有研究对象取空腹血样,3 800×g离心10 min,分离血清,放置于-40 ℃冰箱低温保存待检,测定采用ELISA法,试剂盒购自上海江莱生物科技有限公司。
2 结果
2.1一般临床资料和临床生化指标的比较4组间性别、年龄差异无统计学意义(P>0.05);CDN组血尿素氮(BUN)、血清肌酐(Scr)、hs-CRP、UAER高于SDM、EDN及NC组,差异有统计学意义(P<0.05);CDN组收缩压、舒张压、三酰甘油(TG)、血清总胆固醇(TC)、低密度脂蛋白(LDL)高于NC组,差异有统计学意义(P<0.05);SDM组、EDN组、CDN组FPG、HbA1c、IGF-1高于NC组,差异有统计学意义(P<0.05);EDN组、CDN组高密度脂蛋白(HDL)低于NC组,差异有统计学意义(P<0.05); EDN组、CDN组UAER、病程高于SDM组,差异有统计学意义(P<0.05)。4组血清HIF-1α水平差异有统计学意义(P<0.05)。见表 1。

表1 NC组、SDM组、EDN组、CDN组相关指标比较
注:▽为χ2值,余检验统计量值为F值;与NC组比较,*P<0.05,○P<0.01;与SDM组比较,△P<0.05,●P<0.01;与EDN组比较,▲P<0.05,■P<0.01; BUN=血尿素氮,Scr=血清肌酐,TG=三酰甘油,TC=血清总胆固醇,IGF-1=类胰岛素样生长因子-1,LDL=低密度脂蛋白,HDL=高密度脂蛋白,FPG=空腹血糖,HbA1c=糖化血红蛋白,hs-CRP=超敏C反应蛋白,SOD=超氧化物歧化酶,UAER=尿清蛋白排泄率,VEGF=血管内皮生长因子,HIF-1α=缺氧诱导因子1α;-为无
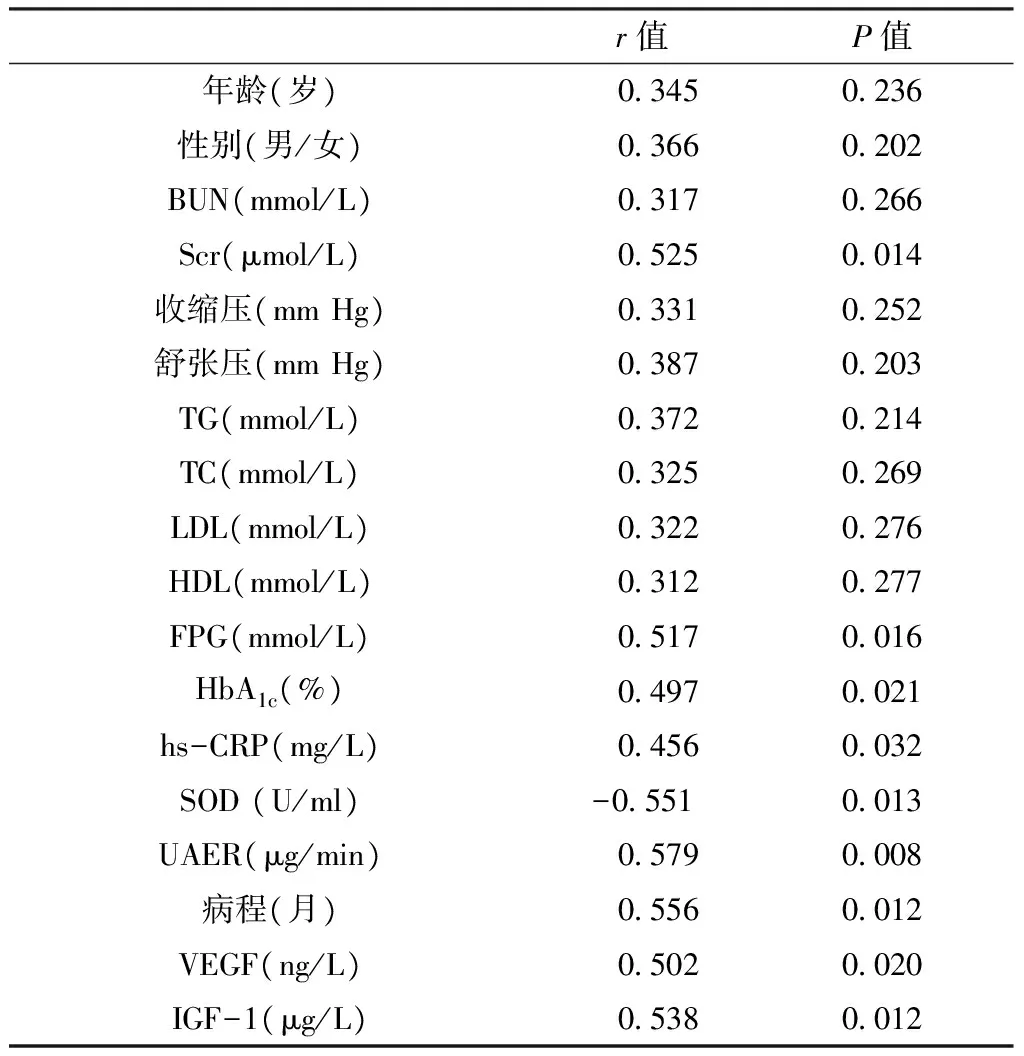
2.2相关性分析血清HIF-1α水平与FPG、HbA1c、IGF-1、hs-CRP、UAER、Scr、病程呈正相关,与SOD呈负相关,见表2。
2.3回归分析多元逐步回归分析结果显示,HbA1c、SOD、HIF-1α、VEGF的回归系数分别为4.062、-1.132、0.413、0.128,建立以下模型:UAER=4.062×HbA1c-1.132×SOD+0.413×HIF-1α+0.128×VEGF+11.578(见表3)。
表2血清HIF-1α水平与其他观察指标的相关分析
Table2Correlation analysis between HIF-1α and other indexes
r值P值年龄(岁) 03450236性别(男/女) 03660202BUN(mmol/L) 03170266Scr(μmol/L) 05250014收缩压(mmHg) 03310252舒张压(mmHg) 03870203TG(mmol/L) 03720214TC(mmol/L) 03250269LDL(mmol/L) 03220276HDL(mmol/L) 03120277FPG(mmol/L) 05170016HbA1c(%) 04970021hs-CRP(mg/L) 04560032SOD(U/ml)-05510013UAER(μg/min) 05790008病程(月) 05560012VEGF(ng/L) 05020020IGF-1(μg/L) 05380012

表3 UAER影响因素的多元逐步回归分析
3 讨论
在氧浓度正常时,HIF-1α在细胞内的表达量维持在较低水平,当氧分压下降时,HIF-1α在胞质内表达增高,DNA结合活性也相应增强。本研究发现,SDM组、EDN组、CDN组HIF-1α高于NC组,且HIF-1α与FPG、HbA1c呈正相关,这可能与血糖、HbA1c增高,2,3-二磷酸甘油(2,3-DPG)水平降低,组织缺氧有关。
已发现糖尿病早期出现肾小球肥大,肾小球滤过率高,同时伴有肾内IGF-l的增加,IGF-1可作用于肾小球足细胞,导致糖尿病大鼠肾脏增生、高滤过,促进DN的发生[4]。而新近研究发现IGF-1可增加HIF-1α水平[5],本研究也发现HIF-1α水平与IGF-1呈正相关,进一步证实HIF-1α水平与IGF-1关系密切,可能是IGF-1通过HIF-1α在DN中发挥了作用,值得深入研究。
缺氧是氧化应激的重要诱发因素,而氧化应激对DN的发生发展起到了重要促进作用,目前HIF-1α在氧化应激中的作用尚不明确。Ma等[6]发现SOD活性增加可能与抑制HIF-1α有关,这说明低水平的HIF-1α有利于减轻氧化应激。颜晓勇等[7]研究发现HIF-1α上调能够诱导糖尿病大鼠肾小球及肾小管细胞凋亡增加,从而促进DN的进展,这可能与氧化应激有关。但HIF-1α作为核转录因子参与机体内许多低氧反应基因的调节,对缺氧的细胞起稳定作用,增强细胞对缺氧的适应能力[8]。本研究发现HIF-1α与SOD呈负相关,更进一步证明其与氧化应激关系密切。本研究认为,HIF-1α在DN中的高表达起两方面作用:一方面增强细胞对缺氧环境的适应能力,对保护肾脏组织和细胞免受缺氧损伤具有积极的作用;另一方面,它诱导肾小球及肾小管细胞凋亡增加,促进DN发展,而这一作用可能与氧化应激有关。HIF-1α与氧化应激的关系值得进一步研究,适度减少HIF-1α的表达可能对于DN的防治具有重要意义。已证实,HIF-1α是缺氧与慢性炎症之间的重要环节,在炎症中发挥了重要作用[9]。研究发现,DN大鼠HIF-1α的表达与肾脏肥大指数和肾小球体积呈正相关[10],并且HIF-1α导致细胞增生肥大的作用与炎症密切相关[11]。本研究发现HIF-1α与hs-CRP呈正相关,进一步证实其与炎症关系密切,可能HIF-1α在炎症存在的情况下对DN发挥了重要作用。
HIF-1α与 VEGF关系密切,HIF-1α可增加 VEGF的表达,可能是VEGF的上游调控器[12]。而在DN早期即有VEGF增加并沉积于足细胞及系膜细胞,导致肾小球通透性增高、肾小球基底膜增厚,尿蛋白增加,而抑制VEGF上述情况可得到改善[13]。本研究发现HIF-1α与VEGF呈正相关,说明HIF-1α与VEGF关系密切。本研究中,随着HIF-1α与VEGF水平增高,DN加重,进一步证实HIF-1α、VEGF在DN中发挥了重要作用。动物实验证实,糖尿病大鼠肾小球及肾小管HIF-1α的表达随着造模时间的延长而逐渐增加[14]。本研究也发现随着DN的进展及病程延长,HIF-1α逐渐增高,与病程呈正相关。这可能与随着病情的发展,血糖和HbA1c的增高、IGF-1增加、炎症加重等有关。本研究发现HIF-1α与UAER、Scr呈正相关,并且回归分析显示HIF-1α是UAER的独立影响因素,进一步证实其在DN中发挥了重要作用。
总之,本研究证实,HIF-1α在氧化应激、炎症中发挥重要作用,与IGF-1、VEGF、血糖、HbA1c等相关,并且其血清水平与T2DM肾病的严重程度相关,深入探讨HIF-1α水平变化及影响因素将为2型DN的防治提供新的思路。
1Tang L,Yi R,Yang B,et al.Valsartan inhibited HIF-1α pathway and attenuated renal interstitial fibrosis in streptozotocin-diabetic rats[J].Diabetes Res Clin Pract,2012,97(1):125-131.
2Xu X,Chen P,Zheng Q,et al.Effect of pioglitazone on diabetic nephropathy and expression of HIF-1α and VEGF in the renal tissues of type 2 diabetic rats[J].Diabetes Res Clin Pract,2011,93(1):63-69.
3 世界卫生组织.2型糖尿病诊断标准[Z].1999.
4Kumar PA,Brosius FC 3rd,Menon RK.The glomerular podocyte as a target of growth hormone action:Implications for the pathogenesis of diabetic nephropathy[J].Curr Diabetes Rev,2011,7(1):50-55.
5Sartori-Cintra AR,Mara CS,et al.Regulation of hypoxia-inducible factor-1α(HIF-1α) expression by interleukin-1β(IL-1β),insulin-like growth factors I (IGF-I) and II (IGF-II) in human osteoarthritic chondrocytes [J].Clinics(Sao Paulo),2012,67(1):35-40.
6Ma L,Zhao Y,Li B,et al.3,5,4′-Tri-O-acetylresveratrol attenuates seawater aspiration-induced lung injury by inhibiting activation of nuclear factor-kappa B and hypoxia-inducible factor-1α[J].Respir Physiol Neurobiol,2012,185(3):608-614.
7颜晓勇,陆清竹,吴蔚桦,等.早期糖尿病大鼠肾脏中HIF-1α表达和细胞凋亡的研究[J].天津医药,2011,39(10):951-954.
8Nangaku M,Nishi H,Miyata T.Role of chronic hypoxia and hypoxia inducible factor in kidney disease [J].Chin Med J,2008,121(3):257-264.
9Shay JE,Celeste Simon M.Hypoxia-inducible factors:Crosstalk between inflammation and metabolism[J].Semin Cell Dev Biol,2012,23(4):389-394.
10黄贤珍,唐俊,杨亦彬.缺氧诱导因子1和血红素氧化酶1在糖尿病鼠肾组织的表达及意义[J].中国糖尿病杂志,2010,18(9):707-709.
11Kim HJ,Park JW,Cho YS,et al.Pathogenic role of HIF-1α in prostate hyperplasia in the presence of chronic inflammation[J].Biochim Biophys Acta,2013,1832(1):183-194.
12Tang L,Yi R,Yang B,et al.Valsartan inhibited HIF-1α pathway and attenuated renal interstitial fibrosis in streptozotocin-diabetic rats[J].Diabetes Res Clin Pract,2012,97(1):125-131.
13Karalliedde J,Gnudi L.Endothelial factors and diabetic nephropathy[J].Diabetes Care,2011,34(Suppl2):291-296.
14徐静,张春虹,王俊红,等.缺氧诱导因子-1α及促红素在糖尿病大鼠肾组织的表达[J].西安交通大学学报:医学版,2013,42(1):77-80.

