系统性红斑狼疮患者树突状细胞对Th1/Th2细胞分化的影响
周红娟 施华萍 蔡龙 郑红霞 马纪林 陶筱娟
系统性红斑狼疮患者树突状细胞对Th1/Th2细胞分化的影响
周红娟 施华萍 蔡龙 郑红霞 马纪林 陶筱娟
目的 探讨系统性红斑狼狼疮(SLE)患者树突状细胞对Th1/Th2细胞亚群分化的影响。方法淋巴细胞分离液分离获得SLE患者外周血单个核细胞,免疫磁珠阳性分选CD14细胞,联合应用rhGM-CSF、rhIL-4和rhTNF-α诱导分化树突状细胞成熟。在培养的第9天,流式细胞术检测表型,细胞增殖/毒性剂盒分析树突状细胞刺激同种异体淋巴细胞增殖的能力。ELISA法检测培养上清液中IL-12和IL-10的表达。诱导的成熟树突状细胞与健康对照组淋巴细胞共培养5d后,佛波酯+离子霉素+莫能霉素刺激培养4h,进行T淋巴细胞表面抗原及胞质内细胞因子染色,流式细胞仪检测Th1、Th2的比例。结果SLE患者诱导培养的树突状细胞其CD1a的表达降低(P<0.05),HLA-DR、CD80、CD86的表达均明显升高(P<0.05)。活动组与非活动组的树突状细胞HLA-DR、CD80、CD86的表达有统计学差异(P<0.05)。SLE患者诱导培养的树突状细胞刺激同种异体淋巴细胞增殖能力增强(P<0.05)。活动组与非活动组的树突状细胞刺激同种异体淋巴细胞也有所差异(P<0.05)。SLE患者诱导培养的树突状细胞分泌IL-12的水平均明显降低(P<0.05);分泌IL-10的水平明显升高(P<0.01),活动组与非活动组的树突状细胞分泌IL-12和IL-10的水平差异无统计学意义(P>0.05)。活动组的树突状细胞与对照组淋巴细胞共培养后Th1的比例明显降低(P<0.01),Th2的比例差异无统计学意义(P>0.05)。结论SLE患者诱导的树突状细胞表型增加,刺激同种异体淋巴细胞增殖的能力增强,分泌IL-12降低,IL-10升高。SLE患者树突状细胞功能的异常可能导致了Th1细胞分化不足,在SLE发生、发展过程中起重要作用。
系统性红斑狼疮 树突状细胞 Th1/Th2


【 Abstract】 ObjectiveTo investigate the effect o f dendritic cells(DC)on Th1/Th2differentiation in patients with systemic lupus erythematosus(SLE).MethodsPeripheral blood mononuclear cells(PBMC)were isolated and purified by a high gradient magnetic cell sorting system(MACS).GM-CSF,IL-4 and TNF-α were used to induce matured DCs,the phenotype of DCs was analyzed by immunofluorescence staining and flow cytometry 9d after induction.The ability of inducing proliferation of allogenic lymphocytes was examined by cell counting Kit-8(CCK-8).The production of IL-12 and IL-10 by the induced mature DCs were measured by ELISA.The lymphocytes in PBMC were separated by the adherent method,and were co-cultured with the matured DC from SLE patients.After 5 days,CD4+T cells were stimulated with PMA+ionomycin+monensin and the differentiation of Th1/Th2cells was detected by flow cytometry using intracellular fluorescent staining of IFN-γ and IL-4.ResultsThe expresses of CD80,CD86 and HLA-DR in DCs from SLE patients were increased(P<0.05),that of CD1a was decreased(P<0.05).There were significant differences in expression of HLA-DR,CD80,CD86 and ability of inducing allogenic lymphocytes proliferation between active and inactive cases(P<0.05).The levels of IL-12 were reduced and IL-10 increased significantly in the induced mature DCs from SLE patients.There was no significant difference between active and inactive cases.In comparison to health controls, the percentage of Th1cells in CD4+T was lower when co-cultured with the matured DC from SLE patients.ConclusionThe results indicate that Th1cell differentiation is impaired in patients with SLE,which may be associated with the dysfunctions of dendritic cells.
系统性红斑狼疮(SLE)免疫紊乱表现在T、B细胞高度活化增生,大量自身抗体产生,最终形成免疫复合物沉积于组织中,Th1/Th2细胞比例失调,细胞因子异常等[1]。但最根本的环节是机体对自身抗原的耐受遭到破坏,或机体免疫系统过度递呈自身抗原,致使初始型T细胞发展为反应性T细胞,导致自身免疫性疾病的发生。树突状细胞被认为是目前所知功能最强的专职抗原递呈细胞,能选择性诱导Th0向Th1或Th2分化,从而调控T淋巴细胞免疫应答的类型[2]。本研究通过观察SLE患者外周血中的树突状细胞的表型、功能以及对Th1/ Th2分化的影响,对两者之间的关系进行初步探讨,为SLE的免疫治疗提供方法和策略。
1 对象和方法
1.1 对象 选择2011-01—2011-12我院风湿免疫肾病科门诊和住院的SLE患者20例,均符合1997美国风湿病学会制定的SLE诊断标准。以SLE疾病活动指数(SLEDAI)积分来判断疾病活动程度。其中男2例,女18例,年龄15~49(33±9)岁;按SLEDAI≥6分为界限,将SLE患者分为活动组和非活动组,两组SLEDAI积分(9.0±2.9、3.2±1.8)差异有统计学意义(P<0.01)。选择我院体检的性别、年龄相匹配的健康志愿者10例为对照组,其中男1例,女9例,年龄19~45(34±13)岁。本研究遵循伦理学标准,并得到本院伦理委员会批准,所有受试者均签署知情同意书。
1.2 试剂和仪器 RPMI 1640,胎牛血清(FBS)为美国GIBICO公司产品;Ficoll400为美国USBiological公司产品;CD14磁珠分选试剂盒(人)为德国Miltenyibiotec公司产品;重组细胞因子rhGM-CSF、rhIL-4、rhTNF-α购自美国 PeproTech公司;PE标记的 CD83、CD86、HLA-DR和FITC标记的CD14、CD1a、CD80及同型对照,IL-12、IL-10 ELISA试剂盒,功能级纯化的抗CD3和抗CD28购于美国Ebioscience公司;CCK-8试剂盒为上海碧云天生物技术有限公司产品。PE-Cy5标记的CD3、PE-TR标记的CD8、FITC标记的IFN-γ、R-PE标记的IL-4和FIX&PERM破膜剂为美国Invitrogen公司产品。流式细胞仪为Beckman coulter公司产品,型号为EPICS-XL。
1.3 方法
1.3.1 CD14+单核细胞收集及树突状细胞的体外诱导抽取SLE患者、健康志愿者静脉血20ml,肝素抗凝,用Ficoll淋巴细胞分离液提取PBMC,按CD14磁珠分选试剂盒说明书分选CD14细胞。分选后流式分析CD14细胞的纯度,结果显示其达到90%左右。
将各组CD14+细胞按1×106/ml接种于24孔板,每孔用1ml含10%胎牛血清,100U/ml青霉素和100U/ml链霉素的RPMI 1640完全培养基培养,并加诱导因子rhGM-GSF(1 000U/ml)、rhIL-4(500U/ml),5%CO2,37℃条件下培养。第3天半量换液。6d后更换等量的含有rhTNF-α(1 000U/ml)的完全培养基,3d后可获得成熟的树突状细胞。
1.3.2 树突状细胞表型的检测 收集诱导培养的SLE患者、对照组的树突状细胞,分别计数2×105个细胞置流式管中,分别加入PE或FITC标记的抗人CD1a、CD83、CD80、CD86、HLA-DR单克隆抗体,常温下染色20 min,洗涤,500 μl PBS重悬,上流式细胞仪测定细胞表面CD1a、CD80、CD86、CD83及HLA-DR的表达水平。
1.3.3 淋巴细胞增殖情况的测定 晨起抽取健康志愿者静脉血10ml,肝素抗凝,用Ficoll淋巴细胞分离液提取PBMC,细胞贴壁法获取淋巴细胞作为效应细胞,按2×105/孔接种于96孔板,将1.3.1收获的成熟树突状细胞作为刺激细胞,按照树突状细胞∶淋巴细胞为1∶10,1∶20,1∶50,1∶100这4种比例接种,同时设置调零孔(只加完全培养基)和阴性对照(不加树突状细胞),每组设定3复孔。共同培养72h后,每孔加入10μl CCK-8溶液,孵育2h,上酶标仪检测,在波长490 nm处测定各孔的光密度值(OD值),以空白孔调零。计算刺激指数(SI)表示增殖情况:SI=实验孔OD490/阴性对照孔OD490。
1.3.4 培养上清液中细胞因子水平的检测 收集第9天树突状细胞培养上清液,按ELISA Kit操作步骤检测各组树突状细胞培养上清液中IL-12、IL-10的水平。
1.3.5 树突状细胞对Th1、Th2分化影响的检测 收集1.3.3剩余的健康对照组淋巴细胞,计数待用。将1.3.1诱导的成熟树突状细胞以1∶1与健康对照组淋巴细胞混合,每孔细胞总数为1×106/ml细胞(同时设置空白对照组,不加成熟的树突状细胞细胞)加入到预先包被功能级的抗CD3(10μg/ml)的24孔板中,同时加入功能级的抗CD28 2μg/ml,TGF-β15ng/ml的完全培养基,培养5d。若诱导为Th1细胞,培养基中加入IFN-γ(10μg/ml),若诱导为Th2细胞,培养基中加入IL-4(10μg/ml)。
细胞共培养5d后,每孔加入无血清的RPMI 1640液1ml(含PMA 1μg/ml+离子霉素50μg/ml),进行刺激培养,并加莫能霉素(0.1mg/ml)。培养4h后进行T淋巴细胞表面抗原及胞质内细胞因子染色的检测:加入20μl CD3-TC和20μl CD8-PE-TR,避光孵育15min。每管中加入100μl Fix&Perm中的试剂A(即固定液),避光孵育15min。PBS洗涤后,分成2管,每管中加入100μl Fix&Perm中的试剂B(即破膜和溶血液),同时加入相应的抗体各10μl:IFN-γ-FITC+IL-4-PE,室温避光孵育15min,同时设立同型对照管。PBS洗涤后,500μl PBS重悬细胞,上机检测。以CD3+设门,分析CD8-IFN-γ+和CD8-IL-4+细胞所占的比例,CD3+CD8-IFN-γ+为Th1细胞,CD3+CD8-IL-4+为Th2细胞。以CD3+细胞设门,分析CD69+细胞占CD3+细胞的百分率。要求激活对照阳性率与胞内染色对照阳性率均>95%。
1.4 统计学处理 采用SPSS13.0统计软件,计量资料以表示,组间比较采用t检验,计数资料比较采用χ2检验。
2 结果
2.1 各组树突状细胞的表型 在倒置显微镜下观察,培养24h后大部分细胞仍贴壁生长并成簇排列,呈圆形,细胞膜光滑无突起。培养72h后,细胞的形态出现不规则,悬浮细胞逐渐增多,细胞伸出突起。培养6d后,胞体较大,可见大量细胞集落形成,较多细胞呈半悬浮生长,部分细胞表面出现长短不一的毛刺样突起,并可见少量单个悬浮的典型树突状细胞。培养9 d后,胞体明显变大,绝大部分细胞呈半悬浮生长,可见胞膜向外伸出树枝样突起,呈现典型的树突状细胞形态。
SLE患者活动组树突状细胞表达的CD1a水平低于健康对照组(P<0.05),而CD80、CD86、HLA-DR的表达水平均升高(均P<0.05);非活动组CD1a、CD80、CD86和HLA-DR的表达水平与健康对照组差异均无统计学意义(均P>0.05)。各组树突状细胞的CD83表达水平差异无统计学意义(P>0.05)。详见表1。

表1 各组树突状细胞表型检测结果(%)
2.2 各组淋巴细胞的增殖情况比较 与健康对照组相比,SLE患者诱导培养的树突状细胞刺激同种异体淋巴细胞增殖能力增强(P<0.05)。活动组与非活动组差异有统计学意义(P<0.05),而非活动组与健康对照组差异无统计学意义(P>0.05)。详见表2。
2.3 各组培养上清液中细胞因子水平的比较 与健康对照组比较,SLE患者(活动组、非活动组)培养的树突状细胞分泌IL-12的水平均降低(P<0.05),IL-10水平升高(P<0.01),而活动组与非活动组诱导培养的树突状细胞分泌IL-12、IL-10的水平差异均无统计学意义(均P>0.05)。详见表3。
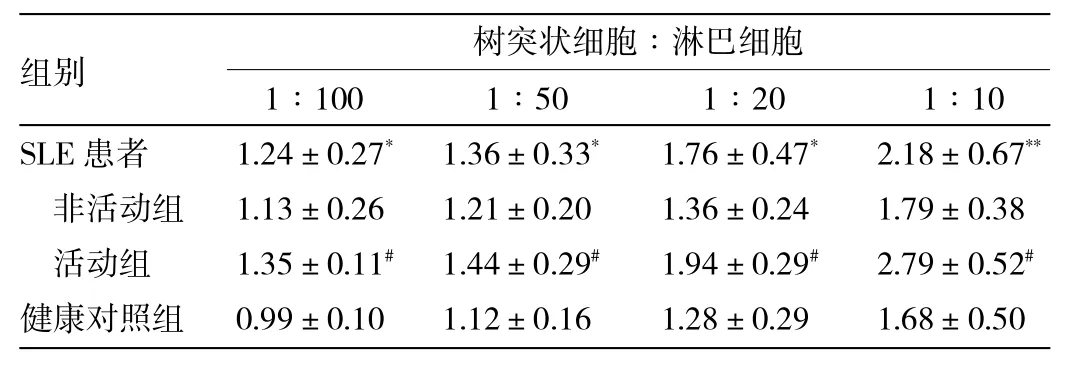
表2 各组淋巴细胞增殖能力(SI)的比较

表3 各组培养上清液中IL-12和IL-10水平的比较(pg/ml)
2.4 各组树突状细胞对Th1、Th2分化影响的比较 见表4、图1。

表4 各组树突状细胞对Th1、Th2分化影响的比较(%)
由表4、图1可见,与对照组比较,SLE活动组的树突状细胞与健康对照组淋巴细胞共培养后Th1的比例明显降低(P<0.01),Th2比例差异无统计学意义(P>0.05)。
3 讨论
SLE是一种常见的自身免疫性疾病,其主要特点是自发性的T细胞激活以及Th细胞辅助的B细胞多克隆激活,导致大量自身抗体产生,核小体形成,循环免疫复合物增多。目前对于SLE自身免疫异常的机制不十分清楚,可能涉及3个环节:(1)自身抗原激活;(2)抗原递呈细胞;(3)增强共刺激信号[3]。
SLE患者的发生、发展均与树突状细胞的改变有着密切的关系[4]。本研究中分离SLE患者外周血CD14单核细胞,联合应用GM-CSF和IL-4选择性促进树突状细胞优势增生,并以TNF-α促进树突状细胞进入成熟阶段。成熟的树突状细胞高表达MHC-Ⅱ、CD40、CD80、CD83、CD86等免疫分子。本研究中,SLE外周血单核细胞诱导的树突状细胞各表型表达百分率较对照组有所提高,除CD80外,均有统计学意义,SLE活动组树突状细胞各表型表达较非活动期明显升高。SLE患者活动组的树突状细胞CD1a表达降低,提示可能存在分化障碍。已有报道,SLE患者中循环树突状细胞的总数比正常对照组低[2]。特别是浆细胞来源的树突状细胞(pDC)数量明显降低,而且活动期患者循环树突状细胞的数量明显低于静止期患者。T细胞的激活一是需要T细胞表面受体(TCR)与相应的MHC抗原多肽结合,二是T细胞表面共同刺激受体与共刺激分子B7-1(CD80)和B7-2(CD86)相结合,只有当抗原递呈细胞传递的共同刺激信号存在的情况下,T、B细胞才会出现增生、活化。在SLE患者,即使是在疾病的非活动期也可观察到CD80和CD86的增高,说明共刺激分子B7与SLE患者自身反应性T细胞形成和激活有关,这些自身反应性T细胞可以大量增生,产生各种自身抗体,导致器官组织的损伤[4]。HLA-DR为MHC-Ⅱ类分子,表达于B淋巴细胞、单核细胞、巨噬细胞、活化T淋巴细胞、活化NK淋巴细胞和人祖细胞上[5]。SLE患者HLA-DR表达增高也提示着T、B细胞分化增高。CD83是树突状细胞成熟的标志,研究结果表明,诱导培养的SLE患者外周血单核细胞可产生大量成熟的树突状细胞,说明树突状细胞在SLE抗原递呈及产生共刺激信号等方面对SLE的发生、发展具有促进和加强的作用[8]。在实验的过程中还发现SLE患者诱导培养的树突状细胞刺激同种异体淋巴细胞增殖能力增强。活动期与非活动期患者诱导的树突状细胞刺激同种异体淋巴细胞也有所差异,而非活动期与健康对照组所诱导的树突状细胞刺激同种异体淋巴细胞无明显差异。
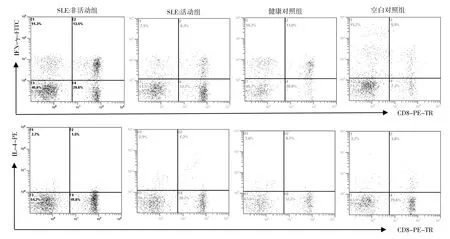
图1 各组树突状细胞对Th1、Th2分化影响的流式细胞仪检测结果(以CD3+细胞设门)
在体内,树突状细胞可以通过分泌的多种细胞因子调节T细胞亚群的分化[9-10]。IL-12可诱导Th0向Th1细胞分化,本研究结果表明,SLE患者无论是活动期还是静止期,其产生的IL-12均低于对照组。SLE患者诱导的树突状细胞与健康对照组淋巴细胞共培养后Th1的比例明显降低,活动组降低更明显,而Th2的比例无明显差异。分析此结果可能与以下因素有关:(1)已知IL-12诱导Th1细胞的发育,当IL-12分泌减少时,Th1细胞的发育受抑制,Th1细胞产生的细胞因子减少。已有文献报道SLE患者体内的IL-1β、IL-2和IFN-γ的基因表达水平较正常人降低或检测不到[11-12],细胞免疫功能降低。(2)IL-12分泌减少,导致Th1细胞及其分泌细胞因子的减少,则对Th2型的细胞因子的抑制作用减弱,导致Th2型细胞因子分泌增多。文献报道SLE患者体内有较高水平的Th2细胞因子基因的表达,包括IL-14、IL-6和IL-10,使得SLE患者体液免疫功能增强,产生自身抗体[13-14]。(3)研究已表明SLE患者体内有较高水平的IL-10,它能增强B细胞的活性,使其产生自身抗体[15],而IL-10是合成IL-12的强力抑制物,因此SLE中高水平的IL-10可降低IL-12的水平。IL-10主要是由Th2细胞分泌,在有些情况下,树突状细胞可通过分泌IL-10和TGF-β等细胞因子,诱导B细胞发生Ig类别转换,产生IgA类抗体;也可通过分泌以IL-1β为主的细胞因子,促进T、B细胞活化。本研究中也检测到SLE患者诱导的树突状细胞分泌的IL-10明显增加。
本研究提示SLE患者诱导的树突状细胞表型增加,刺激同种异体淋巴细胞增殖能力增强,分泌IL-12降低,IL-10升高,导致了Th1细胞分化不足。阻断或减少成熟树突状细胞的产生,防止树突状细胞的浸润,改善其免疫调节功能,维持自身的免疫耐受,减少自身抗原的摄取和递呈,促进Th1细胞的产生,打破原有的恶性循环,可达到长期缓解SLE症状和治疗的目的。
[1]Miyake K,Akahoshi M,Nakashima H.Th subset balance in lupus nephritis[J].J Biomed Biotechnol,2011:980-986.
[2] Seitz H M,Matsushima G K.Dendritic cells in systemic lupus erythematosus[J].Int Rev Immunol,2010,29(2):184-209.
[3] Zhang R,Xing M,Ji X,et al.Interferon-alpha and interleukin-6 in SLE serum induce the differentiation and maturation of dendritic cells derived from CD34+hematopoietic precursor cells[J]. Cytokine,2010,50(2):195-203.
[4] Kis-Toth K,Tsokos G C.Dendritic cell function in lupus:Independent contributors or victims of aberrant immune regulation[J]. Autoimmunity,2010,43(2):121-130.
[5] Sela U,Sharabi A,Dayan M,et al.The role of dendritic cells in the mechanism of action of a peptide that ameliorates lupus in murine models[J].Immunology,2009,128(1 Suppl):e395-405.
[6] Carre~no L J,Pacheco R,Gutierrez M A,et al.Disease activity in systemic lupus erythematosus is associated with an altered expression of low-affinity Fc gamma receptors and costimulatory molecules on dendritic cells[J].Immunology,2009,128(3):334-341.
[7] Shah D,Kiran R,Wanchu A,et al.Oxidative stress in systemic lupus erythematosus:relationship to Th1 cytokine and disease activity[J].Immunol Lett,2010,129(1):7-12.
[8] Ursaciuc C,Surcel M,Ciotaru D,et al.Regulatory T cells and TH1/TH2 cytokines as immunodiagnosis keys in systemic autoimmune diseases[J].Roum Arch Microbiol Immunol,2010,69(2): 79-84.
[9] Tucci M,Lombardi L,Richards H B,et al.Overexpression of interleukin-12 and T helper 1 predominance in lupus nephritis[J]. Clin Exp Immunol,2008,154(2):247-254.
[10] Barbado J,Vega L,González-Gallego R,et al.MCP-1 in urine as biomarker of renal lupus in absence of cytokines,interferon-γ and growth factors[J].Reumatol Clin,2010,6(6):296-298.
[11] Tamimoto Y,Horiuchi T,Tsukamoto H,et al.A dose-escalation study of rituximab for treatment of systemic lupus erythematosus and Evans'syndrome:immunological analysis of B cells,T cells and cytokines[J].Rheumatology(Oxford),2008,47(6): 821-827.
[12] Tucci M,Lombardi L,Richards H B,et al.Overexpression of interleukin-12 and T helper 1 predominance in lupus nephritis [J].Clin Exp Immunol,2008,154(2):247-254.
[13] Ohl K,Tenbrock K.Inflammatory cytokines in systemic lupus erythematosus[J].J Biomed Biotechnol,2011:432-595.
[14] Lit L C,Wong C K,Li E K,et al.Elevated gene expression of Th1/Th2associated transcription factors is correlated with disease activity in patients with systemic lupus erythematosus[J].J Rheumatol,2007,34(1):89-96.
[15] Cui H D,Qi Z M,Yang L L,et al.Interleukin-10 receptor expression and signalling were down-regulated in CD4+T cells of lupus nephritis patients[J].Clin Exp Immunol,2011,165(2):163-171.
(本文编辑:马雯娜)
《浙江医学》对图表的要求
稿件中若有图表,分别按其在正文中出现的先后次序连续编码。每幅图应冠有图题。说明性的文字应置于图下方注释中,并在注释中标明图表中使用的全部非公知公用的缩写。线条图应墨绘在白纸上,高宽比例以5∶7为宜。以计算机制图者应提供激光打印图样。照片图要求有良好的清晰度和对比度;图中需标注的符号(包括箭头)请用另纸标上,不要直接写在照片上。每幅图的背面应贴上标签,注明图号、方向及作者姓名。若刊用人像,应征得本人的书面同意,或遮盖其能被辨认出系何人的部分。大体标本照片在图内应有尺度标记。病理照片要求注明染色方法和放大倍数。图表中如有引自他刊者,应注明出处。电子版投稿中图片建议采用JPG格式。表格建议采用三横线表(顶线、表头线、底线),如遇有合计和统计学处理内容(如 值、值等),则在此行上面加一条分界横线;表内数据要求同一指标有效位数一致,一般按标准差的1/3确定有效位数。
本刊编辑部
Effect of dendritic cells on Th1/Th2differentiation in patients with systemic lupus erythematosus
Systemiclupus erythematosus Dendritic cells Th1/Th2
2012-03-14)
杭州市科技发展计划项目(2008333Q27)
310003 杭州,浙江省中西医结合医院风湿免疫实验室(周红娟、施华萍、蔡龙),肾病科(郑红霞、马纪林、陶筱娟)
周红娟,E-mail:zhouhjlan@hotmail.com

