华仁杏SSR标记的筛选与评价
秦 玥 ,刘梦培 ,傅大立 ,2,朱高浦 ,赵 罕
(1.中国林业科学研究院 经济林研究开发中心,河南 郑州 450003;2.北京林业大学,北京 100083)
华仁杏Armeniaca cathayanaD. L. Fuet al.属于蔷薇科Rosaceae李亚科Subfam. Prunoideae杏属ArmeniacaScop.,是2010年傅大立等发表的我国杏属一新种[1]。华仁杏是我国重要的木本粮食与油料兼用树种,具有果核薄、杏仁大、无苦味、含油率高、油质上乘、抗性强等优良特性。华仁杏种质资源丰富,栽培品种较多,但其相关的分子标记研究鲜见报道,新种发表至今,仅有极少数学者就其不同品种与杂交种进行了分子标记研究[2-5]。
研究华仁杏的SSR引物,对寻求科学准确的种质鉴定技术,解决其生产中存在的品种混杂、同名异物现象具有重要意义。SSR分子标记是近几年发展起来的利用范围较广的分子标记技术,具有多态性高、重复性好、共显性遗传、数量丰富、对基因组覆盖性高等优势[6-8]。目前,SSR分子标记技术以其独特的优势在遗传多样性分析[9-10]、遗传连锁图谱构建[11-12]、基因定位[13]等研究中均发挥了重要作用。由于华仁杏为近年发现的新种,目前适用于华仁杏研究的SSR引物未见报道,无法满足其品种鉴别和起源演化等研究的需要,因此,加快开发华仁杏SSR引物筛选工作显得尤为重要。关于其它物种的研究表明[14-16],SSR分子标记在属内不同种间具有一定的通用性,甚至在不同属间也具有一定的通用性。因此对近缘物种已开发的SSR引物进行筛选,也是一条获取SSR引物的重要途径。
本研究中利用SSR分子标记技术,以华仁杏为供试材料,筛选适合的多态性引物,旨在为华仁杏遗传资源的进一步评价研究奠定基础。
1 材料与方法
1.1 材 料
供试华仁杏材料均采集于中国林业科学研究院张家口实验基地,共60份(见表1)。SSR引物均由上海英俊公司合成,试验中所用试剂均购于Takara公司。
表1 供试的华仁杏品种Table 1 The tested cultivars of Armeniaca cathayana
1.2 方 法
1.2.1 DNA提取
取60份华仁杏幼嫩健康的叶片,利用试剂盒法提取基因组DNA,并用琼脂糖凝胶电泳和紫外分光光度计检测其质量和浓度。
1.2.2 PCR扩增
PCR反应体系总体积20 μL,其中Premix Taq Version 2.0(Loading dye mix) 9 μL,上下游引物各1 μL(10 μmoL/L)、DNA模板1.5 μL(20 mg/L),ddH2O 7.5 μL。循环体系 94 ℃预变性 4 min,94 ℃变性40 s,53 ℃退火40 s,72 ℃延伸80 s,35个循环,72 ℃延伸10 min,4 ℃保存。
1.2.3 扩增产物检测
扩增产物在110 V电压下,利用1.5%的琼脂糖凝胶进行电泳,40 min后取出在全自动紫外与可见分析装置中拍照。
具有清晰条带的产物在6%聚丙烯酰胺凝胶(PAG)上电泳,200 V电压,电泳2 h后,将胶取出放入之前配置好的染色液中染色。染色液的配制方法:10 mL 1 moL/L 的NaCl溶液中加入10 μL的10 000×Gelred原液,再用1×TBE定容到100 mL)。30 min后取出拍照[17]。
1.2.4 数据采集与统计分析
将电泳图谱上同一位置清晰出现的条带记为1,没有条带记为0,记录过程中,统计主要带型,忽略弱杂带型,构建SSR引物扩增结果的数据库。统计每对SSR引物PCR扩增出的不同等位位点数,计算每个SSR位点的多态性信息含量指数(PIC),,其中Pi为某个SSR位点的第i个等位变异出现频率占该位点全部等位变异出现频率的比率。并用PopGene软件计算杂合度、Shannon指数等信息。
2 结果与分析
2.1 SSR引物筛选结果
利用8份华仁杏样品进行65对李亚科SSR引物的筛选,其中31对引物多态性较高、稳定性较好并且分辨率较高。利用这31对SSR引物对60份华仁杏材料进行扩增,得到产物片段大小在67~394 bp之间,部分电泳结果如图1与图2所示,筛选出的31对引物的信息见表2。
2.2 引物SSR位点分析
利用筛选出的31对SSR引物在60个华仁杏样品中检测到138个等位基因位点,每对引物可检测2~7个等位位点,平均等位位点数为4.5个。其中,以引物aprigms20、aprigms24和BPPCT030检测的等位基因最多。平均多态性信息含量指数(PIC)为0.72,变化范围为0.28~0.90,以引物aprigms18的值最高,引物Pchgms2的值最低。
利用PopGene软件分析31对引物对60份华仁杏材料的检测结果,结果见表3。从表3可以看出:平均观测杂合度为0.533 6;引物BPPCT002的值最高,为0.867 9;引物Pchgms2的最低,为0.050 0。平均期望杂合度为0.580 8;引物BPPCT030的值最高,为0.785 9;引物Pchgms2的最低,为0.065 4。Nei指数(h)的分布范围在0.064 9~0.779 1之间,平均每个位点的h值为0.575 4。平均每个位点的Shannon信息指数(I)值为0.646 5;引物BPPCT030的I值最高,为1.674 6;引物Pchgms2的值最低,为0.164 9。

图1 引物BPPCT030的部分扩增产物的6%聚丙烯酰胺凝胶电泳图Fig.1 6% PAGE gel electrophoresis of part of ampli fied products with primer BPPCT030
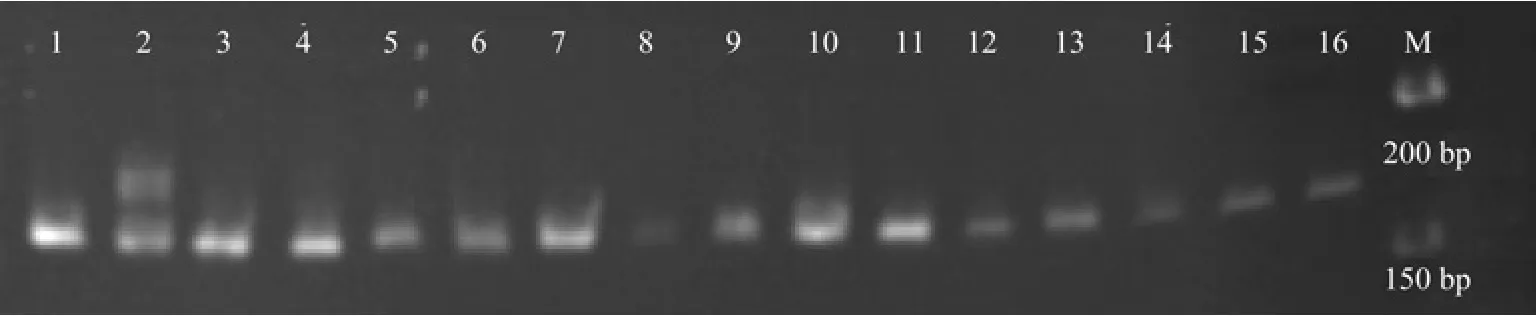
图2 引物Pchgms2的部分扩增产物的6%聚丙烯酰胺凝胶电泳图Fig.2 6% PAGE gel electrophoresis of part of ampli fied products with primer Pchgms2
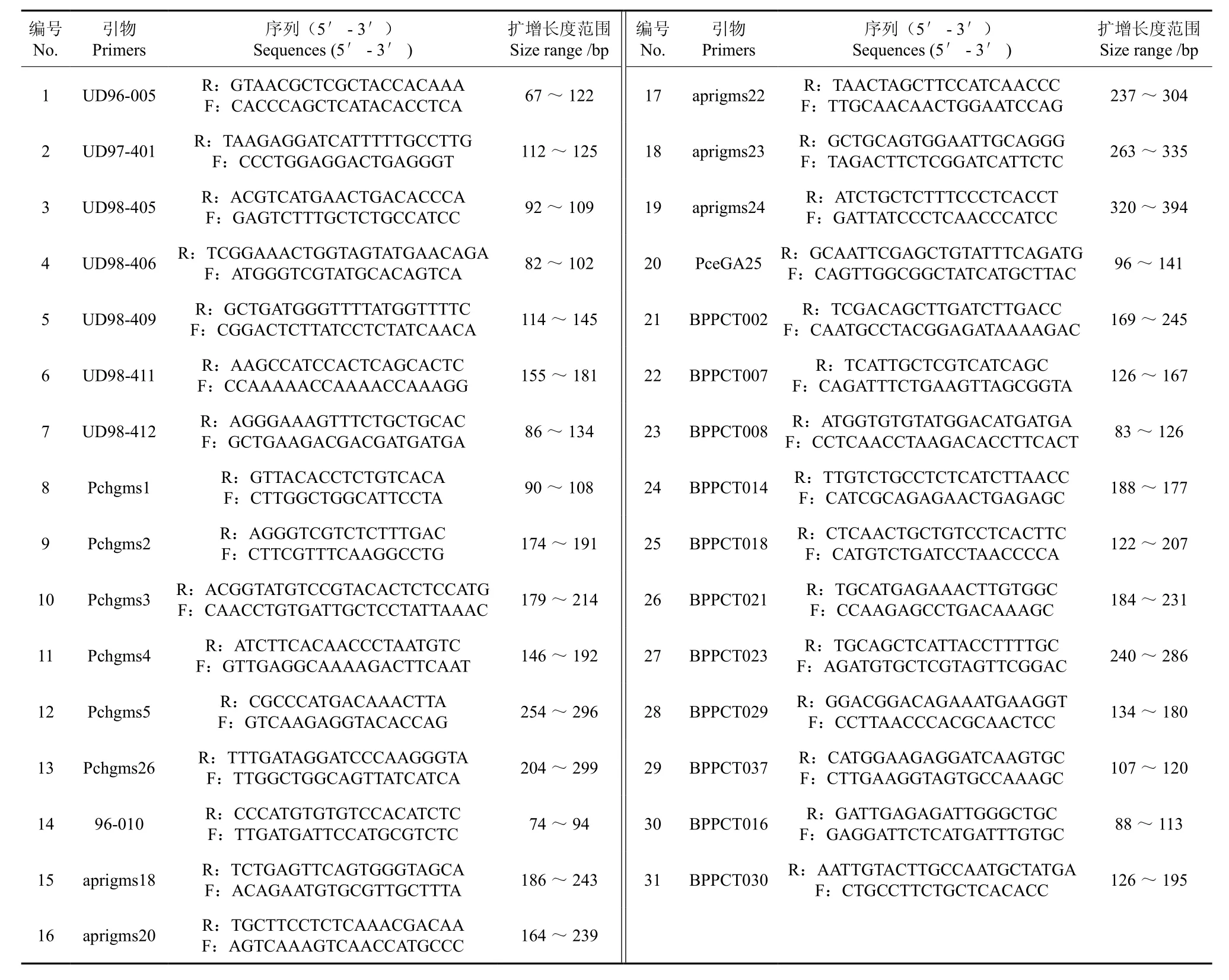
表2 筛选出的31对SSR引物对60份供试材料的扩增结果Table 2 Amplification result of 60 samples by using 31 pairs of primers

表3 华仁杏引物的SSR扩增统计结果和基因多样性分析Table 3 SSR amplification results of primers and analysis of genetic diversity in Armeniaca cathayana
3 讨论与结论
本研究以华仁杏不同品种作为试验材料,从65对已公开发表的SSR引物中筛选出31对引物,可以扩增出清晰的条带。该31对引物中既包括杏属引物,也包括李属及少量其它蔷薇科引物,由此可见,SSR标记具有较好的通用性。
利用31对引物在60份华仁杏材料中进行PCR扩增,共检测到138个等位基因位点,每对引物可检测2~7个等位位点,其中有3对引物等位位点数达到7。较高的多态性显示了SSR标记具有较高的应用价值,同时也反映了供试材料在该位点存在较大的遗传差异[18]。
PIC值、杂合度、Nei’s基因多样性、Shannon信息指数均是描述引物多态性的指标。计算每对引物的PIC值,最高可达0.9,平均值也高达0.72,较玉米[19]、辣椒[20]、甜瓜[21]等其它多数物种偏高。一般认为当PIC>0.5时,该引物为高度多态性信息引物;当0.25<PIC<0.5时,为中度多态性信息引物;当PIC<0.25时,为低度多态性信息引物[22]。本研究中所得平均期望杂合度及观测杂合度分别为0.533 6及0.580 8,较Fatemeh等[23]和张淑青等[24]试验所得值0.628和0.68偏低。
综合几个指标,31对引物中鉴别能力最强的2对引物为BPPCT030和aprigms18,最弱的2对引物为Pchgms2和aprigms23。
参考文献:
[1]傅大立,李炳仁,傅建敏,等. 中国杏属一新种[J]. 植物研究,2010,30(1):1-3.
[2]傅大立,刘梦培,傅建敏,等. 华仁杏种级分类地位的SSR分析[J]. 中南林业科技大学学报,2011,31(3):60-64.
[3]刘梦培,傅大立,李芳东,等. 华仁杏杂种鉴定及遗传变异分析[J]. 林业科学研究,2012,25(1):88-92.
[4]刘梦培,傅大立,李芳东,等. 华仁杏ISSR-PCR反应体系的正交优化分析[J]. 华北农学报,2011,26(2):128-132.
[5]刘梦培,傅大立,田 敏,等. 华仁杏3个杂交组合F1子代遗传变异的ISSR分析[J]. 中南林业科技大学学报,2011,31(10):100-104.
[6]姜 敏,张立军.SSR标记在玉米育种中的研究进展[J].杂粮作物,2009,29(4):237-239.
[7]赵海燕,渠云芳,黄晋玲.SSR分子标记在棉花遗传育种中的应用及进展[J].中国农学通报,2009,25(22):57-61.
[8]艾呈祥,余贤美,张力思,等.甜樱桃SSR标记的选择性扩增微卫星(SAM)法筛选[J].园艺学报,2007,34(2):311-316.
[9]杨 军,曹玉芬,吴 俊,等.杜梨实生繁殖群体遗传多样性的SSR分析[J].西北植物学报,2011,31(11):2172-2177.
[10]余 利,黄少勇,张智俊,等.13种观赏竹EST-SSR标记遗传多样性分析[J].经济林研究,2012,30(3):6-10.
[11]陈敏敏,冯富娟,隋 心,等.3种分子标记方法在红松家系图谱构建中的应用[J].经济林研究,2011,29(4):13-59.
[12]冯素萍,李维国,于 飞,等.巴西橡胶树SSR遗传图谱的构建[J].遗传,2010,32(8):857-863.
[13]高美玲,朱子成,高 鹏,等.甜瓜重组自交系群体SSR遗传图谱构建及纯雌性基因定位[J].园艺学报,2011,38(7):1308-1316.
[14]CIPRIANI G, LOT G, HUANG W G,et al. AC/GT and AG/CT microsatellite repeats in peach [Prunus persica(L) Batsch]:isolation, characterisation and cross-species amplification inPrumus[J]. Theor Appl Genet,1999,99:65-72.
[15]高志红.果梅核心核心种质的构建与分子标记的研究[D].北京:中国农业大学,2003.
[16]乔玉山,章 镇,沈志军,等.中国李简单重复序列(SSR)反应体系的建立[J].植物生理学通讯,2004,40(1):83-86.
[17]Qin Yue, Fu Da-li, Liu Meng-pei,et al. Optimization of Microsatellite DNA Gelred Fluorescence Imaging Technology[J].African Journal of Biotechnology,2012,11(82):14749-14754.
[18]杨留启,杨文鹏,王明春,等.12份糯玉米自交系的SSR标记多态性和分子分类研究[J].贵州农业科学,2009,37(8):1-3.
[19]邱红波,叶雨胜,彭忠华,等.卡斯特高海拨山区玉米骨干自交系SSR指纹图谱的构建[J].玉米科学,2010,18(4):63-65.
[20]何建文,杨文鹏,姜 虹,等.贵州12个辣椒杂交种SSR标记指纹图谱的构建与分析[J].云南农业大学学报, 2010,25(6):769-774.
[21]王美荣,许 勇,詹永乐,等.厚皮甜瓜品种组合SSR指纹图谱构建[J].中国农学通报,2010,26(20):47-51.
[22]Bostein D, White R L, Skolnick M,et al. Constmiction of a genetic linkage map in manusing restriction fragment length polymorphisms [J].American Journal of Genetics, 1980, 32:314-331.
[23]Fatemeh M aghuly, Eduviges Borroto Femandez, Szabolcs Ruthner Andrzej Pedryc,et al. Microsatellite variability in apricots (Prunus armeniacaL) re ects their geographic origin and breeding history [J]. Tree Genetics & Genames, 2005, 1:151-165.
[24]张淑青,刘冬成,刘威生,等.普通杏品种SSR遗传多样性分析[J].园艺学报,2010,37(1):23-30.

