用加压溶剂萃取法提取板栗多糖的工艺条件
梁 雪,杨越冬,杜 彬,王同坤
(河北科技师范学院,河北省板栗工程技术研究中心,河北 秦皇岛 066004)
板栗Castanea mollissimaBlume属山毛榉科(亦名壳斗科)Fagaceae栗属Castanea[1]植物。栗属植物是世界范围内的重要经济作物,多种植于山坡地,在亚洲、欧洲、美洲有广泛分布,国外称之为“健康食品”,为健胃补肾、延年益寿的上等果品[2]。板栗果实中的很多化学成分既有营养价值,又有保健治疗作用。板栗富含淀粉和多糖,其中多糖具有一定的活性功能,已有研究结果表明,多糖含有降血糖血脂、抗氧化、抗病毒、抗肿瘤、免疫调节作用等重要生物活性[3-4],值得深入研究。目前,关于多糖类物质的提取方法主要局限于传统的热水辅助提取等[5-7],但耗时较长。加压溶剂萃取(Automated Pressurized Liquid Extraction,APLE)技术是近年来新推出的样品前处理技术,具有节约萃取溶剂、缩短萃取时间,且能提高提取效率等突出优点[8],但由于所要提取的目标物各具有不同的特点,故需要根据实际情况设置萃取处理参数,以便获得有实用价值的最佳萃取条件。例如,张玉等人[9]研究报道,提取柑橘皮中黄酮类物质的最佳工艺条件是,以80%(V/V)的乙醇为溶剂,在压强为10.3 MPa、温度为70 ℃、时间为10 min、萃取循环次数为1 次时可获得目标物的最大萃取率。宋文斌等人[10]的研究结果表明,在提取人参中的多种人参皂甙时,萃取参数设置为压强10 MPa、温度140℃、时间为5 min、萃取循环次数为2次时可获得最大的萃取量,可比其他常规方法(浸渍法、超声波法、匀质法、机械振荡法)高25.88%~58.68%。因此,在针对不同树种及其不同器官应用加压溶剂萃取技术时,均应研究其最佳的萃取条件。文中利用加压溶剂萃取技术提取板栗多糖,以萃取温度、萃取时间、萃取压力、循环次数为考察指标,并用苯酚-硫酸法测定多糖含量[11],以确定板栗多糖的最佳提取条件。同时与热水提取、微波提取、酸提取及超声波提取多糖方法进行了比较[12-15],以期为板栗有效成分的提取和开发利用提供理论依据。
1 材料和方法
1.1 材 料
试验材料:“燕龙”板栗,采自河北省迁西县白庙子乡李兴庄优种板栗示范采穗园。
主要试剂:葡萄糖标准品、无水乙醇、硫酸、苯酚等试剂均为分析纯。
主要设备:APLE-3000全自动加压溶剂萃取仪(北京吉天仪器有限公司)、Jsp-200 金穗高速多功能粉碎机(浙江省永康市金穗机制造厂)、SJT-Ⅱ多功能恒温超声波生物萃取仪(无锡市上佳生物科技有限公司)、G80W23YCSL-Q3格兰仕微波炉(广东格兰仕集团有限公司)、N-1100旋转蒸发仪(东京理化器械株式会社)、722S可见分光光度计(上海精密科学仪器有限公司)。
1.2 方 法
1.2.1 材料预处理
将板栗剥壳后置于鼓风干燥箱中干燥至恒重(25~50 ℃),然后用粉碎机研磨成粉状,过40目筛,然后装入密封袋放入干燥器中备用。
1.2.2 APLE提取板栗多糖的工艺流程
称取一定量板栗粉,与硅藻土充分混合,装入萃取池,再用硅藻土填满萃取池,设计不同萃取温度、静态萃取时间、萃取压力和萃取循环次数,开始快速萃取。萃取完成后,取出收集瓶,测量萃取液体积,计算多糖提取率,再对板栗多糖的提取液进行离心、沉淀,得到板栗粗多糖。
1.2.3 热水辅助提取板栗多糖
称取一定量的板栗粉,按照1∶35的料液比、提取温度65 ℃、提取时间1 h的最佳提取条件进行水浴锅浸提,离心合并上清液,测量上清液体积,计算多糖提取率,再对板栗多糖的提取液进行浓缩、沉淀,得到板栗粗多糖[13]。
1.2.4 微波辅助提取板栗多糖
称取一定量的板栗粉,按照1∶30的料液比、提取时间50 s,提取功率800 w的最佳提取条件在微波炉内提取,离心合并上清液,测量上清液体积,计算多糖提取率,再对板栗多糖的提取液进行浓缩、沉淀,得到板栗粗多糖[13]。
1.2.5 酸辅助提取板栗多糖
称取一定量的板栗粉,按照提取时间40 min、提取温度70 ℃、盐酸浓度0.72 mol/L、料液比为1∶20的最佳提取条件,在水浴锅内浸提,离心合并上清液,测量上清液体积,计算多糖提取率,再对板栗多糖的提取液进行浓缩、沉淀,得到板栗粗多糖[13]。
1.2.6 超声波辅助提取板栗多糖
称取一定量的板栗粉,按照浸提温度30 ℃,超声波功率870 W,超声时间50 min,料液比为1∶40的最佳提取条件,用超声波生物萃取仪提取,离心合并上清液,测量上清液体积,计算多糖提取率,再对板栗多糖的提取液进行浓缩、沉淀,得到板栗粗多糖[13]。
1.2.7 板栗多糖含量的测定
采用苯酚-硫酸法测定多糖含量。标准曲线的制作过程如下:称取葡萄糖1.00 g,制得100 μg/mL标准葡萄糖溶液。分别吸取0.0、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0 mL于 试 管,以去离子水定容至1.0 mL,即得到不同浓度葡萄糖标准溶液(0、10、20、30、40、50、60、70、80、90、100 μg/mL),加入5%苯酚1.0 mL及浓硫酸5.0 mL,室温静置30 min,以不加葡萄糖标准溶液的溶液作为空白对照,用紫外分光光度计在490 nm处测定其吸光值。以横坐标为多糖浓度,纵坐标为光密度值,绘制标准曲线(见图1)。
将板栗多糖液稀释为合适的倍数,取稀释液1.0 mL,按照上述步骤操作,测定吸光值,根据图1中葡萄糖标准曲线方程y=7.758 2x-0.003 5计算出多糖的浓度C;并按下式计算多糖的提取率[16]:
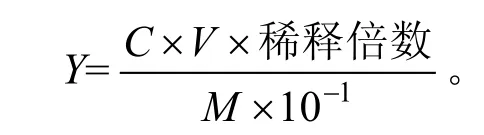
上式中,Y表示多糖提取率(%),C表示由标准曲线计算得到的多糖质量浓度(μg/mL) ,V表示样品溶液体积(mL),M表示板栗粉总质量(g)。

图1 葡萄糖标准曲线Fig.1 Standard curve of glucose
2 结果与分析
2.1 加压溶剂萃取板栗多糖的单因素试验
萃取温度的确定:设置萃取温度分别为50、55、60、65、70 ℃,试验结果如图2。随着提取温度的升高,板栗中多糖的提取率明显增大,当提取温度升高到65 ℃时,即达到了最佳萃取温度;当提取温度超过65 ℃以后,多糖提取率又开始下降。因此,选定的正交试验温度分别为60、65、70 ℃。

图2 温度对板栗提取率的影响Fig.2 Effect of temperature on polysaccharide yield in Chinese chestnut
静态萃取时间的确定:设置静态萃取时间分别为4、8、12、16、20 min,试验结果如图3。随着萃取时间的增加,板栗中多糖的提取率逐渐下降,可能由于时间过长导致了多糖的降解。因此,为了提高多糖提取率,选定的正交试验时间分别为 4、8、12 min。
萃取压力的确定:设置压力分别为3、6、9、12、15 MPa,试验结果如图4。随着压力的增大,板栗多糖的提取率也跟着增大;当萃取压力到达6 MPa时,提取率最大;继续增大压力,多糖的提取率开始下降。因此,选定的正交试验压力条件分别为3、6、9 MPa。

图3 时间对板栗多糖提取率的影响Fig.3 Effect of time on polysaccharide yield in Chinese chestnut

图4 萃取压力对板栗多糖提取率的影响Fig.4 Effect of pressure on polysaccharide yield in Chinese chestnut
循环次数的确定:设置循环次数分别为1、2、3、4、5次,试验结果如图5。随着提取次数的增多,多糖提取率逐渐增大,当提取次数为3时,提取率达到最大值;随后多糖的提取率又出现下降的趋势。由此确定,正交试验中循环次数分别为2、3、4次。
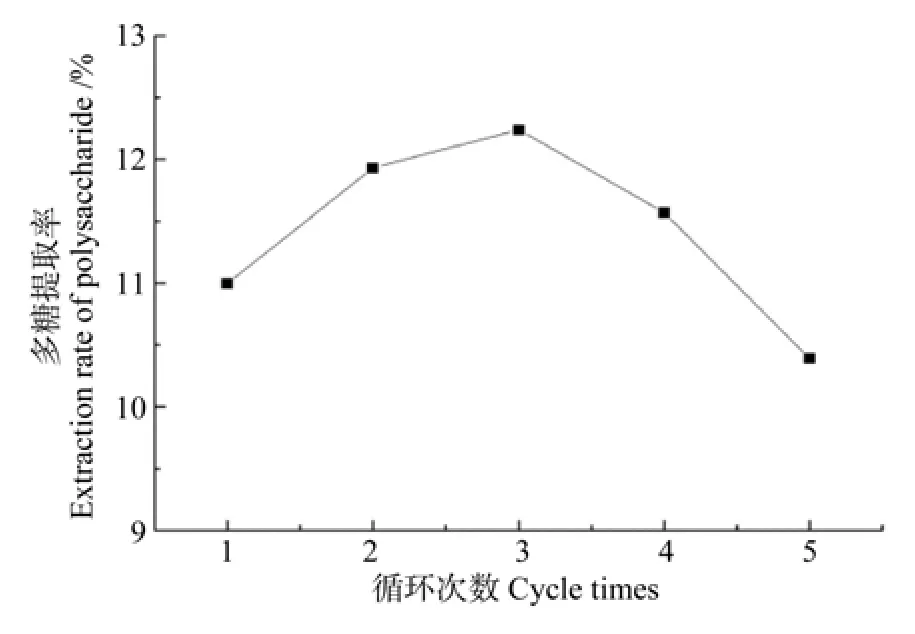
图5 循环次数对板栗提取率的影响Fig.5 Effect of cycle times on polysaccharide yield in Chinese chestnut
2.2 加压溶剂萃取板栗多糖最优条件的确定
根据单因素试验所确定的因素水平,设计了4因素3水平L9(34)的正交试验,得到了板栗多糖加压溶剂萃取的最佳工艺条件(如表1所示)。
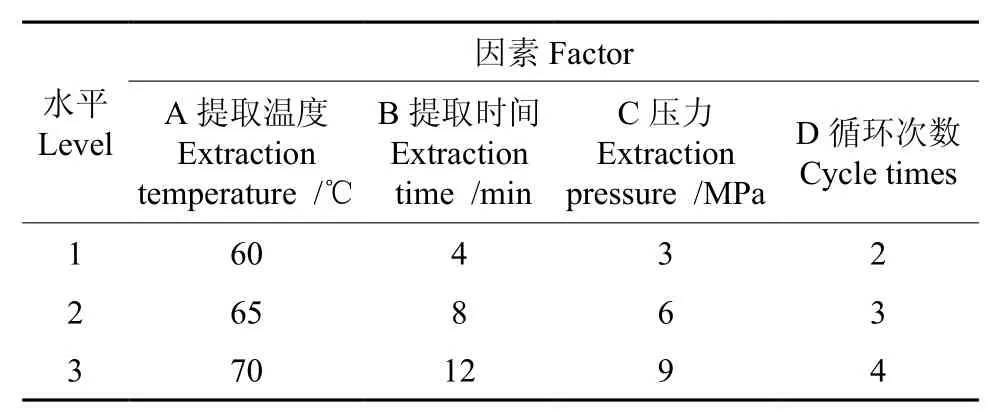
表1 正交试验设计的因素与水平Table 1 Factors and levels in orthogonal experimental design
本研究即按照此设计条件进行正交试验,结果如表2所示。4个因素对板栗多糖提取率的影响的主次顺序为提取时间>循环次数>提取压力>提取温度。根据显著性检验确定的最佳提取工艺条件为A3B2C2D1,即提取温度为70 ℃,提取时间为8 min,萃取压力为6 MPa,循环次数为2次。
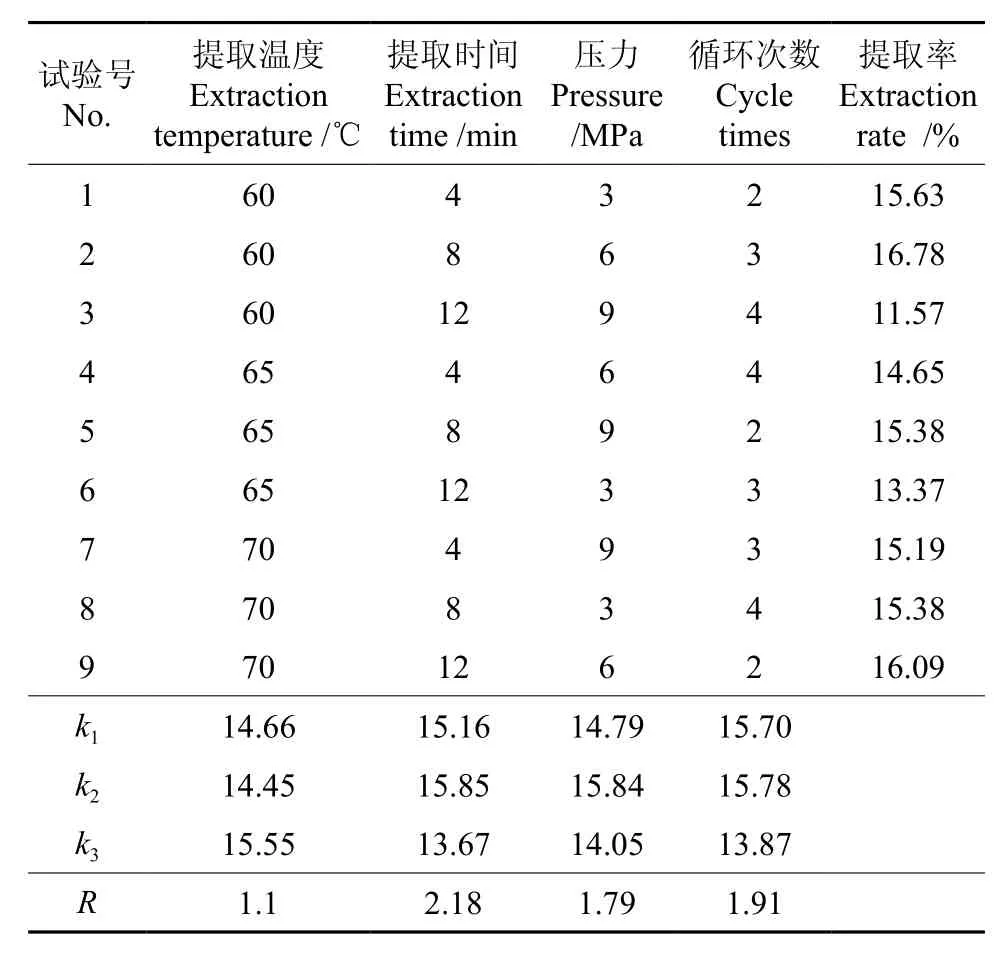
表2 板栗多糖提取正交试验结果Table 2 Orthogonal test results of polysaccharide extraction in Chinese chestnut
正交处理后,对试验数据进行了方差分析,结果如表3所示。由表3可知,萃取时间、循环次数、萃取压力对多糖提取率的影响极显著,萃取温度对多糖提取率的影响不显著。
2.3 验证性试验结果
为了验证试验结果的可靠性,根据最佳提取条件进行了验证性试验。在萃取温度为70 ℃,萃取时间为8 min,萃取压力为6 MPa,循环次数为2次的条件下,板栗多糖的实际提取率为20.14%±0.025 4%。因此认为,对板栗多糖提取条件的优化是可行的,具有实际应用价值。

表3 方差分析结果†Table 3 Result of variance analysis
2.4 5种板栗多糖提取方法的比较
根据正交试验所确定的加压溶剂萃取板栗多糖的最优条件进行多糖提取,结果得出板栗多糖的提取率为20.14%。同时,根据参考文献介绍的热水辅助提取、微波辅助提取、酸辅助提取和超声波辅助提取板栗多糖的最优方法进行试验并计算提取率,所得结果见表4。

表4 APLE法最优多糖萃取条件及其与传统提取多糖方法的对比Table 4 Comparison of the optimal polysaccharide extraction conditions of pressurized solvent extraction and some traditional polysaccharide extraction methods
将表4中不同提取方法所得的结果进行比较后可知:加压溶剂萃取法所用时间短,循环2次的时间仅有16 min,而其它4种辅助提取法所需时间均长于加压溶剂萃取法,并且要达到加压溶剂萃取法相似的提取效果则需12 h左右;此外,加压溶剂萃取法溶剂使用量少,萃取液体积小,多糖浓度高,省去了真空浓缩步骤,提高了萃取效率,多糖提取率比热水提取、微波提取、酸提取分别提高了3.20、13.86 、6.50个百分点。加压溶剂萃取法与超声波提取相比,虽然提取率降低了2.37个百分点,但是在同等的时间内(16 min),超声波辅助提取的多糖提取率仅为8.72%,远远低于加压溶剂萃取法。
3 结论与讨论
以加压溶剂萃取法提取板栗中多糖的最佳工艺参数为:萃取温度70 ℃,静态萃取时间8 min,萃取压力6 MPa,循环次数2 次,多糖的提取率达20.14%。加压溶剂萃取法与常规的多糖提取技术相比,具有4方面的优势:①快速,完成1 次提取一般仅需8 min;萃取时间缩短了,可以保证萃取物热降解减少;②溶剂用量少,20 g样品仅需30 mL溶剂,萃取液浓度较高,所得萃取液可直接用于醇沉试验,省去了真空浓缩步骤;③萃取效率高,显著降低了单个样品的提取成本;④使用方便,安全性好,自动化程度高。
采用热水辅助法、微波辅助法、酸辅助法和超声波辅助法提取板栗多糖的单因素试验中,当达到一定提取时间后再继续延长提取时间,多糖的提取率会逐渐下降,其原因可能是在较高温度条件下时间的延长会导致多糖降解,持续高温易破坏多糖结构,且影响多糖的品质。而加压溶剂萃取法的最佳萃取温度为70 ℃,完成1 次提取一般仅需8 min,萃取时间的缩短可保证萃取物热降解减少,从而提高萃取率,减小对多糖结构和活性的影响。由此可见,用加压溶剂萃取法提取板栗多糖的提取方法明显优于其它4种提取方法,且加压溶剂萃取法对多糖品质的影响不大,对多糖结构分析和生物活性的影响小,便于在生产中应用,这将对板栗新品种选育和开发利用及板栗多糖的提取都具有十分重要的意义。
参考文献:
[1]王同坤.燕山板栗产业发展现状与对策分析[D]. 陕西杨凌:西北农林科技大学,2007.
[2]林顺顺,祝美云,张建威.中国板栗的研发现状和前景[J].农产品加工,2010,(12):74-76.
[3]Li WJ, Nie SP, Yu Q,et al. Ganoderma atrum polysaccharide protects cardiomyocytes againstanoxia/reoxyg- enationinduced oxidative stress by mitochondrial pathway[J]. Journal of Cellular Biochemistry, 2010, 110(1): 191-200.
[4]Dell A, Morris HR. Glycoprotein structure determination by mass spectrometry[J]. Science,2001, 291(5512):2351-2356.
[5]尹 艳,高文宏,于淑娟.多糖提取技术的研究进展[J].食品工业科技,2007,(2):247-250.
[6]陆志科,黎 深.荔枝核活性成分及其提取物抑菌活性分析[J].经济林研究,2009,28(1):82-85.
[7]王婧杰,马凤鸣,穆立蔷.用响应面法优化超声波辅助提取紫椴枝皮中的黄酮[J].经济林研究,2012, 30(4):113-118.
[8]Richterb BE, Ezzell JL, Felix WD. Comparison of accelerated solvent extraction with conventional solvent extraction for organophosphorus pesticides and herbicides[J].LC/GC, 1995,(13): 390-398.
[9]张 玉,吴慧明,余建伟,等.加速溶剂萃取技术提取柑橘皮中总黄酮的工艺研究[J].食品科技, 2007, (11):213-215.
[10]宋文斌,代英成,许 敏,等.加速溶剂萃取-液相色谱-紫外检测法测定人参中多种人参皂甙含量[J]. 现代科学仪器,2009, (6):104-108.
[11]周 振,周 能.苯酚—硫酸法测定仁东大蒜中的总糖[J].食品研究与开发,2012,33(6):137-142.
[12]Peter CK, Vincent EC, Mei Z. Molecular weight and antitumor activity of the water-soluble polysaccharides isolated by hot water and ultrasonic treatment from the sclerotia and mycelia of Pleurotus tuber-regium[J]. ScienceDirect, 2004,56(2004): 123-128.
[13]王晓红. 板栗多糖类物质提取方法优化与不同品种(系)含量测定[D]. 河北秦皇岛: 河北科技师范学院, 2012.
[14]Chen XQ, Liu Q, Jiang XY,et al.Microwave-assisted extraction of polysaccharides fromSolanum nigrum[J]. Journal of Central South University of Technology, 2005, 12(5): 556-560.
[15]陈义勇,窦祥龙,黄友如,等.响应面法优化超声-微波协同辅助提取茶多糖工艺[J].食品科学, 2012, 33(4):100-103.
[16]范晓良,李行诺,楚 楚,等.响应面法优化加压溶剂萃取香菇多糖工艺研究[J].中国食品学报, 2012, 12(2): 98-103.

