4种披碱草属植物光合作用光响应特性的比较
祁娟,师尚礼,徐长林,闫伟红,张小娇
(1.甘肃农业大学草业学院 草业生态系统教育部重点实验室 中-美草地畜牧业可持续发展研究中心,甘肃 兰州730070;2.中国农业科学院草原研究所,内蒙古 呼和浩特010010)
植物的光合、呼吸以及水分利用状况与环境和植物内部因子之间均有密切联系,其中光合有效辐射(PAR)是影响因子中的主导因子[1]。它不仅是植物生理活动的物质和能量基础,同时还影响着植物的生长、发育、繁殖和分布。植物光合-光响应曲线是在一定的模拟光强梯度下,测定并绘制的光合速率随光强变化的曲线,反映了净光合速率随光强变化的特性[2]。通过光响应曲线可以计算出植物的光饱和点、光补偿点、最大光合速率等重要的光合参数,对研究植物的光合作用具有重要的意义,这也是研究植物光合生理生态过程对环境响应的基础[3]。光合作用-光强响应曲线很早就被用来评价植物光合速率及其相关的光合特征[4-5],显示其在一定范围的光照强度下潜在的光合能力[6]及生长发育态势,并可作为选育和鉴定具高光效、耐强光的优良品种的一个重要指标[7]。不同植物有不同的光适应特性,研究植物对光的响应,有助于阐明其冠层光合产物积累与环境的关系。
披碱草属(Elymus)是禾本科(Poaceae)小麦族(Triticeae)中的一个重要经济属,其中含有许多优良牧草,如老芒麦(Elymussibiricus)和加拿大披碱草(Elymuscanadensis)等,同时也含有抗普通栽培小麦(Triticumaestivum)和大麦(Hordeumvulgare)的一些病虫害和抗逆的基因[8-9]。目前,有关披碱草属分类、遗传多样性、形态学、生长发育、栽培技术等方面[10-15]等有很多报道,但就披碱草属植物光合特性变化报道较少,尤其是对不同来源野生披碱草属材料光合生理特性尚未见相关报道。因此,研究披碱草属植物的光合作用光响应特性具有重要的意义。本研究选取披碱草属4种材料为对象,在模拟有效光辐射条件下比较不同植物光合特征及其差异,通过测定净光合速率-光响应曲线,阐明披碱草属植物对环境光合特性的适应和生理响应,揭示其适应强光和弱光的能力,为披碱草属种质资源的评价与利用奠定科学基础。
1 材料与方法
1.1 试验地概况
本试验小区设在内蒙古自治区锡林郭勒盟太仆寺旗贡宝拉格苏木,位于北纬41°36′,东经115°04′,内蒙古中部,锡林郭勒盟南部,地处阴山北麓,浑善达克沙地南缘,属典型干旱、半干旱草原区;海拔1400m,年平均气温0.7~2.4℃,最热月(7月)平均气温17.8℃,极端最高温33.3℃,最冷月(1月)平均气温-17.6℃,极端低温-35.7℃;年均降水量397mm,最多降水量625mm,最少降水量240mm,≥10℃年积温1800~2300℃,无霜期90~126d;土壤为淡栗钙土,pH一般为7.0~8.5,土层较厚,周边草地植被以克氏针茅(Stipakrylovii)、羊草(Leymuschinensis)、隐子草属(Cleistogenes)及蒿属(Artemisia)植物为建群种和优势种。
1.2 试验材料与方法
试验材料为老芒麦、披碱草(Elymusdahuricus)、麦宾草(Elymustangutorum)、肥披碱草(Elymusexcelsus)。于2007年6月21日人工条播,行距40cm,小区间间隔80cm,试验小区面积2m×5m,采用随机区组设计,重复3次。
利用红外气体分析仪(LI-6400)配备红蓝人工光源测量不同光照强度下植物的净光合速率(Pn,μmol CO2/m2·s)、蒸腾速率(Tr,mmol H2O/m2·s)、胞间 CO2浓度(Ci,μmol CO2/mol)、气孔导度(Gs,mol H2O/m2·s)、叶面饱和水压亏(Pa)等,模拟光辐射强度的梯度设置为0,50,100,200,400,600,800,1000,1200,1400,1600,1800,2000μmol/(m2·s)。改变光强以后最少稳定时间为60s,当测量结果变异率小于0.05时由红外气体分析仪自动记录。选取自然生长条件下,4种披碱草属植物正常叶片,每种植物测量3株,每株选取3个叶片,利用刻度尺测量叶片宽度,然后根据公式:叶面积=长×宽×0.75计算,利用Excel和SPSS软件对数据进行统计分析。
净光合速率-光响应曲线在低光强(0~200mol/m2·s)下呈直线部分的斜率即表观量子效率(AQY),将测得的净光合速率(y)与相应的光量子(x)做直线回归y=a+bx,a为暗呼吸速率,b为表观光量子效率,a/b为光补偿点,即该直线与X轴的交点为其光补偿点(LCP),与Y轴的交点则为光下的暗呼吸速率(Rd)[5],光饱和点(LSP)由抛物线模型y=ax2+bx+c,以90%Pmax时的PAR值计算[6]。水分利用效率(WUE)的计算公式为:WUE=Pn/Tr。
2 结果与分析
2.1 光合速率和蒸腾速率
披碱草属不同材料对模拟光强变化的响应过程大体上可区分为3个不同阶段。首先,在PAR<200μmol/(m2·s)光强条件下,Pn随SPR升高而线性增高(图1),之后,Pn随着SPR的升高而增加幅度较小,直到Pn不再随着SPR的升高而增高,即达到了光合作用的光饱和阶段。在0~200μmol/(m2·s)的光强范围内,4种材料的光合速率反应都比较迅速,以后随着光强的增加,曲线渐趋平缓。不同植物种之间的差别主要在于这些曲线中所包含的相关参数值大小不一,其中最明显的差别是,在相同的光照强度下,麦宾草的光合速率较高,披碱草次之,其他2种材料净光合速率差异不大。4种植物的Tr随SPR的增强而保持相对恒定的增幅,麦宾草和肥披碱草明显高于老芒麦和披碱草,大小顺序为:麦宾草>肥披碱草>披碱草>老芒麦。
2.2 水分利用效率
对于干旱、半干旱地区植物而言,水分利用效率的有效性是决定其生存适应的最关键因子,是反映植物耐旱性的一个重要指标。披碱草属4种材料的WUE随SPR的加强而呈规律递增,WUE的大小顺序为老芒麦>披碱草>麦宾草>肥披碱草。老芒麦的蒸腾速率低,因而其水分利用效率较高。4种植物达到最大水分利用效率的光强及最大水分利用效率不同,老芒麦在SPR为1600μmol/(m2·s)时水分利用效率为3.809μmol CO2/mmol H2O,披碱草在SPR为1400μmol/(m2·s)时,WUE为2.8655μmol CO2/mmol,麦宾草和肥披碱草在SPR为1800μmol/(m2·s)时其 WUE分别为2.343和2.006μmol CO2/mmol。WUE由Pn和Tr决定,SPR增加的初期阶段,植物叶片的Pn的增幅大于Tr的增幅,WUE呈上升趋势,但当SPR超过一定强度后,植物叶片Pn的增幅小于Tr的增幅,导致WUE逐渐下降,因而老芒麦在弱光条件下光能利用效率高,在较弱的光强下就达到WUE的最大值。
2.3 气孔导度
气孔导度是植物叶片与大气进行气体交换的通道,其闭合程度直接影响光合作用,间接影响WUE。4种植物气孔导度(Gs)均随模拟光辐射强度的升高而增大(图3)。麦宾草和披碱草的Gs明显高于其他2种植物,高的Gs导致植物高的Pn、Ci、Tr和低的WUE。光照诱导气孔开启,但是随着SPR的增加,Gs并不是表现为单纯的线性递增的趋势,而是同Pn一样,也在强光下趋于平缓。
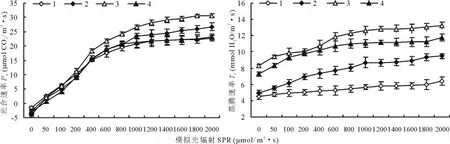
图1 4种植物光合速率及蒸腾速率对模拟光辐射增强的响应Fig.1 Responses of photosynthetic rate(Pn)and transpiration rate(Tr)to enhancing of SPR for four Elymus species
2.4 胞间CO2 浓度(Ci)
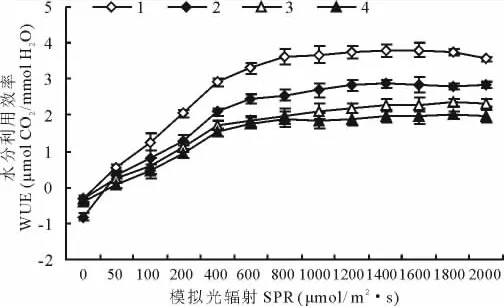
图2 4种植物WUE对SPR增强的影响Fig.2 Reponses of WUE to enhancing of SPR intensity for four plants

图3 4种植物Gs对SPR增强的响应Fig.3 Reponses of stomatal conductance(Gs)to enhancing of SPR intensity for four plants
4种植物胞间CO2均随着SPR的增强,Pn的增大而减少(图4)。SPR在0~500μmol/(m2·s)时有一个急剧下降的过程,然后Ci趋于缓慢降低态势。随SPR增强,光合作用增强,CO2消耗增大,导致Ci降低,4种植物在SPR增强的初级阶段有一个大量消耗CO2的过程,加之气孔导度较小,其Ci急剧下降。由Berry和Downton[16]对气孔限制进行判断,在大于饱和光强条件下,光合速率下降的同时,虽然气孔导度有所降低,气孔限制增大,但是Ci在稳定的低值附近呈波动状态,并没有明显的降低趋势。
2.5 叶面饱和蒸汽压亏
当SPR从0增至500μmol/(m2·s)时,4种植物叶面饱和水压亏(Vpdl)有一个小的下降过程,之后除披碱草缓慢下降外,其他材料随SPR增加而缓慢增加。麦宾草和肥披碱草的Vpdl明显高于其他2种材料,说明比披碱草和老芒麦具有更大的Vpdl。Vpdl是水蒸气从叶片散失到空气的动力,伴随Vpdl的增大,Tr逐渐增大,同时,Ci减少,Pn的增加幅度减少,导致WUE超过一定强度以后逐渐减少。
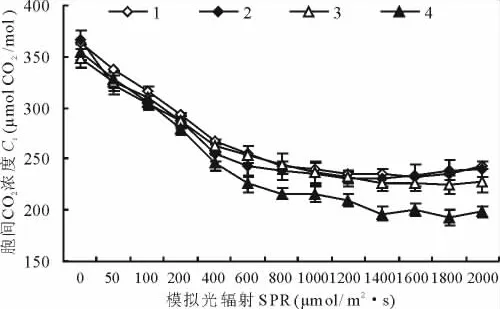
图4 4种植物胞间CO2浓度对SPR增强SPR的响应Fig.4 Reponses of intercellular CO2concentration(Ci)to enhancing of SPR for four plant species
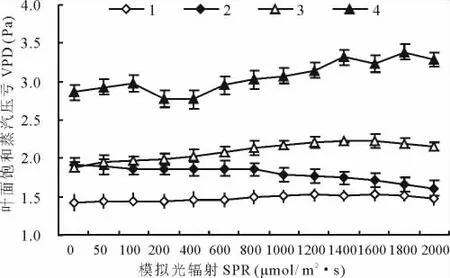
图5 4种植物叶面饱和水压亏对增强的响应Fig.5 Reponses of vapor pressure deficit(VPD)to enhancing of SPR for four plant species
2.6 4种植物主要生理参数的比较
由表1可见,4种植物的最大生理参数存在明显的差异,在SPR为2000μmol/(m2·s)的光强范围内,麦宾草的净光合速率、蒸腾速率和气孔导度较高,老芒麦较低,老芒麦具有较高的水分利用效率和胞间CO2浓度,肥披碱草的水分利用效率、气孔导度和胞间CO2浓度较低,但叶面饱和水压亏较高,披碱草各参数最大值介于这三者之间。
2.7 披碱草属4种植物各光合因子之间相关性分析
模拟光照强度下,4种植物各光合因子相关分析(表2)表明,净光合速率与气孔导度呈极显著正相关,蒸腾速率与水分利用效率呈显著负相关,WUE与胞间CO2浓度呈显著正相关,与叶面饱和水压亏呈显著负相关,胞间CO2浓度与叶面饱和水压亏呈极显著正相关。
2.8 光响应曲线
光饱和点和光补偿点分别代表光照强度与光合作用关系的上限和下限临界指标,可以代表植物自身对光能的要求及利用能力,反映植物叶片对弱光和强光的利用能力。分别对4种植物净光合速率-光响应曲线的直线部分即低光合有效辐射(x)(小于200μmol/m2·s)段和净光合速率(y)做线性回归,回归方程如表3,以回归方程计算4种植物的光补偿点分别为:老芒麦<麦冰草<披碱草<肥披碱草,通过二次曲线而计算出4种植物饱和点为:老芒麦<肥披碱草<披碱草<麦冰草。老芒麦和麦宾草光补偿点相对较低,麦宾草和披碱草光补偿点较高。老芒麦和肥披碱草的光饱和点较低,而披碱草和麦宾草的光饱和点较高,因而其利用强光的能力较强。植物的表观量子效率(AQY)反映了植物对光能的利用情况。由表3可知,4种植物AQY没显著差异,且都高于自然条件下一般植物的表观量子产额(0.03~0.05)[8],这也是这4种植物光合速率较高,生长较好的重要原因之一。
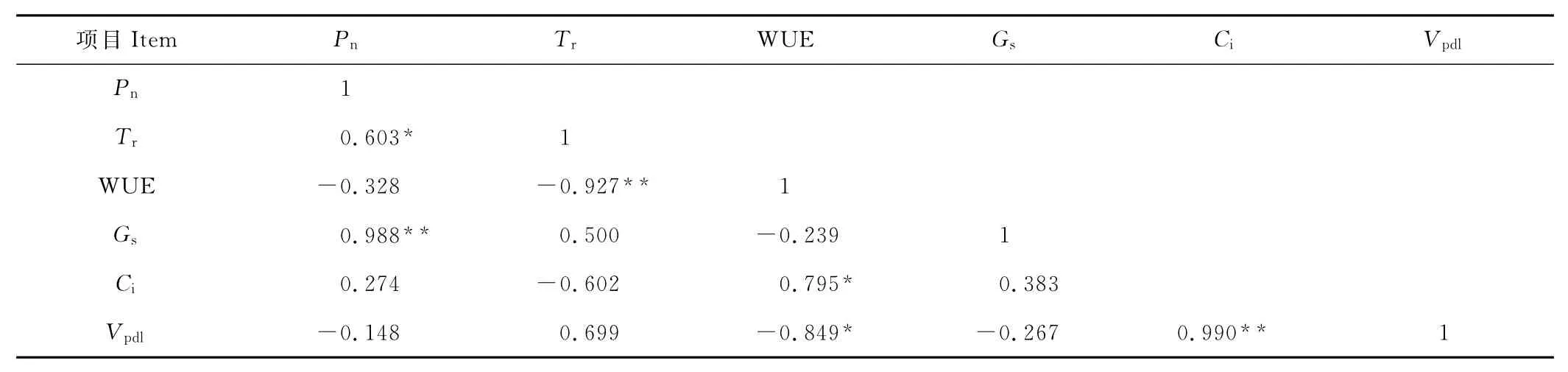
表2 披碱草属4种植物各光合因子之间相关性分析Table 2 Cofficient of correlation among Pn,Tr,WUE,Gs,Ciand water vapor deficit at the leaf surface plant species
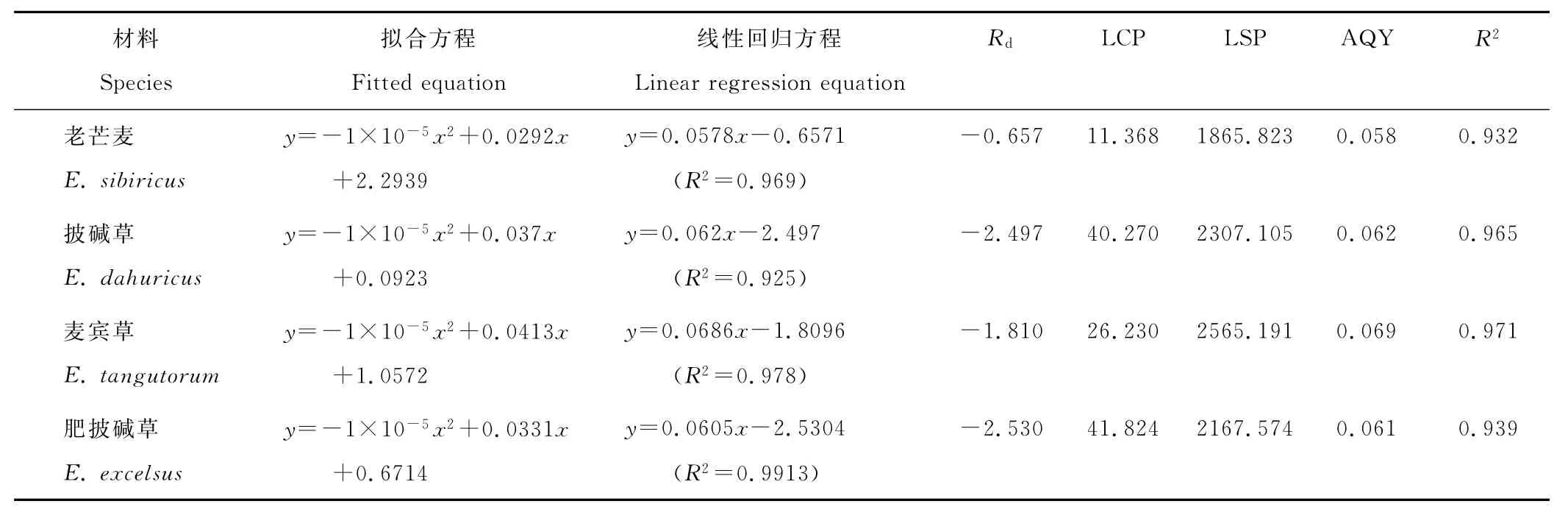
表3 披碱草属植物光响应曲线的特征参数Table 3 Characteristic values of Pn-PAR fit lines for four Elymus species
3 讨论与结论
3.1 4种披碱草属植物光合特性与光强的关系
有效光辐射是植物光合作用的能量来源,与光合过程的各生理特性密切相关[17]。目前,有效光辐射对植物的光合生理特性的研究逐渐成为植物光合生理生态方面的研究热点[18-19]。白伟岚等[20]选择有代表性的8种园林植物,对其不同光照处理下的光合作用及相关生理变化进行了量化测定,归纳出园林植物耐阴性研究的一般顺序;李新国等[21]研究发现银杏叶片遭受强光胁迫后,净光合速率、气孔导度、细胞间隙CO2浓度、表观量子效率都下降;王满莲等[22]对野生与栽培黄花蒿(Artemisiaannua)对光强的响应研究表明强光有利于黄花蒿的生长;杜占池等[23]对扁蓿豆(Melissitusruthenica)、冷蒿(Artemisiafrigida)和木地肤(Kochiaprostrata)枝条净光合速率与光照关系的动态特征进行了研究;史刚荣和蔡庆生[24]对叶片可塑性及其对光强环境的响应进行了探讨,发现白三叶(Trifoliumrepens)在不同光照强度下表皮结构具有可塑性。本试验在模拟光照强度的环境下,4种植物光合参数变化趋势并不完全一致,可能是由于植物种之间的个体差异以及不同植物对同一生境适应的差异性所导致,这与张利刚等[25]和罗亚勇等[26]的研究一致。4种披碱草属植物叶片的净光合速率、气孔导度和蒸腾速率明显增加,而胞间CO2浓度降低。实验结果还显示气孔导度的变化与净光合速率和蒸腾速率的变化趋势基本一致,这与张力文等[27]对鼠尾草(Salviafarinacea)的研究结果一致。4种植物光合速率与Gs之间存在极显著的正相关关系,Pn对Gs的变异非常敏感。4种植物之间Gs的差异是导致Pn、Tr和 WUE之间差异的直接原因,Gs大的植物,利于CO2的扩散,能够增进光合作用。
Vpdl是叶细胞与叶面空气的蒸汽压差值,与叶片蒸腾过程存在密切关系[28-29]。在叶面小环境范围内,Tr增大响应于Vpdl的升高,而植物叶片为了控制过多的水分消耗,又通过Gs的降低控制Tr的增大,三者之间经长期进化形成一个反馈调控机制[30],但在本实验中,短期SPR升高并未见到这一现象(表2),可能是因为在较短的测量时间内,三者之间的反馈调节作用未能显现。肥披碱草和麦宾草的Vpdl值较高,说明蒸腾失水较少,湿度亏缺较大,因而具有较强的保水能力,而老芒麦和披碱草Vpdl值相对较低,蒸腾失水相对较多。
3.2 4种披碱草属植物光响应曲线与光强的关系
植物光合-光响应曲线有2种类型:I型,光合速率随光强增加而达到最高点之后,若继续增加光强,光合速率反而降低,如虎尾草(Chlorisvirgata)和稗草(Echinochloacrusgalli)[30]。Ⅱ型,光合速率随光强增加而达到最高点之后,光强继续增加,光合速率虽不再提高,但在较大光强范围内保持平稳,如竺麻(Boehmeria)[31]、芦苇(Phragmitescommunis)和马莲(Irisensatathunb)[30]等。对于I型曲线,根据江力等[32]在烟草(Nicotianatabacum)上的研究结果,光合速率降低是强光使PSI、PSⅡ及全电子传递活性和碳酸酐酶活性降低所致。本试验中的4种材料光合-光强响应曲线初步可以认为为Ⅱ型,2000μmol/(m2·s)以内的强光对光合速率未表现明显的光抑制作用,可以认为其光合作用系统的稳定性较好。对于2000μmol/(m2·s)以上光合速率随光强的变化情况有待进一步研究。
3.3 4种披碱草属植物光响应曲线特征参数的比较
光是影响光合作用的重要环境因子,对光的广幅适应是植物对环境适应能力强的重要表现[33]。光补偿点较低、光饱和点较高的植物对光环境的适应性较强;而光补偿点较高、光饱和点较低的植物对光照的适应性较弱。不同植物种之间的差别主要在于这些曲线中所包含的相关参数值大小不一。通过结合各项光合生理参数的均值比较,利用综合评判法[34]得出,利用光能的能力高低顺序为:麦宾草>披碱草>老芒麦>肥披碱草,也就是无论在强光或弱光条件下,麦宾草和披碱草光合特征较明显,这在一定程度上表明麦宾草和披碱草对环境的适应性要强。麦宾草和披碱草具有较高的Pn、Gs和LSP,低的Rd,反映其无论在弱光或强光下利用光能的可塑性较强,较高的气孔开闭调节能力有利于光合作用过程中气体和水分的交换,低的暗呼吸速率降低了光合产物的消耗,因而可积累较多的同化产物供给植株生长之需,这类植物为喜光或强喜光植物。老芒麦和肥披碱草具有相对较低的Pn、Tr、Gs和AQY,低的光能利用率与表观量子效率,低的气孔开闭调节能力将影响植物对光能和CO2的利用。
[1] 周海燕,黄子琛.不同时期毛乌素沙区主要植物种光合作用和蒸腾作用的变化[J].植物生态学报,1996,20(2):120-131.
[2] 蒋高明,何维明.一种在野外自然光照条件下快速测定光合作用光响应曲线的新方法[J].植物学报,1999,16(6):712-718.
[3] 张中峰,黄玉清,莫凌,等.岩溶植物光合光响应曲线的两种拟合模型比较[J].武汉植物学研究,2009,27(3):340-344.
[4] Platt T,Gallegos C L,Harrison W G.Photo inhibition of photosynthesis in natural assemblages of marine phytoplankton[J].Journal of Marine Research,1980,38:687-701.
[5] Harrison W G,Platt T.Photosynthesis-irradiance relationships in polar and temperature phytoplankton populations[J].Polar Biology,1986,5(3):153-164.
[6] Falkowski P G,Raven J A.Aquatic Photosynthesis[M].Oxford:Blackwell,1997.
[7] 许大全.光合作用效率[M].上海:上海科技出版社,2002:5-10.
[8] Crane C F,Carman J G.Mechanisms of apomixes inElymusrectisetusfrom East Australia and New Zealand[J].American Journal of Botany,1987,74:456-477.
[9] Bothmer R,Seberg O,Jacobsen N.Genetic resources in the Triticeae[J].Hereditas,1992,116:141-150.
[10] 杨瑞武,周永红,郑有良,等.利用RAPD分析披碱草属、鹅观草属和猬草属模式种的亲缘关系[J].西北植物学报,2001,21(5):865-871.
[11] 马啸,周永红,于海清,等.野生垂穗披碱草种质的醇溶蛋白遗传多样性分析[J].遗传,2006,28(6):699-706.
[12] 陈功,贺兰芳.高寒地区两种老芒麦生态适应性和生产性能评价[J].草业科学,2004,21(9):39-41.
[13] 袁庆华,张吉宇,张文淑,等.披碱草和老芒麦野生居群生物多样性研究[J].草业学报,2003,12(5):44-49.
[14] Ujeeb-Kazi A,Rodriguez R.Cytogenetics ofElymuscanadensisandHordeumvulgare[J].Hereditas,1982,73:77-79.
[15] 卢红双.披碱草属穗型下垂类种质的分类鉴定及其遗传变异分析[D].北京:中国农业科学院,2007.
[16] Berry J A,DowntonW J.Environmental Regulation of Photosynthesis Govindjee ed Photosynthesis (Vol II)[M].New York:Academic Press,1982.
[17] 李美茹,王以柔,刘鸿先,等.光照强度调控4种亚热带森林植物叶片的抗氧化能力[J].植物生态学报,2001,25(4):460-464.
[18] 孙伟,王德利,王立,等.白草(Pennisetumflaccidum)蒸腾特性与水分利用效率对有效光辐射强度和CO2浓度的响应[A].现代草业科学进展[C].中国国际草业发展大会暨中国草原学会第六届代表大会论文集,2002:120-126.
[19] 孙伟,王德利,王立,等.模拟光条件下禾本科植物和藜科植物蒸腾特性与水分利用效率比较[J].生态学报,2003,23(4):814-819.
[20] 白伟岚,任建武,苏雪痕.八种植物耐阴性比较研究[J].北京林业大学学报,1999,21(3):46-52.
[21] 李新国,许大全,孟庆伟.银杏叶片光合作用对强光的响应[J].植物生理学报,1998,24(4):354-360.
[22] 王满莲,韦霄,蒋运生,等.野生与栽培黄花蒿净光合速率对光强和CO2浓度的响应[J].热带亚热带植物学报,2007,15(1):45-49.
[23] 杜占池,杨宗贵.扁蓿豆、冷蒿和木地肤枝条净光合速率与光照关系的动态特征[J].草地学报,1997,5(3):161-167.
[24] 史刚荣,蔡庆生.白三叶叶片解剖可塑性及其对光强的响应[J].草地学报,2006,14(4):301-305.
[25] 张利刚,曾凡江,刘波,等.绿洲-荒漠过渡带四种植物光合及生理特征的研究[J].草业学报,2012,21(1):103-111.
[26] 罗亚勇,赵学勇,张静辉,等.科尔沁沙地不同氮素生境和功能型植物的光合作用与水分利用特性[J].草业学报,2012,21(3):206-212.
[27] 张力文,钟国成,张利,等.3种鼠尾草属植物光合作用-光响应特性研究[J].草业学报,2012,21(2):70-76.
[28] Zu Y G,Yin X F,Zhang W H,etal.Gas exchange and water use efficiency ofAdenophoralobophylla(Campanulaceae)at different altitudes on the east boundary of the Qing-Zang plateau[J].Acta Botanica Sinica,1998,40(10):947-954.
[29] Yu Q,Wang T D.Simulation of the physiological responses of C3plant leaves to environmental factors by a model which combines stomatal conductance,photosynthesis and transpiration[J].Acta Botanica Sinica,1998,40(8):740-754.
[30] 迟丽华,宋凤斌.松嫩平原4种植物光合作用光响应特性的研究[J].吉林农业大学学报,2007,29(2):119-122.
[31] 郭清泉.苎麻不同品种叶片光合特性及其与产量形成关系的研究:Ⅱ叶片光合生理[J].湖南农学院学报,1993,19(6):550-557.
[32] 江力,曹树青,戴新宾,等.不同光照强度对烟草光合作用的影响[J].中国烟草学报,2000,6(4):17-20.
[33] 孙旭生,林琪,赵长星,等.施氮量对超高产冬小麦灌浆期旗叶光响应曲线的影响[J].生态学报,2009,29(3):1428-1436.
[34] 刘家琼,黎志坚,蒲锦春,等.我国沙漠中部地区主要不同生态类型植物脯氨酸的累积、光合、呼吸和叶绿素含量[J].植物学报,1988,30(1):85-95.

