N-乙酰半胱氨酸对体外循环大鼠血脑屏障功能的影响
曹惠鹃,周 锦,孙莹杰,姚 婧,张铁铮
·基础研究·
N-乙酰半胱氨酸对体外循环大鼠血脑屏障功能的影响
曹惠鹃,周 锦,孙莹杰,姚 婧,张铁铮
目的探讨N-乙酰半胱氨酸(NAC)对体外循环(CPB)大鼠血脑屏障功能(BBB)的影响。方法将36只成年雄性SD大鼠随机分为3组:假手术组(S组)、CPB组(C组)、CPB+NAC组(N组)。N组在预充液中加入NAC 100 mg/kg,然后以20 mg/(kg·h)速度输注直到停转流,C组输注等量生理盐水。停CPB后2 h,采集上腔静脉血测定血浆肿瘤坏死因子-α(TNF-α)和白细胞介素-6(IL-6)水平。每组随机取6只测脑组织伊文思蓝(EB)含量,另6只做脑组织脑丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-px)含量测定和大鼠BBB超微结构的观察。结果N组血浆TNF-α和IL-6水平,脑组织MDA、GSH-px和EB含量均显著优于C组;N组海马区BBB超微结构的损伤程度也较C组明显减轻。结论NAC可减轻CPB大鼠BBB的损伤程度,其机制可能与其抗炎、抗氧化作用有关。
N-乙酰半胱氨酸;体外循环;血脑屏障
体外循环(cardiopulmonary bypass,CPB)可使血脑屏障(blood-brain barrier,BBB)功能失调[1],BBB功能障碍可导致心脏手术后的神经并发症。CPB继发BBB功能失调的病因尚不清楚,但与CPB期间的低灌注状态、缺血/再灌注、炎性介质及血管
内微栓等密切相关。N-乙酰半胱氨酸(N-acetylcysteine,NAC)是细胞维持正常生理功能的重要化合物-谷胱甘肽(GSH)的前体物质,对氧化应激、缺血再灌注损伤等有一定的防治作用。本研究通过建立大鼠CPB模型,探讨NAC对CPB大鼠BBB功能的影响。
1 资料与方法
1.1 动物选择与分组 沈阳军区总医院实验动物中心提供的健康雄性清洁级Sprague-Dawley大鼠36只,4~6个月龄,体重330~400 g,按随机数字表分为3组:假手术组(S组)、CPB组(C组)、CPB+ NAC组(N组),每组12只。S组仅置管,不进行CPB;C组和N组进行CPB 1 h,然后观察2 h。N组在预充液中加入NAC(美国Sigma公司,批号A-7250)100 mg/kg,然后以20 mg/(kg·h)速度输注1 h直到停转流,C组输注等容量生理盐水。停CPB后2 h,采集上腔静脉血测定血浆肿瘤坏死因子-α(TNF-α)和白细胞介素-6(IL-6)水平。每组随机取6只测脑组织伊文思蓝(Evans blue,EB)含量,另6只做脑组织脑组织丙二醛(MDA)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-px)含量测定和大鼠BBB超微结构的观察。
1.2 实验材料 恒流蠕动泵(BT00-300M型,保定兰格恒流泵有限公司),配套硅胶管(内径4 mm),大鼠专用膜式氧合器(表面积0.05 m2,预充液3 ml,广东科威医疗器械有限公司),小动物呼吸机(TKR-200C型,江西省特力麻醉呼吸设备公司),多功能监测仪(日本光电公司),全自动温血仪(美国BIGGER公司),电子天平(FA314型,上海海康电子仪器厂),分光光度计(CM3500D型,日本美能达),伊文思蓝(美国Sigma公司),TNF-α和IL-6放免试剂盒(天津九鼎医学生物工程有限公司),MDA、GSH -px测试盒(南京建成生物工程研究所),透射电镜(JEM-1200EX型,日本电子公司)。
1.3 CPB方法大鼠在实验前禁食、水6 h。腹腔注射10%水合氯醛350 mg/kg麻醉,窥喉后经口气管插管,接呼吸机行机械通气,吸入氧浓度1.0,调整潮气量和呼吸频率维持呼气末二氧化碳32~42 mm Hg。CPB环路连接、管道预充及管理参照文献[2]介绍的方法。
1.4 标本留取及检测
1.4.1 脑组织EB含量的测定 参照Ding-Zhou L等的方法[3],应用EB作为示踪剂,监测BBB的损伤程度,计算出每克组织的EB含量(μg/g)。
1.4.2 脑组织MDA、GSH-px含量测定 低温下取脑组织,制备10%的脑组织匀浆,根据测定试剂盒说明书对每毫克脑组织匀浆中MDA、GSH-px进行测定。
1.4.3 血浆TNF-α和IL-6浓度的测定 应用放射免疫分析法测定大鼠血浆TNF-α和IL-6浓度。
1.4.4 透射电镜观察 将取出的大鼠左侧海马区脑组织小块,置入1%锇酸固定,乙醇梯度脱水,环氧树脂包埋后切片,铀、铅双染色,置于透射电镜下观察海马区神经元细胞的超微结构。
1.5 统计学处理 应用SPSS17.0统计软件进行分析,计量资料以均值±标准差(±s)表示,组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 脑组织EB含量 与S组比较,其余组大鼠海马区脑组织EB含量升高,差异均有统计学意义(P<0.05);与C组比较,N组海马区脑组织EB含量降低(P<0.05),见表1。
2.2 脑组织MDA和GSH-px含量的变化 与S组比较,其余组脑组织MDA含量升高(P<0.05)、GSH-px含量降低(P<0.05);与C组比较,N组脑组织MDA降低(P<0.05)、GSH-px含量升高(P<0.05),见表1。
2.3 血浆TNF-α和IL-6水平的变化 与S组比较,C组和N组血浆TNF-α和IL-6水平均升高(P<0.05);与C组比较,N组血浆TNF-α和IL-6水平均降低(P<0.05),见表1。
2.4 BBB超微结构的改变 S组BBB基膜均匀一致,完整性良好,内皮细胞间的紧密连接完整。C组BBB基膜变厚,内皮细胞不均匀,微血管腔狭窄,红细胞运行受阻,内皮细胞间紧密连接不清。N组BBB基膜轻微肿胀,红细胞运行不受限,内皮细胞间的紧密连接清晰,见图1~3。
表1 各组脑组织EB、MDA和GSH-px含量及血浆TNF-α和IL-6水平的比较(±s)

表1 各组脑组织EB、MDA和GSH-px含量及血浆TNF-α和IL-6水平的比较(±s)
注:与S组比较∗P<0.05;N组与C组比较#P<0.05
项目S组C组N组EB含量(μg/g)0.67±0.215.85±0.81∗2.03±0.47∗#MDA(nmol/mg)15.02±4.3870.54±26.27∗31.09±12.65∗#GSH-px(U/mg)2.93±0.612.00±0.32∗2.45±0.43∗#TNF-α(μg/L)0.92±0.162.55±0.82∗1.70±0.61∗#IL-6(ng/L)56.84±8.87173.34±39.22∗96.45±23.63∗#
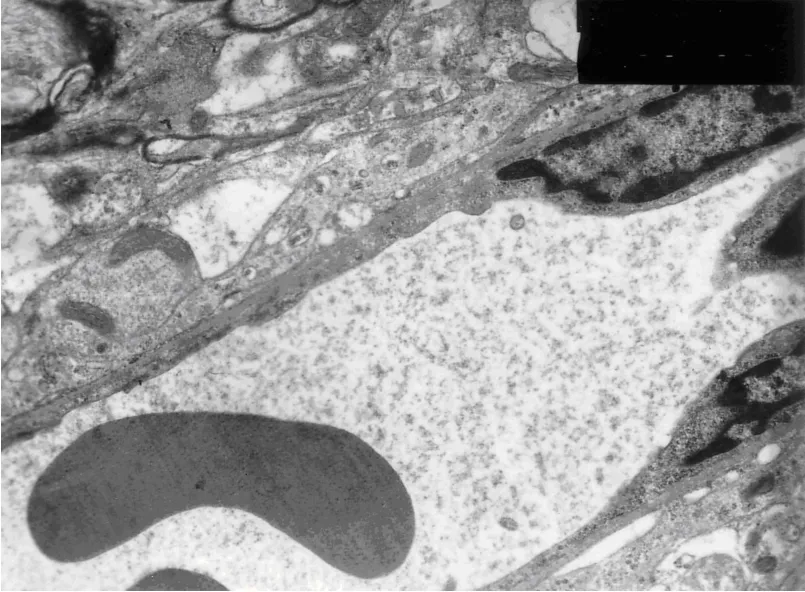
图1 S组电镜结果(×7200)

图2 C组电镜结果(×7200)
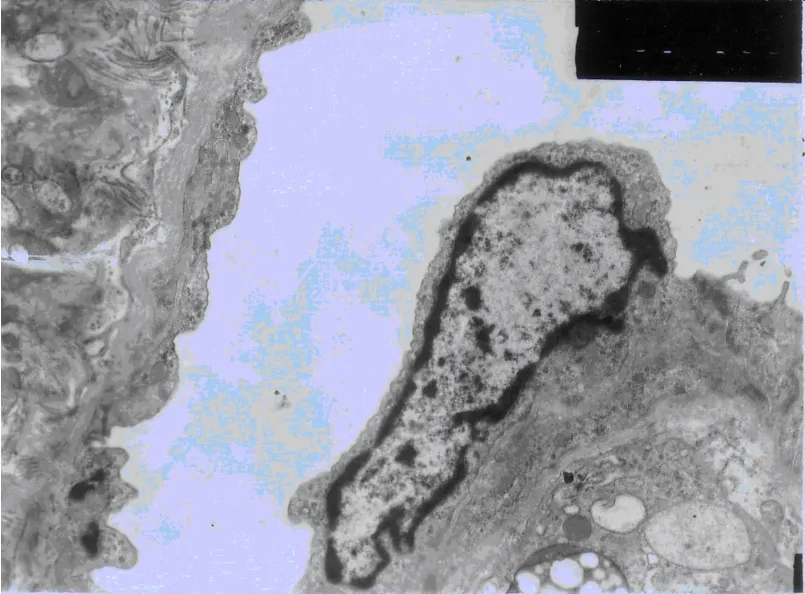
图3 N组电镜结果(×7200)
3 讨 论
脑神经损伤是心脏外科手术的一个严重的并发症。损伤的严重程度从轻微的认知功能障碍到中风,增加住院时间、费用和康复需求,并导致生活质量下降[4]。BBB是由脑毛细血管内皮细胞、基膜和神经胶质膜构成的血浆与脑细胞外液间的屏障,对脑的营养物质供应、维持神经系统内环境的相对稳定和保持神经元一定的功能等方面起重要作用。BBB破坏是脑损伤的危险因素,并可引发一系列神经、精神并发症。CPB可增加BBB的通透性[1],使BBB功能失调,导致心脏手术后的神经并发症。
NAC是广泛应用的抗氧化剂,具有潜在的抗氧化和抗炎作用。NAC通过中和氧自由基、保护细胞膜、维持内皮细胞功能发挥保护作用[5]。研究表明,在损伤后静脉应用NAC能显著改善缺氧复氧新生猪的颈动脉血流和氧供,减少脑皮质caspase-3和脂质过氧化物含量的增加[6]。在预充液中加入NAC,能够减轻CPB对大鼠的肾损伤,且呈剂量依赖性[7]。而NAC对CPB所诱导的BBB损伤是否具有保护作用,国内外罕见报道。心胸手术过程中应用CPB使机体与非生理表面接触、非搏动血流、低灌注状态等可激活氧化应激反应和全身炎症反应。因此,选用具有抗氧化性质的试剂减轻氧化应激和氧化应激引起的炎症反应,探讨其对CPB大鼠BBB结构和功能的影响。
EB属于一种常用的染料制剂,因其分子量大小与血液中的白蛋白相近,并可与血液中的白蛋白结合,因此,常被用于作为观察BBB完整性的示踪剂。本实验结果显示,进行CPB的大鼠脑组织EB含量明显高于假手术组,说明CPB可使BBB结构受损,导致屏障作用减弱,通透性增加,使生理状态下不能通透的物质穿越BBB进入组织间隙,继发血管源性脑水肿。而N组海马区脑组织EB含量降低,表明一定剂量的NAC可减轻CPB对大鼠BBB的损伤。电镜结果也表明,CPB使BBB超微结构发生一定程度的改变,一定剂量的NAC可减轻BBB超微结构的改变。
TNF-α是引起炎性级联反应的一个重要而又具有广泛生物学活性的细胞因子,它也是炎症反应释放最早和最重要的内源性介质。IL-6是脑损伤炎症反应链中的一种重要炎性细胞因子,主要通过诱导最初的炎性级联反应、诱导血管内皮黏附因子表达、增强兴奋性氨基酸毒性作用、降低脑血流、增加血脑屏障通透性等机制在继发性脑损伤中发挥作用[9]。基于上述原因,以TNF-α和IL-6作为反映CPB中炎性反应的指标。本研究结果表明,NAC可减少CPB诱导的大鼠脑组织MDA含量的升高及GSH-px含量的降低,可降低血浆TNF-α、IL-6水平的升高,提示NAC可降低CPB所诱发的氧化应激和炎症反应程度。
综上所述,在CPB过程中应用一定剂量的NAC可减轻CPB大鼠BBB的损伤,其机制可能与其抗炎、抗氧化作用有关。
[1]Okamura T,Ishibashi N,Zurakowski D,et al.Cardiopulmonary bypass increases permeability of the blood-cerebrospinal fluid barrier[J].Ann Thorac Surg,2010,89(1):187-194.
[2]Cai DS,Jin BB,Pei L,et al.Protective effects of penehyclidine hydrochloride on liver injury in a rat cardiopulmonary bypass model[J].Eur J Anaesthesiol,2010,27(9):824-828.
[3]Ding-Zhou L,Marchand-Verrecchia C,Croci N,et al.LNAME reduces infarction,neurological deficit and blood-brain barrier disruption following cerebral ischemia in mice[J].Eur J Pharmacol,2002,457(2-3):137-146.
[4]Allen JG,Weiss ES,Wilson MA,et al.Hawley H.Seiler Resident Award.Transcriptional profile of brain injury in hypothermic circulatory arrest and cardiopulmonary bypass[J].Ann Thorac Surg,2010,89(6):1965-1971.
[5]Bemeur C,Vaquero J,Desjardins P,et al.N-acetylcysteine attenuates cerebral complications of non-acetaminophen-induced acute liver failure in mice:antioxidant and anti-inflammatory mechanisms[J].Metab Brain Dis,2010,25(2):241-249.
[6]Liu JQ,Lee TF,Chen C,et al.N-acetylcysteine improves hemodynamics and reduces oxidative stress in the brains of newborn piglets with hypoxia-reoxygenation injury[J].J Neurotrauma,2010,27(10):1865-1873.
[7]Zhu J,Yin R,Shao H,et al.N-acetylcysteine to ameliorate acute renal injury in a rat cardiopulmonary bypass model[J].J Thorac Cardiovasc Surg,2007,133(3):696-703.
[8]Winter CD,Pringle AK,Clough GF,et al.Raised parenchymal interleukin-6 levels correlate with improved outcome after traumatic brain injury[J].Brain,2004,127(Pt 2):315-320.
Protective effects of N-acetylcysteine on blood-brain barrier in the rat cardiopulmonary bypass model
Cao Hui-juan,Zhou Jin,Sun Ying-jie,Yao Jing,Zhang Tie-zheng
Department of Anesthesiology of the General Hospital of ShenYang Military Region,Liaoning Shenyang 110016,China
Zhou jin,Email:zhoujin6@126.com
ObjectiveTo investigate the protective effects of N-acetylcysteine(NAC)on blood-brain barrier(BBB)in the rat cardiopulmonary bypass(CPB)model.MethodsThirty-six male adult Sprague-Dawley rats were randomly divided into three groups(twelve for each group),including sham-operated control group(group S),vehicle control group(group C)and CPB plus NAC group(group N).Rats in group N were treated with NAC 100 mg/kg into CPB prime followed by infusion at 20 mg/(kg·h)until the cessation of CPB,and rats in group C were treated with the same volume of natural saline.The samples of plasma and brain tissue were collected two hours after CPB.The plasma levels of tumor necrosis factor-α(TNF-α)and interleukin-6(IL-6)were determined.Took six rats of each group to measure the Evans blue content of brain tissue,took the other six to determine the contents of brain tissue of malondialdehyde(MDA),glutathione peroxidase(GSH-px)and observe the ultrastructure of BBB.ResultsThe plasma levels of TNF-α,IL-6 in group N were significantly better than those of group C.The contents of brain tissue of MDA,GSH-px and Evans blue in group N were significantly better than those of group C.Compared with group C,the damage degree of ultrastructure of hippocampal BBB in group N was significantly reduced.ConclusionNAC could reduce the injury of BBB inducced by CPB in the rat model by antioxidant and anti-inflammatory mechanisms.
N-acetylcysteine;Cardiopulmonary bypass;Blood-brain barrier
R654.1
A
1672-1403(2013)01-0034-04
2011-12-19)
2012-03-17)
110016沈阳,沈阳军区总医院麻醉科[曹惠鹃(博士研究生)]
周锦,Email:zhoujin6@126.com

