细胞因子提取液对心肌细胞活力的影响
刘 杰,陈 婷,易 军,陈光辉,陈韵岱
细胞因子提取液对心肌细胞活力的影响
刘 杰,陈 婷,易 军,陈光辉,陈韵岱
目的探讨不同浓度细胞因子提取液对心肌细胞活力的影响。方法本研究利用培养乳鼠的心肌细胞,用台盼蓝染色法检测细胞存活率,倒置显微镜下观察细胞形态变化及其搏动率。细胞因子提取液以0、1%、5%、10%、20%、40%浓度对培养48 h的心肌细胞进行刺激,继续培养至96 h,用甲基噻唑基四唑(MTT)法测定各组光密度(OD)值,其中以0组作为对照组。结果发现在培养过程中加入不同浓度细胞因子提取液刺激心肌细胞48 h后,由低浓度到高浓度,心肌细胞MTT产物的OD值依次为:(0.3456±0.0327)、(0.3044±0.1914)、(0.3052±0.1112)、(0.3354±0.2816)、(0.4902±0.2749)、(0.018±0.045),其中1%、5%与对照组比较P>0.05,无统计学差异,其它组分别与对照组比较P<0.05,有显著性差异。细胞存活率均在95%以上。结论10%、20%细胞因子提取液能高心肌细胞的活力。
细胞因子提取液;细胞活力;心肌细胞;MTT
细胞因子(stem cell factor,SCF)提取液一经发现立即引起各国学者的浓厚兴趣及极大的重视,一些生物技术公司也将其作为开发的重要目标。美国Amgen公司研究人员率先开发了该因子,并证明该因子的疗效[1]。军事医学科学院生物工程研究所完成了对人SCF基因的克隆和高效表达[1]。近年来越来越多的研究展示了细胞因子在急性心肌梗死(acute myocardial infarction,AMI)治疗方面的较好的前景,其血管和心脏的再生功能弥补了传统的经皮冠状动脉介入治疗在微血管病变和心肌梗死后心功能恢复方面的不足[2]。本研究的目的是探讨此种细胞因子提取液对正常心肌细胞的增殖及细胞活力的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物 选择出生第2~3 d的SD乳鼠,雌雄不限(由解放军总医院动物室提供)。
1.1.2 主要仪器与试剂 培养瓶和培养板(Coring),超净工作台,离心机,CO2培养箱(Heraeus),相差显微镜(OLYMPUS),恒温水浴箱,酶标仪(Biotek),胎牛血清(杭州四季青),DMEM高糖培养基(Hyclon),胰蛋白酶(Sigma),细胞因子提取液(中科富华生物技术有限公司)。
1.2 方法
1.2.1 原代心肌细胞的分离 取2~3 d的SD乳鼠,无菌条件下开胸取心尖部,用预冷的PBS洗涤3遍。将心肌剪成约1 mm3大小,越小越好;用0.0625%胰蛋白酶在37℃恒温水浴箱中消化心肌组织。消化过程中采用分次消化时间(8 min×6次),第一次消化后自然沉淀并弃上清,以后自然沉淀后取上清;每次分离的上清液加等量含10%胎牛血清的DMEM培养液轻轻吹打终止消化,制成细胞悬液。第一次得到的细胞悬液存放在4℃冰箱保存以保持细胞活性。重复6次,用220目细胞筛过滤细胞悬液,制成单细胞悬液。1 000 r/min离心10 min,弃上清,加入10%DMEM培养基,放入CO2培养箱[3]。
1.2.2 心肌细胞的培养 细胞悬液放5%CO2培养90 min后,采用差速贴壁分离技术,吸取培养瓶中的的细胞悬液,加入BRDU浓度为0.1 mmol/L,调整细胞悬液的细胞数为106/ml,将细胞接种于96孔培养板中和培养皿中,继续培养,24 h后换液,以后隔日换液。
1.2.3 细胞生长曲线 原代细胞分离后,调整细胞密度、接种及培养方法同1.2.2。24 h后,用MTT法测定OD值,每组各5个副孔,2个空白孔,测定至细胞出现平台期。记录不同时间的OD值,并以时间为横坐标,以OD值为纵坐标,绘制细胞生长曲线。
1.2.4 MTT法测定 调整细胞密度、接种及培养方法同1.2.2。细胞培养48 h后,分为两组,每组各5个副孔。对照组用含10%的胎牛血清继续培养,另1组按细胞因子浓度0、1%、5%、10%、20%、40%进行刺激,继续培养。细胞培养48 h加入MTT 20 μl,37℃5%CO2继续培养4 h,弃去上清,每孔加入150二甲基亚砜,震荡10 min混匀,自动酶标仪490 nm测OD值。每孔OD值减去空白孔OD值为测试孔OD值。
1.2.5 心肌细胞存活率测定 分别计数,不同浓度组及对照组的培养细胞。取0.4%的台盼蓝液100 μl、细胞悬液100 μl、PBS 800 μl,取10 μl滴于细胞计数板上,在倒置相差显微镜下计数四个大方格内的细胞总数、未染成蓝色的活细胞数,计数10次,取平均值。细胞存活率(%)=活细胞数/总细胞数×100。
1.2.6 心肌细胞搏动次数的测定 心肌细胞培养24~48 h,在倒置显微镜下观察不同浓度组及对照组每分钟心肌搏动次数,随机计数10个不同视野中的心肌细胞搏动次数。
1.2.7 心肌细胞的鉴定 用免疫细胞化学法鉴定心肌细胞,细胞培养心肌细胞进行纯度鉴定,用横纹肌肌动蛋白(ɑ-actin)单克隆作为一抗,用SABC法进行免疫细胞化学染色。
1.2.8 统计方法 采用SPSS13.0软件对资料进行分析,多组均数比较采用单因素方差分析,两两比较采用LSD法,所用结果用均数±标准差(±s)表示,P<0.05为具有显著意义
2 结果
2.1 心肌细胞生长曲线 心脏成纤维及内皮细胞在90 min内基本已贴壁。未贴壁细胞培养24 h后,在倒置显微镜下可观察到心肌细胞呈梭形,不规则星形可见单个细胞搏动。培养48 h后,伪足相互交织成网,形成单层细胞,出现节律收缩运动,每分钟30至90次不等。见图1。
2.2 心肌细胞存活率结果 不同浓度细胞因子提取液刺激心肌细胞48 h后,继续培养至96 h。浓度1%、5%与对照组比较无统计学意义(P>0.05),其它组分别与对照组比较有显著性差异(P<0.05)。见图2、3、4。
2.3 不同浓度细胞因子提取液对心肌细胞的增殖及细胞活力的影响 不同浓度细胞因子提取液刺激心肌细胞48 h后,继续培养至96 h。浓度1%、5%与对照组比较无统计学意义(P>0.05),其它组分别与对照组比较有显著性差异(P<0.05)。见图5。
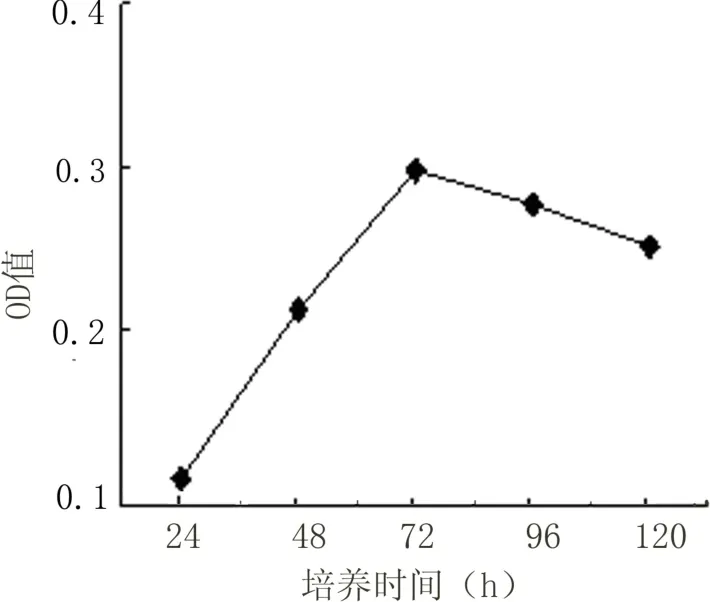
图1 心肌细胞生长曲线
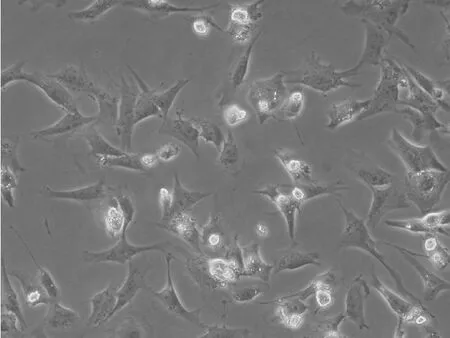
图2 对照组心肌细胞培养96 h
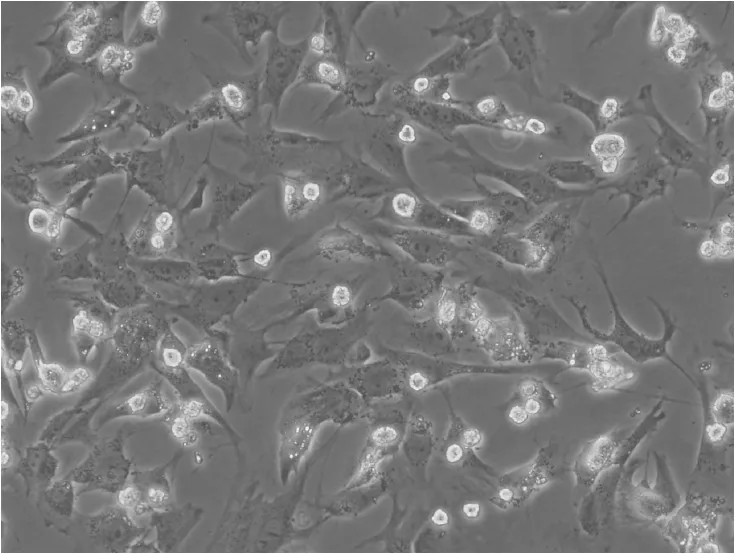
图3 20%细胞因子提取液培养96 h
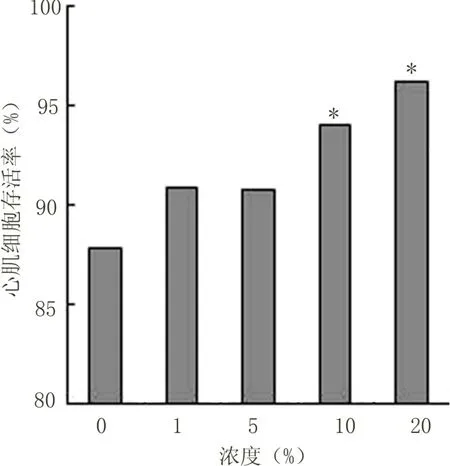
图4 心肌细胞培养96 h存活率
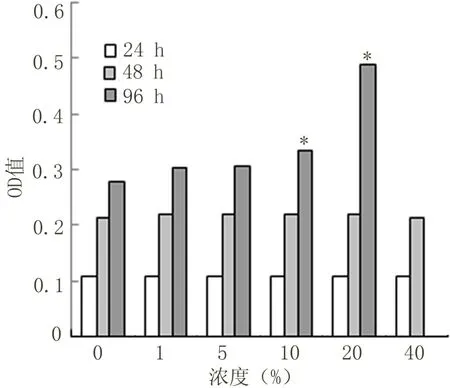
图5 不同浓度细胞因子提取液对心肌细胞的影响
2.4 心肌细胞搏动次数测定结果 不同浓度细胞因子提取液刺激心肌细胞48 h后,继续培养至96 h。浓度1%、5%、10%、20%与对照组比较无统计学意义(P>0.05),浓度40%与对照组比较有显著性差异(P<0.05)。见图6。
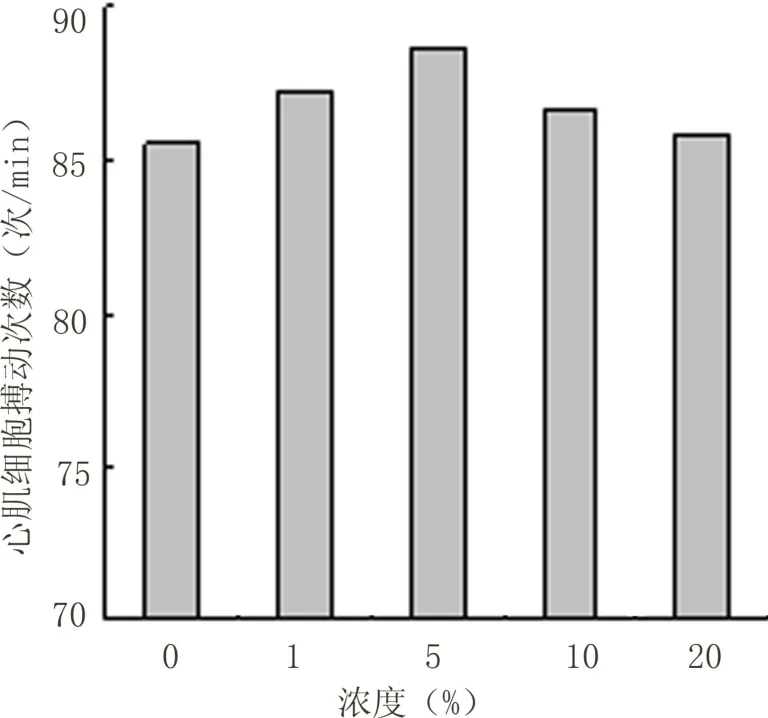
图6 心肌细胞培养96 h每分钟搏动次数
3 讨 论
细胞因子是由骨髓微环境的基质细胞产生的一种酸性糖蛋白。其糖基连在肽键的N和O集团上,相对分子量为(31~36)×103,由非共价键结合的两个相同亚基组成,分为可溶性SCF蛋白编码248个氨基酸,有跨膜区,在第6外显子中有一蛋白酶切位点,经蛋白酶水解去掉跨膜区,最终产物为N末端165氨基酸,仍可溶性,并具有干细胞因子活性;膜结合型SCF蛋白编码220个氨基酸,有跨膜区[4]。近年来发现细胞因子具有十分重要的生理功能。它参与机体发育中的多种细胞的生长调控,是多种哺乳动物干细胞增殖分化的关键因子[4]。
有研究显示急性心肌梗死本身引起的外周血SCF浓度升高和干细胞数量的增多,这些干细胞数量的增多可能与体内的SCF浓度有关[2]。Kuhlmann等[5]在心肌梗死鼠的模型上更深入的发现SCF除了可以促进心肌梗死局部的心肌血管的新生,还可以上调心肌梗死处的缝隙连接因子的表达,从而减少心肌梗死后的恶性心率失常。本研究显示,通过细胞因子提取液对体外培养心肌细胞刺激24 h后,心肌细胞的OD值比对照组明显升高。
通过试验可以看出本研究的10%、20%细胞因子提取液能高心肌细胞的活力。本实验细胞培养24 h后加入不同浓度细胞因子提取液继续培养心肌细胞,48 h后细胞,其中20%浓度的OD值(0.4902±0.2749)与对照组比较有显著性差异。根据活细胞线粒体在能量代谢过程中可作用于MTT产生蓝紫色结晶产物这一原理,测定细胞因子提取液对培养中心肌细胞的增殖及活力的影响。MTT法强调MTT反应所形成的甲臜结晶,取决于活细胞的数量和其新陈代谢的强度,而死细胞不发生反应,无结晶产生,使其反应更加准确[6]。MTT为淡黄色唑氮盐,是线粒体脱氢酶的作用底物,当与活细胞共同孵育时可以被具有活性的线粒体脱氢还原为不溶于水的蓝色结晶,将其溶于有机溶剂后可用比色法测定其吸光度(OD)值,OD值越大反应脱氢酶活性越大,活细胞的数量就越多,细胞的新城代谢就越旺盛。
综上所述,笔者认为,细胞因子提取液能够促进心肌细胞的活性,且20%细胞因子提取液能高效提高心肌细胞的活力。
[1]刘驰,李晁金子.细胞因子对心肌细胞增殖的作用[J].现代实用医学,2008,20(9):741-743.
[2]严轶文,戴秋艳,张治,等.急性心肌梗死患者外周血干细胞及干细胞因子的变化[J].中华老年心脑血管病杂志,2007,9(2):82-85.
[3]马芳芳,沈晓丽,林立芳,等.新生大鼠心肌细胞的原代培养[J].心血管康复医学杂志,2009,18(2):125-127.
[4]潘玥,张鸣,谭顺革.干细胞因子研究概况[J].国外医学临床生物化学与检验学分册,2005,26(9):597-595.
[5]Kuhlmann MT,Kirchof P,Klocke R,et al.G-CSF/SCF reduces inducible a nhythmias in the infarcted heart potentially via increased connexin43 expression and arteriogenesis[J].J Exp Med,2006,203(1):87-97.
[6]陈光辉,祝善俊,刘莉,等.血管紧张素Ⅱ对心肌细胞活力的影响[J].军医进修学院学报,2000,21(4):267-269.
The effects of cell factor extract on the viability of cardiac myocyte
Liu Jie,Chen Ting,Yi Jun,Chen Guang-hui,Chen Yun-dai
Institute of Geriatric Cardiology,PLA General Hospital,Beijing 100853,China
Chen Guang-hui,Email:chen kevin301@msn.com
ObjectiveOur study sought to investigate the effects of different cytokine extract concentration on the viability of cardiomyocytes.MethodsCell survival rate was detected by trypan blue staining,and we observed the cell morphological change and pulsation under the inverted microscope.The cytokine extracts of increasing concentrations ranging from 0%to 40%were added to the culture medium to stimulate the cardiomyocytes that had been cultivated for 48 hours.Fourty hours later,we used MTT to measure OD of each group.ResultsOur result showed that the survival rates of all the groups were above 95%.The OD of the control group was 0.3456±0.0327.The ODs of other groups were as follows:0.3044±0.1914(1%group),0.3052±0.1112(5%group),0.3354±0.2816(10%group),0.4902±0.2749(20%group)and 0.018±0.045(30%group).The ODs of 10%group and 20%group were significantly higher than that of the control group.ConclusionThe cytokine extracts of concentration at 10%and 20%could improve the viability of cardiomyocytes.
Cell factor extract;Cell viability;Cadiocyte;MTT
R654.1
A
1672-1403(2013)03-0186-04
2013-05-06)
2013-06-20)
100853北京,中国人民解放军总医院心内科
陈光辉,Email:chen kevin301@msn.com

