武汉市370例变应性接触性皮炎患者斑贴结果
陈 浩,李文静,黄 南,冯 伟,胡林涛,王晓龙,祝戎飞
(华中科技大学 同济医学院 附属同济医院过敏反应科,武汉 430030)
变应性接触性皮炎(allergic contact dermatitis,ACD)是接触物半抗原诱发T细胞介导免疫反应,从而导致皮肤炎性改变的一种皮肤疾患。由于引起ACD的变应原种类繁多且发病率呈逐年上升的趋势,这类疾病已成为威胁公共安全的重大问题。欧洲多个国家已经限制了引起ACD最常见的变应原(如硫酸镍等)在日常消费品中的使用,并对职业环境等暴露危险因子进行了防护,已取得较好效果。但是,目前中国ACD的发病并未得到有效控制。找出变应原、避免接触是疾病不再复发的重要保障。斑贴试验作为一种有效的诊断方法,具有成本低、操作简单、安全性好、结果准确可靠的优势,是诊断ACD的金标准。为了解武汉地区引起ACD的主要变应原及其与性别、年龄、职业、发病部位的关系,本研究对武汉地区ACD患者的斑贴结果进行回顾性分析,以期更好地为临床提供参考依据。
对象和方法
对象及分组
选择2010年1月至2012年12月华中科技大学同济医学院附属同济医院过敏反应科的ACD门诊患者,诊断均符合其标准[1],即有变应原接触史;出现边界清楚的瘙痒性湿疹样皮疹,呈急性(水疱及渗出)或慢性(苔藓化和鳞屑性版块)表现;局限于接触部位的或散在的播散性皮损。所有患者全部进行斑贴试验,分组遵循MOAHLFAP标准[2]。
入选标准
病例符合ACD的诊断标准。起病前无特殊饮食史,怀疑为ACD但接触性变应原不明确。斑贴试验前2周未系统使用皮质内固醇激素,斑贴试验前7 d未用免疫抑制剂,试验前3 d未使用抗组胺药。
排除标准
(1)测试部位皮肤有痤疮、毛囊炎、疖肿及溃疡、糜烂等皮损;(2)ACD处于急性发作期;(3)妊娠及哺乳期妇女。
斑贴试验
试剂及方法:采用“瑞敏”斑贴试验变应原,由北京元康医学实用技术有限责任公司提供,批号为国食药监械(进)字2005第1400334号。将已知添加赋形剂抗原置于由惰性聚乙烯塑料制成的斑贴小室中,固体试验物加入约0.02 g,液体试验物取0.02 ml浸湿滤纸后置于测试芯室,并做好标记。将加有抗原的斑贴测试器贴附于脊柱两侧的正常皮肤,粘贴好后用手指轻压每个小室使其中的抗原均匀地接触皮肤。48 h后将斑试物除去,30 min后肉眼判读结果,再过24 h后最终判读结果。必要时可于1周内继续观察,如有新发皮疹、瘙痒或原有皮疹红斑进行性加重,可考虑进行再1次结果判读,以便某些变应原引发反应的时间不够,影响阳性率[3]。不符合上述观察要求及检查中途斑试物脱落的病例予以剔除。
结果判读:根据国际接触性皮炎研究组(International Contact Dermatitis Research Group,ICDRG)规定标准[4]判读结果:阴性反应(-),即受试局部皮肤无任何改变;可疑反应(±),即受试皮肤仅有轻度红斑;弱阳反应(+),即出现红斑、浸润、可有少量丘疹;强阳反应(++),即出现红斑、浸润、丘疹、水疱;极强反应(+++),即出现红斑、浸润明显、丘疹、水疱、大疱。由专业人员操作及判读结果,(-)及(±)在72 h后加剧者记为阳性反应。在判读结果时,注意变态反应与刺激性反应的鉴别,将刺激性反应标记为IR,在计算阳性率时需排除IR、(-)及(±)的患者。
统计学处理
应用SPSS17.0软件,统计方法为卡方检验和Fisher精确概率法。比较ACD患者斑贴结果中变应原在不同年龄、性别、职业及发病部位中的差别,P<0.05为差异有统计学意义。
结 果
一般情况
共纳入患者370例,男96例,女274例。年龄为5~74岁,平均(33.71±13.77)岁;其中,年龄≤40岁者252例,>40岁者118例。办公室工作人员67例,老师和学生91例,美容美发行业35例,医务工作者32例,建筑工人18例,家庭主妇67例,无职业者60例。ACD发作部位在面部者113例,手部者83例,躯干和四肢(排除手部)者174例。
斑贴试验结果
所有370例ACD患者中,斑贴试验阳性者284例,总阳性率为76.76%。其中,阳性率居前5位的变应原依次为硫酸镍(34.32%),芳香混合物(18.65%),氯化钴(18.38%),重铬酸钾(17.30%)和甲醛(12.70%)。极强阳性率居前4位的依次为硫酸镍(12.70%),芳香混合物(4.05%),对苯二胺基质(3.51%)和甲醛(1.08%)(表1)。阴性或可疑反应86例,占总人数的23.24%。
1种变应原致敏者131例,占35.41%;2种变应原致敏者73例,占19.73%;3种变应原致敏者42例,占11.35%;4种变应原致敏者21例,占5.68%;5种及以上变应原致敏者17例,占4.59%。金属盐类变应原如氯化钴、重铬酸钾、硫酸镍阳性经常同时存在于同一个体。金属盐变应原致敏者160例,占总例数的43.24%。其中单一氯化钴阳性者17例,单一重铬酸钾阳性者22例,单一硫酸镍阳性者85例,而这3种金属盐变应原中的2种及全部阳性者共36例,超过单一氯化钴或重铬酸钾阳性例数。其余86例为阴性及可疑阳性者。
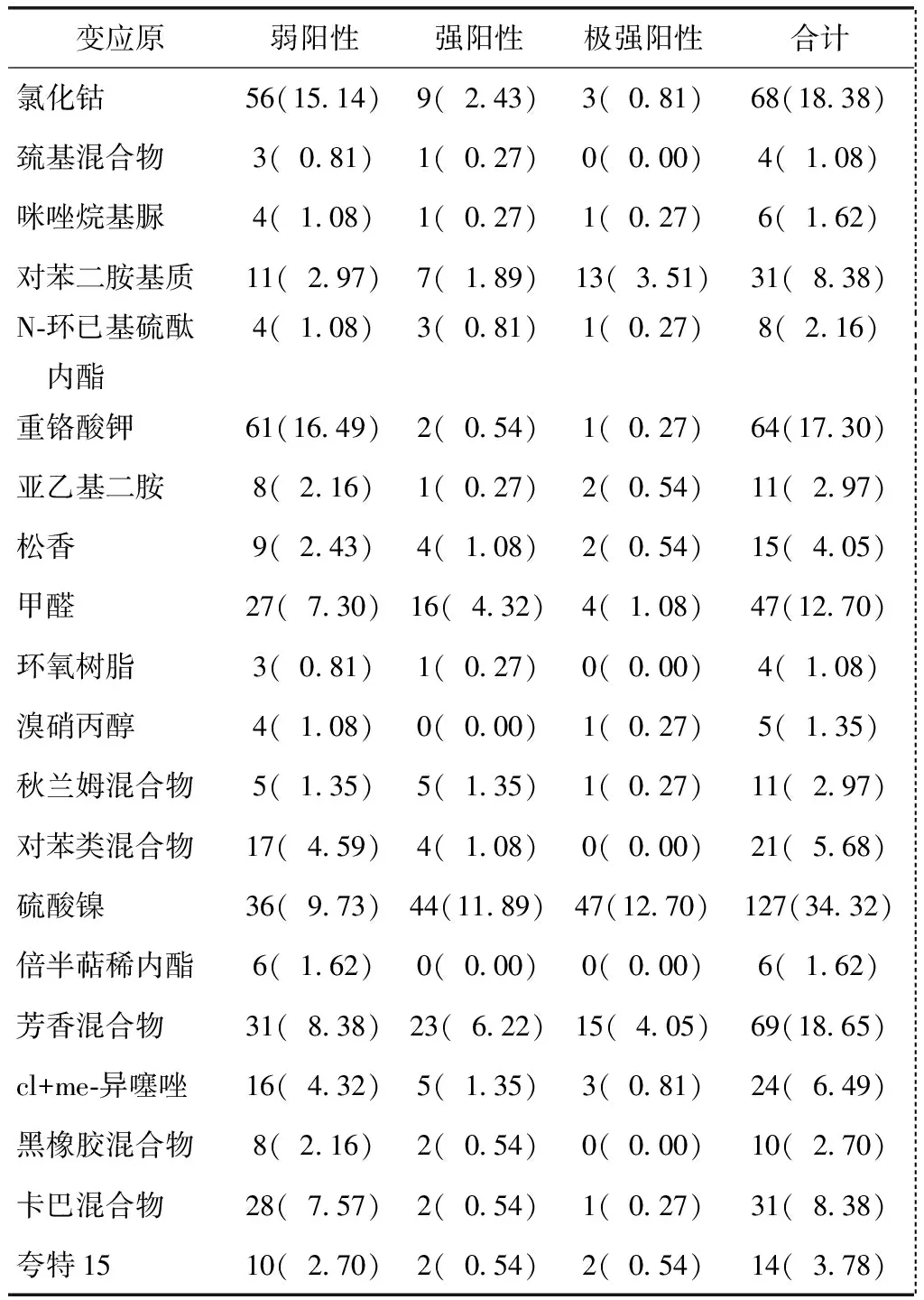
表1 370例变应性接触性皮炎患者斑贴试验结果Table 1 Patch test results in 370 patients with allergic contact dermatitis [n(%)]
斑贴试验与性别的相关性
所有370例ACD患者中,女性硫酸镍及甲醛的阳性率(40.51%、15.69%)显著高于男性(16.67%、4.17%),差异有统计学意义(P<0.01)。男性卡巴混合物的阳性率显著高于女性,差异有统计学意义(14.58%vs. 6.20%,P<0.05)。
斑贴试验与年龄的相关性
≤40岁及>40岁者例数比例为2.14∶1。≤40岁者硫酸镍的阳性率明显高于>40岁者(38.1%vs. 26.27%,P<0.05)。>40岁者N-环已基硫酞内酯、甲醛、芳香混合物与卡巴混合物的阳性率明显高于≤40岁者(5.08%vs. 0.79%,18.64%vs. 9.92%,25.42%vs. 15.48%,7.63%vs. 1.98%,均P<0.05)。
斑贴试验与职业的相关性
办公室工作人员的氯化钴阳性率明显高于其他职业者,美发师的对苯二胺基质阳性率明显高于其他职业者,建筑工人的重铬酸钾和环氧树脂的阳性率明显高于其他职业者,医务人员的秋兰姆混合物和对苯类混合物的阳性率明显高于其他职业者,家庭主妇的硫酸镍阳性率明显高于其他职业者,差异均有统计学意义(均P<0.05)。
斑贴试验与发病部位的相关性
秋兰姆混合物的手部阳性率高于面部与躯干四肢,芳香混合物的面部阳性率高于手部和躯干四肢,差别均有统计学意义(均P<0.05)。
讨 论
本研究的370例ACD患者斑贴试验总阳性率为76.76%,结果略高于欧洲研究所报道的阳性率[5-6]。这可能与接触性变应原在不同国家和地区种类不同或者不同个体对变应原的敏感性差异有关。另外,欧盟1994年颁布法令限制极高阳性率的变应原(如硫酸镍及对苯二胺基质等)在日常消费品中使用,这也是欧洲ACD阳性率较低的原因。此外,本研究观察到氯化钴、重铬酸钾、硫酸镍阳性经常同时存在于同一个体,说明交叉致敏和多重致敏是影响斑贴试验阳性的重要因素[7]。
硫酸镍的总阳性率最高,这与付兰芹等[8]报道的结果一致,高于欧洲类似研究[9-10],这可能因为主要变应原存在国家、地区及种族差异,以及欧盟的“限镍令”降低了硫酸镍致敏的ACD发病率。硫酸镍、芳香混合物、氯化钴、重铬酸钾和甲醛是本研究中阳性率居前5位的变应原,这可能与这些成分广泛存在于合金、防腐剂、杀菌剂、衣物染料、水泥、香料、牙膏、香皂、化妆品及建筑材料中有关,且随着社会经济发展及人们生活方式改变,对这些物质的需求将会越来越多。如何识别种类繁多的日用品中是否含有变应原原及是否存在多重、交叉致敏,已经成为医务工作者亟待解决的共同难题。
本研究中,阳性率低的变应原分别为巯基混合物、咪唑烷基脲、环氧树脂、溴硝丙醇以及倍半萜稀内酯混合物,其阳性率均为1%左右,这可能与它们在日常生活用品中含量较低有关。国外每年都会对每种变应原的阳性率进行总结,并将阳性率低于1%的变应原从标准斑贴系列中取消[11]。因而有必要对国内各地区斑贴试验的阳性率进行统计,对阳性率极低的变应原进行适当调整。
重铬酸钾和氯化钴的总阳性率分别为17.30%与18.38%,略高于土耳其对542例可疑ACD患者行回顾性分析后的斑贴结果(重铬酸钾阳性率11.8%,氯化钴阳性率7.1%)[10];本结果也高于国内刘永平[12]对287例ACD患者斑贴试验的分析结果(重铬酸钾阳性率为9.1%,氯化钴为14.7%)。这可能与不同国家和地区变应原种类不同或纳入排除标准不同有关。重铬酸钾和氯化钴的弱阳性率分别为16.49%与15.14%,但强阳性率与极强阳性率重铬酸钾分别为0.54%与0.27%,氯化钴分别为2.43%与0.81%。说明重铬酸钾与氯化钴是一种普遍存在但致敏强度较弱的变应原,也有可能是由于二者作为金属盐固有的刺激性[13],将部分刺激反应判断为弱阳性反应,从而出现弱阳性率高但强阳性率与极强阳性率低的结果。与重铬酸钾和氯化钴不同,硫酸镍的弱阳性率、强阳性率及极强阳性率均较高,这与国外大多数关于硫酸镍阳性率的报道基本一致[14-15]。硫酸镍是电镀工业、制镍镉电池、有机合成和生产硬化油的原料或催化剂,被广泛应用于如耳环、手表、眼镜框、硬币等日常生活品中,避免较困难。近几年,镍元素在手机中的应用逐渐广泛,在一定程度上增加了镍所致ACD的病例数[16]。而且,大多数食物中均含有镍元素,食入含镍饮食能够导致或加重皮炎症状[17]。多种原因使ACD患者硫酸镍阳性率居高不下。
从接受斑贴试验的ACD患者性别分布来看,女性明显多于男性,男女比例为1∶2.85,男女比例的差别一方面是由于女性佩戴首饰、接触化妆品、染发及使用香水和消毒剂等物品较男性多,使得其患ACD的风险较男性高;另一方面,女性往往比男性更注重自身形象,ACD作为一种皮肤疾患,不仅影响了生活质量,而且也影响了美观。两方面原因共同导致女性就诊人数多于男性。本研究显示,男性的卡巴混合物阳性率较女性显著性增高。由于卡巴混合物主要存在于天然橡胶制品中,造成这种差别可能是由于男性在职业和生活中较女性更易接触到橡胶制品。本研究还显示,女性的硫酸镍阳性率显著高于男性,与国外文献报道相似[10, 18]。这是由于女性在日常生活中更易接触到耳环、项链等金属饰品有关[10]。此外,宫内节育器(含金属)在育龄妇女中广泛使用也成为女性硫酸镍阳性率高于男性的又一因素[19]。另外,女性的甲醛阳性率明显高于男性,这是由于甲醛多存在与化妆品、消毒剂及防腐剂中,在生活中女性对这类物质的接触较男性多。
从ACD患者的年龄分布来看,≤40岁的患者其硫酸镍阳性率明显高于>40岁的患者,这与国外报道相符[20]。究其原因,可能与年轻人接触更多的染发、纹身、打耳洞及穿戴金银首饰有关[10]。而对于变应原N-环已基硫酞内酯、甲醛、芳香混合物与卡巴混合物,>40岁者则有着更高的阳性率,这可能是因为中老年人群更易暴露在与这些变应原相关的职业环境中。
从ACD患者的职业分布来看,氯化钴更易致敏办公室工作人员,可能与氯化钴存在于部分合金类物品中有关;对苯二胺基质更易致敏美发师可能与其经常接触染发剂有关[21];重铬酸钾和环氧树脂更易致敏建筑工人,可能与重铬酸钾多存在于水泥、油漆等建筑材料[22]及环氧树脂多存在于地板材料、硬化剂及活性稀释剂的接触有关[23];硫酸镍更易致敏家庭主妇,这可能与家庭主妇常接触含硫酸镍的家用物品(如不锈钢的物品以及含镍的食物等)有关;秋兰姆混合物和对苯类混合物更易致敏医务人员,可能与秋兰姆混合物多存在于橡胶手套中有关。有文献报道,每天戴橡胶手套超过5 min者比少于1 min者更易患手部接触性皮炎[24]。医务人员作为一种需要长期使用橡胶手套的特殊群体,接触秋兰姆混合物则更易出现ACD反应。对苯类混合物多存在于药品的防腐剂中,医务人员对这类物质的接触机会亦较其他人多。
从ACD患者的病变部位分布来看,秋兰姆混合物易发生在手部,芳香混合物易发生在面部,这可能与橡胶手套及化妆品的广泛使用有关。
硫酸镍、芳香混合物、氯化钴、重铬酸钾以及甲醛是武汉地区ACD的主要变应原。仍有23.24%的患者斑贴试验为阴性或可疑阳性,说明现有的斑贴变应原系列不能涵盖所有导致ACD的变应原,因此有必要对斑贴变应原系列进行适当调整,如增加变应原系列并对现有阳性率低于1%的变应原予以剔除。ACD的病因复杂,久治不愈,且愈后易复发,查清变应原是ACD治疗的关键因素。斑贴试验早期检测能够及早确诊ACD、提升患者的生活质量、减低治疗成本、有效防止皮炎向慢性期发展[25]。对于检出阳性率的变应原,找出其在生活中的对应物质,然后进行避免,可以防止复发,甚至达到根治的目的。本研究同时分析了常见接触性变应原和性别,年龄,职业及发病部位的关系,可以为武汉地区ACD防治和斑贴试验的选择提供依据。
[1]Bolognia JL, Jorizzo JL, Rapini RP.Dermatology[M].Chicago:Elsevier (singapore)Pte Ltd,2010:271-288.
[2]Uter W, Schwitulla J, Thyssen JP, et al. The ‘overall yield’ with the baseline series-a useful addition to the array of MOAHLFA factors describing departmental characteristics of patch tested patients[J].Contact Dermatitis, 2011, 65:322-328.
[3]Hillen U, Jappe U, Frosch PJ, et al. Late reactions to the patch-test preparations para-phenylenediamine and epoxy resin:a prospective multicentre investigation of the German Contact Dermatitis Research Group[J].Br J Dermatol, 2006, 154:665-670.
[4]Wahlbeng JE. Diagnositic patch test, Rycroft RGJ1Testbook of contact dermatitis[M].Berlin:Springer-Verlag, 1992:2411
[5]Craiglow BG, Resneck JS Jr, Lucky AW, et al. Pediatric dermatology workforce shortage:perspectives from academia[J].J Am Acad Dermatol, 2008, 59:986-989.
[6]Resneck JS Jr, Kimball AB. Who else is providing care in dermatology practices? Trends in the use of nonphysician clinicians[J].J Am Acad Dermatol, 2008, 58:211-216.
[7]Rui F, Bovenzi M, Prodi A, et al. Nickel, chromium and cobalt sensitization in a patch test population in north-eastern Italy (1996-2010)[J].Contact Dermatitis, 2013, 1:23-31.
[8]付兰芹,谢文红,余梦清, 等.530例皮炎湿疹类皮肤病斑贴试验结果分析[J].中国预防医学杂志,2006, 5:412-414.
[9]MF Astman, M David, A Trattner. Standard patch test results in patients with contact dermatitis in Israel:age and sex differences[J].Contact Dermatitis, 2007, 56:103-107.
[10] Akasya-Hillenbrand E, Ozkaya-Bayazit E.Patch test results in 542 patients with suspected contact dermatitis in Turkey[J].Contact Dermatitis, 2002, 46:17-23.
[11] Wahlberg JE. Patch testing. T extbook of contact dermatitis[M].Berlin:Springer-V erlag, 1992:241-265.
[12] 刘永平.287例变应性接触性皮炎患者斑贴试验结果分析[J].皮肤性病诊疗学杂志, 2010, 5:359-360.
[13] Fischer T, Rystedt I.False-positive, follicular and irritant patch test reactions to metal salts[J].Contact Dermatitis, 1985, 2:93-98.
[14] Boonchai W, Iamtharachai P, Sunthonpalin P. Prevalence of allergic contact dermatitis in Thailand[J].Dermatitis, 2008, 19:142-145.
[15] Skoet R, Olsen J, Mathiesen B, et al. A survey of occupational hand eczema in Denmark[J].Contact Dermatitis, 2004, 51:159-166.
[16] Thyssen JP, Johansen JD, Zachariae C, et al. The outcome of dimethylglyoxime testing in a sample of cell phones in Denmark[J].Contact Dermatitis, 2008, 59:38-42.
[17] Hostynek JJ. Nickel-induced hypersensitivity:etiology, immune reactions, prevention and therapy[J].Arch Dermatol Res, 2002, 29:249-267.
[18] Al-Sheikh OA, Gad El-Rab MO. Allergic contact dermatitis:clinical features and profile of sensitizing allergens in Riyadh, Saudi Arabia[J].Int J Dermatol, 1996, 35:493-497.
[19] Romaguera C, Grimalt F.Contact dermatitis from a copper-containing intrauterine contraceptive device[J].Contact Dermatitis,1981,3:163-164.
[20] hstman MF,David M,trattner A.Standard patch test results in patients with contact dermatitis in Israel:age and sex differences[J].Contact Dermatitis, 2007, 56:103-107.
[21] Armstrong DK, Jones AB, Smith HR, et al. Occupational sensitization to p-phenylenediamine:a 17-year review[J].Gontact Dermatitis, 1999, 41:348-349.
[22] Avnstor PCH. Risk factors for cement eczema[J].Contact Dermatitis, 1991, 25:81-88.
[23] Koch P. Occupational contact dermatitis[J].Am J Clin Dermatol, 2001, 2:353-365.
[24] Lee SW, Cheong SH, Byun JY, et al. Occupational hand eczema among nursing staffs in Korea:Self-reported hand eczema and contact sensitization of hospital nursing staffs[J].J Dermatol, 2013, 40:182-187.
[25] Rajagopalan R, Anderson RT, Sarma S, et al. An economic evaluation of patch testing in the diagnosis and management of allergic contact dermatitis[J].Am J Contact Dermatitis, 1998, 9:149-154.

