普通变异型免疫缺陷病合并自身免疫性疾病临床特征
罗小芳,李梦涛,郑文洁,张 文,曾小峰,张奉春
(中国医学科学院 北京协和医学院 北京协和医院风湿免疫科,北京 100730)
普通变异型免疫缺陷病(common variable immunodeficiency,CVID)是一种以低免疫球蛋白、抗体产生缺陷、反复感染为特征的原发性免疫缺陷病,其发病率为1100 000~120 000。目前,CVID在国内尚无统一命名,亦有译做“常见变异型免疫缺陷病”或“普通变异型免疫球蛋白缺乏症”。CVID易合并肿瘤和自身免疫性疾病(autoimmune disease,AID)[1],然而,以“普通变异型免疫缺陷病”及“自身免疫性疾病”,或以“常见变异型免疫缺陷病”及“自身免疫性疾病”,或以“普通变异型免疫球蛋白缺乏症”及“自身免疫性疾病”为关键词检索中国知网、维普数据库及万方数据库,国内尚无CVID合并AID的报道。本文回顾性分析1999年4月至2012年10月北京协和医院6例CVID合并AID患者的临床特点、诊断依据和治疗方案,旨在提高临床医务工作者对CVID合并AID的认识。
对象和方法
CVID诊断标准
目前国内尚无统一标准,诊断按照1999年欧洲免疫缺陷病协会(European Society for Immunodeficiencies,ESID)全美免疫病缺陷病协作组(Pan-American Group for Immunodeficiency,PAGID)标准[2]。反复发生感染的患者,至少1种免疫球蛋白(主要包括IgG、IgM、IgA)水平低于正常值2个标准差(我国标准为血清免疫球蛋白总量低于3.0 gL,IgG低于2.5 gL),并除外其他药物及感染引起的低免疫球蛋白血症、已定义的其他有遗传背景或染色体异常的低免疫球蛋白性疾病(先天性无丙种球蛋白血症、婴儿暂时性低丙种球蛋白血症、选择性IgA缺乏症等原发性免疫缺陷疾病),即诊断为CVID。
方法
回顾性分析1999年4月至2012年10月北京协和医院符合上述诊断标准的住院患者23例,记录患者的临床表现、相关辅助检查、治疗及转归等临床资料。AID由专科医生根据诊断标准进行诊断。根据是否合并AID分为合并AID组及无合并AID组,对2组相关数据进行统计学分析。
统计学处理
应用SPSS17.0进行统计学分析,计数资料应用中位数表示,采用Mann-Whitney U非参数检验进行分析。计量资料以发生率表示。P<0.05为差异有统计学意义。
结 果
临床特点
23例CVID患者中,6例合并有AID,约占26.1%。其中男4例,女2例,诊断CVID的中位年龄为26.5(14~32)岁,从出现症状到确诊CVID的中位时间为13.5(1~27)年。无合并AID组17例患者,男9例,女8例,诊断CVID的中位年龄为24.0(12~50)岁,从出现症状到确诊CVID的中位时间为19.0(6~45)年,诊断CVID的年龄及从出现症状到确诊CVID的时间与合并AID组比较,差异均无统计学意义(P=0.674,P=0.151)。
6例CVID合并AID者诊断AID的中位年龄为24.0(14~32)岁。其中,3例首发症状为呼吸道感染,2例首发症状为AID表现,1例首发症状为腹泻。6例患者皆有1个或多个器官肿大患者,无1例患者检查找到瘤细胞。2例患者存在家族相关性,例1患者母亲存在慢性腹泻;例3患者母亲存在缺铁性贫血及脾脏肿大,且其母和弟弟血清IgM下降,IgG为正常下限(表1)。
6例CVID合并AID患者中免疫性血小板减少性紫癜(idiopathic thrombocytopenic purpura,ITP)和自身免疫性溶血性贫血(autoimmune hemolyticanemia,AHA)共3例,占13.0%(323),其余3例AID分别为恶性贫血并萎缩性胃炎、白癜风及贝赫切特综合征,分别占4.3%(123)。

表1 6例普通变异型免疫缺陷病合并自身免疫性疾病患者临床资料Table 1 Clinical data of 6 patients with common variable immunodeficiency complicated with autoimmune disease
CVID:普通变异型免疫缺陷病;AID:自身免疫性疾病;IVIG:静脉应用人免疫球蛋白
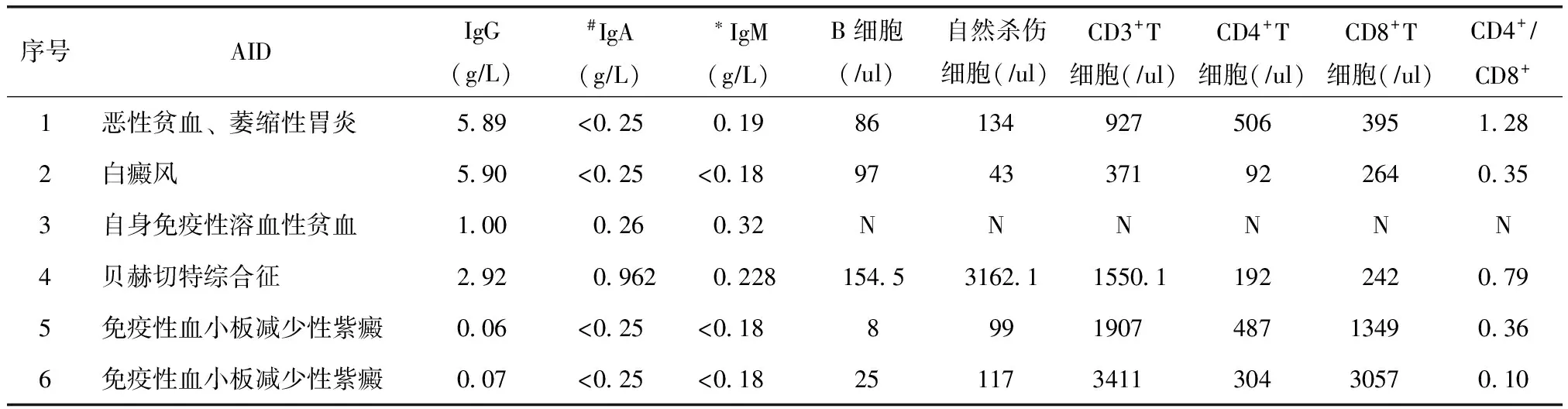
表2 6例普通变异型免疫缺陷病合并自身免疫性疾病患者实验室检查特点Table 2 Laboratory examination of 6 patients with common variable immunodeficiency complicated with autoimmune disease
#IgA<0.25 gL时,按照IgA=0计算中位数;*IgM<0.18 gL时,按照IgM=0计算中位数;N:未检测;CVID:普通变异型免疫缺陷病;AID:自身免疫性疾病
实验室检查
所有6例CVID合并AID者血清免疫球蛋白IgG、IgA及IgM均降低,IgG水平中位数为1.96(0.06~5.90) gL,IgA水平中位数为0(0~0.96) gL,IgM水平中位数为0.095(0~0.32) gL(表2)。
5例患者进行淋巴细胞亚群检查。CD3+T淋巴细胞中位数为1550(371~3411)μl,CD4+T淋巴细胞中位数为304(92~506)μl,CD8+T淋巴细胞中位数为395(242~3057)μl,B淋巴细胞中位数为86(8-154)μl,CD4+TCD8+T淋巴细胞中位数为0.36(0.10~1.28)。所有5例患者B淋巴细胞均减少;4例患者存在CD4+T淋巴细胞比例下降和CD4+TCD8+T比例倒置,提示细胞免疫功能缺陷;3例患者的CD8+T细胞存在异常激活(表2)。
无合并AID组17例患者外周血免疫球蛋白IgG、IgA及IgM也均降低,与合并AID组比较无统计学差异,其中有15例接受了淋巴细胞亚群检查,有13例患者的B淋巴细胞减少,有11例患者CD4+TCD8+T比例倒置,但与AID组比较无统计学差异(表2)。
治疗及转归
4例患者接受了静脉输注免疫球蛋白治疗,治疗后临床症状均明显好转(表1)。
讨 论
本组报道的23例CVID中,6例合并AID,其患病率为26.1%,与国外报道的22%~25.9%一致[3-4]。本研究报道的6例CVID合并AID中ITP和AHA共3例,占23例CVID的13.0%,与Wang和Cunningham-Rundles[5]报道的11%相近。其余3例AID分别为恶性贫血并萎缩性胃炎、白癜风、贝赫切特综合征,与ESID的1项关于CVID的大型研究结果相似,结果显示合并恶性贫血、萎缩性胃炎和白癜风分别占CVID的9%、6%及5%[1]。而贝赫切特综合征目前国际上仅有2例报道[6]。其他CVID相关的AID相对少见,包括血管炎、系统性红斑狼疮、类风湿关节炎、幼年类风湿关节炎、干燥综合征、炎症性肠病、原发性胆汁性肝硬化、自身免疫性肝炎、银屑病、毒性弥漫性甲状腺肿及胰岛素依赖性糖尿病等[1,7]。
CVID多为成年发病,临床表现各异,常见临床表现为呼吸道和消化道复发感染。吕玮等[8]报道的12例CVID中有7例为呼吸道受累,5例为消化道受累,其中1例存在消化道和呼吸道同时受累。CVID合并AID时,患者可表现为AID相关症状及反复感染,也可仅有AID相关临床表现。1项对224例CVID患者的长期随访研究发现,2.3%的患者在诊断CVID时仅有AID的临床表现[3]。Pavic等[9]报道的9例CVID合并AID患者中,有4例首发症状为AID相关临床表现,如溶血性贫血或血小板减少等,另外5例患者首发症状为感染。因此,应注意监测AID患者血清免疫球蛋白水平,尤其对于合并反复感染的患者,监测血清免疫球蛋白水平有利于CVID的早期诊断;另外,对于已经确诊的CVID患者,应关注其AID相关症状,避免漏诊AID。
CVID的发病机制尚不明确。由于CVID以低免疫球蛋白、抗体产生缺陷为主要特征,普遍认为其存在B细胞分化成熟为抗体分泌细胞缺陷,而外周血B细胞数目通常正常[7],也可以减少或缺如。同时,T细胞缺陷及细胞因子异常亦有报道。本组5例接受外周血淋巴细胞亚群检查的患者B淋巴细胞数目均减少,且有4例患者存在CD4+T淋巴细胞比例下降和CD4+TCD8+T比例倒置,提示细胞免疫功能缺陷。CVID合并AID的相关免疫学基础已有了初步研究,欧洲1项多中心研究提示(IgD-IgM-CD27+)同型转换记忆B细胞的缺失与AID的发生相关,其原因可能为对自身免疫克隆的清除无能[10]。有研究提示肿瘤坏死因子和MBL基因的多态性与CVID自身免疫现象相关[11]。另外,也有研究提示,(CD4+CD25+foxP3+)T调节细胞的减少与CVID合并AID相关[12]。ESID的研究显示,不同国家和地区CVID合并AID的发病率不同,提示其与多基因及环境因素有关[1]。
CVID的主要治疗方法为免疫球蛋白替代治疗[13],需根据患者临床表现和反复感染情况调整免疫球蛋白的用法和用量,而不是血清免疫球蛋白水平。推荐用法用量为400~600 mgkg,每3~4周1次静脉注射或每1~2周1次皮下注射。对于CVID合并AID的患者,应在治疗CVID同时治疗AID。目前,CVID合并ITP或AHA无标准化治疗指南,合并轻型ITP或AHA无需治疗,大剂量静脉注射免疫球蛋白(1gkg)和(或)糖皮质激素即有效;对于合并严重ITP或AHA的患者,研究表明应用利妥昔单抗有效且相对安全[7,14]。CVID合并风湿性疾病的治疗原则与非免疫缺陷者相同,但长期应用免疫抑制剂和糖皮质激素可降低血清免疫球蛋白水平[13],为诊断造成一定的困难并可能增加感染风险[4]。
AID为CVID的预后不良因素,ESID研究结果提示AID与死亡率的相关性具有统计学意义(P=0.03,RR=2.5)[1]。同时有研究显示,长期应用免疫抑制剂和糖皮质激素可能增加感染风险,在使用的过程中应警惕感染发生[4]。CVID的其他预后不良因素包括恶性肿瘤、严重的支气管扩张、淋巴细胞间质性肺炎及其他淋巴增值性疾病等[1,3]。另外,Cunningham-Rundles和Bodian[4]提出,外周血B细胞减少为预后不良的独立危险因素。本文患者中有4例接受了免疫球蛋白静脉注射治疗,好转后出院,由于观察疗程较短,需增加观察时间及病例数来评价疗效及预后。
总之,CVID合并AID临床并不少见,以合并ITP和AHA最为常见,关注感染及AID相关症状有助于早期明确诊断。AID为CVID预后不良因素,其治疗仍以静脉注射免疫球蛋白为主,同时应警惕长期应用糖皮质激素和免疫抑制剂加重感染的风险。
[1]Chapel H, Lucas M, Lee M, et al. Common variable immunodeficiency disorders: division into distinct clinical phenotypes[J]. Blood, 2008, 112:277-286.
[2]Conley ME, Notarangelo LD, Etzioni A. Diagnostic criteria for primary immunodeficiencies. Representing PAGID (Pan-American Group for Immunodeficiency) and ESID (European Society for Immunodeficiencies)[J]. Clin Immunol,1999,93:190-197.
[3]Quinti I, Soresina A, Spadaro G, et al. Long-term follow-up and outcome of a large cohort of patients with common variable immunodeficiency[J]. J Clin Immunol,2007,27:308-316.
[4]Cunningham-Rundles C, Bodian C. Common variable immunodeficiency: clinical and immunological features of 248 patients[J]. Clin Immunol,1999,92:34-48.
[5]Wang J, Cunningham-Rundles C. Treatment and outcome of autoimmune hematologic disease in common variable immunodeficiency (CVID)[J]. J Autoimmun,2005,25:57-62.
[6]Shutty B, Garg KJ, Swender D, et al. Optimal use of ivig in a patient with Behcet syndrome and common variable immunodeficiency[J]. Ann Allergy Asthma Immunol,2012,109:84.
[7]Agarwal S, Cunningham-Rundles C. Autoimmunity in common variable immunodeficiency[J]. Curr Allergy Asthma Rep,2009,9:347-352.
[8]吕玮, 刘正印, 李太生. 普通变异型免疫缺陷病12例临床分析并文献复习[J]. 中华内科杂志,2008,47:378-381.
[9]Pavic M, Seve P, Malcus C, et al. Common variable immunodeficiency with autoimmune manifestations: study of nine cases; interest of a peripheral B-cell compartment analysis in seven patients[J]. Rev Med Interne,2005,26:95-102.
[10] Wehr C, Kivioja T, Schmitt C, et al. The EUROclass trial: defining subgroups in common variable immunodeficiency[J]. Blood,2008,111:77-85.
[11] Brandt D, Gershwin ME. Common variable immune deficiency and autoimmunity[J]. Autoimmun Rev,2006,5:465-470.
[12] Genre J, Errante PR, Kokron CM, et al. Reduced frequency of CD4(+)CD25(HIGH)FOXP3(+) cells and diminished FOXP3 expression in patients with Common Variable Immunodeficiency: a link to autoimmunity?[J]. Clin Immunol,2009,132:215-221.
[13] Cunningham-Rundles C, Maglione PJ. Common variable immunodeficiency[J]. J Allergy Clin Immunol,2012,129:1425-1426.
[14] Gobert D, Bussel J B, Cunningham-Rundles C, et al. Efficacy and safety of rituximab in common variable immunodeficiency-associated immune cytopenias: a retrospective multicentre study on 33 patients[J]. Br J Haematol,2011,155:498-508.

