髓芯减压钽棒+自体骨植入治疗成人早期股骨头缺血性坏死的短期疗效观察
尚 咏,虞攀峰,赵旭红,卞 斌,伍 骥,陈名智(空军总医院骨科,北京 100142)
成人股骨头缺血性坏死(adult avascular necrosis of femoral head,ANFH)的致病机制复杂并且影响因素繁多,它主要是由于股骨头血液循环障碍,进而导致的股骨头内骨髓细胞缺血、坏死、变性,骨小梁断裂、溶解,股骨头负重区变形或塌陷,关节功能障碍的一种疾病。早期股骨头坏死的手术治疗包括髓芯减压、坏死区植骨等手术方式,由于缺乏有效的力学支撑,在坏死区修复之前股骨头常常出现塌陷。如何兼顾减压植骨和机械支撑两个方面,是骨科基础和临床医生面临的一大课题。本研究通过观察髓芯减压联合多孔钽棒+自体骨植骨植入术后不同时间段的临床和影像学结果,对结果进行回顾性研究,探讨该手术治疗成人早期缺血性股骨头坏死的短期疗效。
1 临床资料与方法
1.1 研究对象
选择2009-08~2011-04早期ANFH患者行钽棒植入术11例(17髋)。男10例,女1例,年龄21-58岁,平均(39.2±3.3)岁。单侧病变5例(左侧4例,右侧1例),双侧病变6例。1例有长期饮酒史,1例有服用激素病史,9例无明显病因。纳入标准为:①年龄在20-60岁之间;②营养状况正常(BMI值女性18-23.5,男性20-24);③非创伤、感染所致的股骨头缺血性坏死;④髋关节无骨性关节炎,髋臼正常;⑤影像学分期为≤FicatⅡB期;⑥无重要脏器病变,可耐受手术者。排除标准:①影像学上有股骨头明显塌陷的晚期患者(FicatⅢ期及以后);②年龄<20岁或>60岁;③ BMI不在正常范围内的患者(女性 <18或 >23.5,男性 <20或 >24);④风湿、类风湿及强直性脊柱炎等继发关节损害致股骨头坏死;⑤髋关节骨关节炎继发的股骨头坏死;⑥重要脏器有严重病变无法耐受手术者;⑦髋关节创伤(含脱位、股骨颈骨折)。我们的研究数据根据患者的随访条件,参考1995年由Smith改良的Ficat分期方法作为依据[1],具体如下(影像学资料为X-ray片):Ⅰ期(影像学前期),X线正常或轻微异常;Ⅱ期,ⅡA期(塌陷或死骨形成前期)股骨头硬化、弥漫空洞形成、囊性变,ⅡB期(过度期)股骨头轻度扁平,出现“新月”征;Ⅲ期(塌陷期),X线股骨头轮廓异常,关节间隙正常;Ⅳ期(骨关节炎期),股骨头塌陷、扁平,关节间隙狭窄。
1.2 材料和方法
1.2.1 材料 内固定材料为美国Zimmer公司设计的带孔隙的金属坦棒(a porous tantalum implant)。
1.2.2 方法 17髋手术由3组医生完成(文章署名包含这3组医生)。
手术操作步骤:①确定中心隧道位置。在C型臂机透视下进行,牵引床牵引双下肢,确认手术部位,体表定位,确定进针方向和进针点,以小转子上缘对应的股骨外侧骨皮质为进针点,以坏死病损区中心为进针终点。②插入导针。关节内旋10°-15°以消除股骨颈本身的前倾。用直径为3.2 mm的导针从进针点向导针终点位置进针至距股骨头表面内侧约5 mm处。③钻孔。导针放置到位后,应用空心钻渐进扩孔到8 mm,然后用直径9 mm空心钻扩孔,术中应及时清理空心钻以防止骨碎屑聚集在空心钻中心部位。④取活检。达到逐渐扩孔到达坏死骨区域,在穿透或去除坏死骨区域之前如果需要可以取活检。⑤植骨。清除坏死组织并适量植骨。⑥扩孔至10 mm。取活检后,使用直径10 mm空心钻扩孔至距股骨头表面内5 mm处。⑦测量。去除导针后,插入深度测量器透视深度距股骨头内表面5 mm处,确认假体长度。⑧选择相应长度的延长杆与丝攻末端组合,然后连接T型手柄。从股骨外侧骨皮质进入,至所有螺纹全部位于骨皮质内。⑨假体植入。使用T型手柄将骨小梁金属坦棒植入并将其旋入到最终位置。确保假体的外侧端部分应该与皮质骨保持水平或稍嵌入皮质骨。
1.2.3 观察指标 对11例(17髋)钽棒植入患者进行术后短期的观察及随访,对术前X线分期以及临床Harris评分进行整理,将术前的Harris评分与随访患者钽棒植入术后12个月时的Harris评分进行统计学分析,观察钽棒植入的临床疗效,并对患者术前及术后的影像学改变进行观察,看是否存在假体松动或股骨头塌陷等影像学表现,进行影像学结果的评价;以股骨头塌陷或进行关节置换作为研究止点。
1.3 评价标准
1.3.1 功能评分 采用Harris评分表。Harris评分91-100分为优,81-90分为较好,71-80分为良,≤70分为差。
1.3.2 影像学评价 同前面的Ficat分期。
1.4 术后处理
术后完全不负重3周,4-6周部分负重,6周后完全负重。
1.5 资料的收集
通过门诊复查及电话随访进行术前术后Harris评分,并收集手术前后影像学资料。
1.6 统计学分析
使用SPSS 17.0统计软件,用配对t检验分析术前与术后Harris评分是否存在统计学差异,从而判定钽棒植入术对于治疗ANFH有无效果。
2 结果
术后最短随访时间12个月,最长随访21个月,平均随访15.1个月。2例(3髋)失随访,另外1例已在术后14个月在外院行髋关节置换术。因此统计9例14髋。手术患者平均年龄为(39.2±3.3)岁,手术术前Harris评分平均(56.93±4.93)分,术后12个月Harris评分平均为(77.21±5.82)分。已随访患者手术前后Harris评分进行统计学分析(均以单侧髋关节为单位),差异有统计学意义(t=-2.822,P=0.014)。股骨头坏死病例术后疗效见表1。多孔钽棒植入术后患者在平均15.1个月的随访中影像学X线片观察到11例17髋中,失访2例3髋,影像学塌陷3例3髋,其余患者未加重(典型病例见图1,2)。塌陷病例中1例(1髋)进行关节置换,以股骨头坏死进展发生股骨头塌陷或行关节置换为终点的生存分析显示生存率为78.6%。
具体数据详。
3 讨论
3.1 治疗早期股骨头坏死的传统保髋手术方式
近年来随着成人股骨头坏死发病率的上升以及诊断技术的提高,保髋手术成为早期股骨头坏死治疗的焦点。单纯髓芯减压术的目的是通过降低股骨头的髓内压,改善局部血液循环,促进血管化,防止缺血现象进一步加重,但此术将使原本已脆弱的软骨下骨的支撑力进一步减弱,加速了股骨头的塌陷。Stulberg等[2]学者提出如果采用≥8 mm直径环钻进行钻孔减压,环钻易钻透股骨头而损伤关节面软骨进入关节间隙,同时会降低股骨头、颈力学强度,发生股骨颈骨折。Mont等[3]首先报道用多枚小直径(3 mm)环钻钻孔减压技术治疗股骨头坏死平均随访38个月,塌陷率为14.3%,而传统减压法为45%,采用经皮多枚小直径斯氏针钻孔减压,临床成功率为70%,无并发症发生。Kim等[4]也得出了相同的结论。在传统单纯髓芯减压术的基础上,使用人工骨、同种异体骨、自体松质骨进行填塞。不仅减轻了股骨头内的压力并且进行了机械支撑。
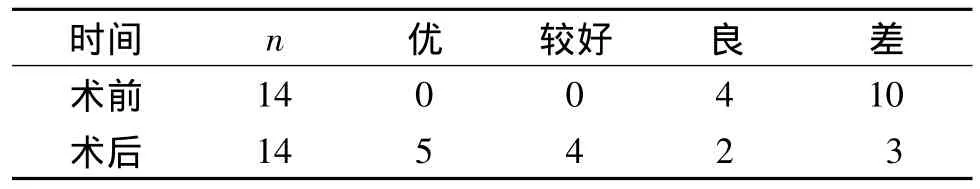
表1 股骨头坏死14髋随访病例术后股骨头功能评估Tab 1 Clinical efficacy of femoral head function in ANFH cases before and after surgery
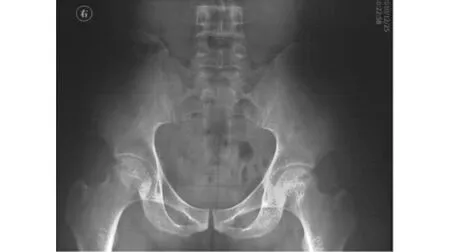
图1 男,26岁,术前X-ray,左侧FicatⅡA期,右侧 FicatⅠ期Fig 1 Preoperative X-ray of a 26-year-old male ANFH patient showed stage Ficat ⅡA in the left,stage FicatⅠin the right
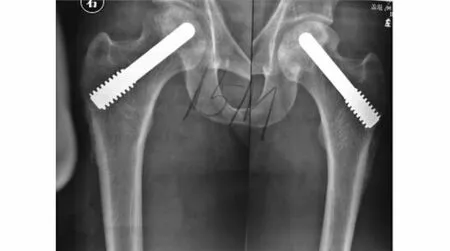
图2 术后15个月X-ray:双侧股骨头未见塌陷(与图1同一病例)Fig 2 X-ray features of the same patient(Fig 1)at month 15 after operation showed no collapse in bilateral femoral heads
由于股骨头坏死的主要原因还是因为局部缺血所致,所以人们试图植入血管束建立新的血液循环,有助于新生骨的形成,阻止股骨头坏死进展。单纯的血管束移植虽然可以改善局部的血液供应,但是却无法对局部坏死吸收的部分进行有效的支撑,并要求术后长期卧床及晚期负重。鉴于以上原因,人们设计出游离带血管蒂的腓骨移植、带旋髂深血管蒂髂骨移植及带股方肌蒂骨柱移植术等多种移植方法,但血管蒂的长度部分限制了髋关节的活动,对患者的活动度存在一定的影响[5]。而带血管蒂的腓骨移植,因其对显微技术要求较高,手术难度及创伤相对较大,限制了其广泛开展,并且会发生供骨区疼痛等并发症,有报道称有19%的患者会出现运动无力、踝部及小腿部不适以及下肢感觉障碍[6]。
另外,咸宝山等[7]在原有手术基础上,于2001年设计出带旋髂深血管蒂髂骨与骨软骨联合移植的方法,回顾研究表明该方法取得了较好的近期疗效,中远期疗效仍需进一步观察。传统的股方肌蒂骨柱植入与上述骨移植方法均可得到较理想的治疗效果,但是往往由于部分骨柱无法存活,致使股骨头的支撑仍存在不稳定因素,并且在骨柱间的股方肌蒂也易受到周围骨组织的挤压而影响血供,故针对这一现象,李伟军等[8]在原有基础上加以改进,设计了股方肌蒂骨柱加钛网伞状支撑术,于软骨下垫一层松质骨骨髓团,压实后将钛网片植入支撑于坏死区,并在股骨头松质骨条中央植入中空圆柱状钛网,以容纳股方肌蒂,形成骨柱-钛网复合体。并经过回顾性研究证实股方肌蒂骨柱加钛网伞状支撑术治疗ARCOⅡC和ⅢA期非创伤性ANFH具有较好的近期效果。
3.2 髓芯减压联合多孔钽棒+自体骨植入手术
多孔钽棒的出现使得对于原有的股骨头支撑方式有了进一步的发展,人们可以不再需要去取自体腓骨或者使用同种异体骨来进行填充支撑,极大地简化了手术方式,减轻患者术中创伤及痛苦。多孔钽棒由纯钽制造,平均空隙大小约为430 μm,弹性模量与骨相当,具有非常优异的生物兼容性和力学特性,并且与骨的摩擦力大致稳定性好。通过特殊加工工艺制成的骨小梁钽金属有80%的孔隙率,其蜂窝状结构与人体的骨小梁类似,并具有和人体骨质相同的弹性模量。多孔钽金属棒的平均屈曲强度是10 N·m,而人腓骨的平均屈曲强度是8.0-12.5 N·m。Pedersen等[9]分析了钽棒治疗股骨头坏死三维有限元特点,认为多孔钽棒与腓骨弹性模量相当,在股骨头内有相同的应力和应变模式。另外Cohen等[10]也通过实验证实钽棒基本不会形成应力遮挡,可对股骨头提供结构性支撑。同时Bobyn等[11]的动物试验研究证实,钽棒内部的蜂窝状构造便于骨组织修复和成骨细胞快速、牢靠地长入,4周后软组织长入即可达1 cm。Zimmer公司的骨小梁重建-AVN钽棒是针对早期ANFH开发的一种植入物,先后在欧洲和加拿大应用于临床,2005年获得美国FDA认证,2008年作为一种新的保髋手术登陆中国,为成人早期股骨头坏死的治疗提供了一种新的选择。
目前钽棒植入的手术技术并不包括自体骨植入,国外有研究表明[12]髓芯减压联合单纯钽棒植入治疗Ⅱ期以前的病例,股骨头存活率为72.5%。在我国开展此手术的时间尚短,数量也相对有限。我们在临床中常见到股骨头坏死病例常常就诊较晚,FicatⅡ期病例较多,X线片已有囊性改变,因此我们尝试在髓芯减压的同时,对Ⅰ、Ⅱ期病例坏死区域清除并行适量的自体骨移植,在保证支撑的同时进行坏死区域的植骨,观察该方法治疗股骨头坏死保头治疗的效果,通过研究结果我们得出以下的结论:
①手术前后Harris评分有统计学的显著差异(P=0.014)。手术术前Harris评分平均(56.93±4.93)分,平均12个月随访后,得到多孔钽棒植入术后12个月Harris评分平均为(77.21±5.82)分。这表明髓芯减压多孔钽棒植入术不但能较好改善患者病变髋关节的功能,显著减轻疼痛,增加关节活动范围,减轻跛行程度。
②多孔钽棒植入手术同时具有手术创口小的特点,只需要在股骨大转子下作1.5 cm的切口,C臂准确定位后,导针引导扩孔直达股骨头病灶,无须进行肌肉剥离,不需切开关节囊,手术具有微创性,手术时间短,术中出血少。做到以最小的创口到达股骨头病灶,有效降低骨内压,彻底清除坏死和炎性组织,而且可以为病变股骨头提供有效的机械支撑,不影响局部血运的重建,还可促进骨头内部骨生长。较小的手术创伤可以缩短患者的康复时间,国外有文献[14]报道称早期股骨头坏死行AVN钽棒植入后可即刻负重。我们的术后恢复依然比较保守,3周内完全不负重,3-6周内部分负重,6周后可完全负重。即使这样,该手术的康复时间也较传统手术大为缩短。
③通过影像学随访检查来确定术后股骨头无塌陷生存时间,我们平均随访12个月,术后观察及随访期内2例(3髋)失随访,3例(3髋)末次随访症状有所加重,1例已在术后14个月时髋关节置换术,其余未见固定松动、断裂等并发症,从随访所得术前术后Harris评分的统计学分析的结果看来,多孔钽棒的植入确实能够提供有效的结构性支撑,并且其弹性模量与骨相似,可以极大地减少应力集中和应力遮挡所带来的一系列弊端,此外良好的骨诱导性和促修复功能都使其能延缓股骨头坏死塌陷。Tsao等[12]也证实了髓芯减压后多孔钽棒植入具有预防股骨头塌陷、推迟髋关节置换的作用,但仍都出现了部分失败的患者。
④此次的短期随访显示髓芯减压多孔钽棒植入术,可以有效使股骨头坏死疼痛减轻,髋关节功能改善,并具有明显的微创优势,对出现的3例加重患者,可能有以下几个原因:第一,术前的评估及适应证的把握。对于一些广泛或者多发的病变,一根钽棒可能无法完全对其坏死区域进行有效的支撑,那么术后就可能出现股骨头的进一步坏死及塌陷。关于钽棒植入适应证的问题:我们的研究在开始时即选定未发生股骨头塌陷的早期(FicatⅠ-ⅡB期)患者,发现绝大部分病例取得了较好的效果,通过对疗效欠满意病例的分析,我们认为坏死囊变面积过大可能是影响疗效的主要因素。所以术前不但要进行准确的分期,而且要对囊变坏死的位置和大小进行准确评估。当然这依赖于MRI和CT检查,以及相关影像学测量技术的支持。第二,钽棒植入术后的效果受到坏死程度及病程长短的限制,如果为慢性病理状态导致的坏死,那么植入术后坏死程度仍有可能进一步加重。Nadeau等[13]对FicatⅢ期及以后的病例施行AVN钽棒植入术,并且也得到了一定的疗效,但是多孔钽棒植入能否使晚期ANFH患者长期获益还有待于进一步的研究。这也提醒我们,虽然钽棒最初设计是针对早期ANFH患者,但是其真正适用人群还有待于多中心大规模的长期临床随访观察。第三,内科疾病与预后关系。Shuler等[14]的研究显示行股骨头坏死钽棒植入术的患者中,有14%(3/22)的患者在随访期内进行了髋关节置换术。Shuler认为一部分患者股骨头坏死的进一步加重可能是由于系统性疾病所形成的血管炎或抗体介导形成的血栓,而且如因为其他疾病而继续使用激素,则将进一步导致骨质疏松,促进塌陷发生。我们随访的3例加重病人中,虽然没有发现以上所提的内科疾病,但也不排除存在某些潜在的内科致病因素。第四,手术技术本身的掌握情况。由于此技术出现时间较短,虽然有标准的操作指南,但是在实际操作中,每位医生根据自己的习惯或理解,势必在手术的一些细节,如导针及钻头距股骨头内侧关节面的距离把握上,都难免存在差异,所以手术技术的掌握程度可能也是影响预后的因素之一。第五,坏死区域植骨的数量及质量。坏死区域刮除后需要植骨,植骨的数量及质量均会存在一定差异,可能也是导致影响手术结果的原因之一。
4 结论
髓芯减压联合多孔钽棒+自体骨植入术为成人早期股骨头坏死的治疗提供了一种新的选择,是一种有效的治疗方式。多孔钽棒良好的生物力学特性可以为股骨头病变承重区域提供有效的结构支撑,使患者能够早期下地活动,加快恢复进程。
此外自体骨的植入将促进坏死区域的修复重建,更好地诱导骨生长,促进坏死区域骨愈合。同时,也具有手术时间短、操作简单便于应用、手术创伤小、术后恢复时间短等优点。
当然我们的研究由于病例数较少,观察时间比较短,得出的上述结论还有待进一步研究证实及从以下几方面进一步完善:①希望能建立对照组,进行钽棒植入与单纯减压加植骨以及带血管腓骨移植对比研究,并采用可信度更高的前瞻性研究而不是回顾性研究,更好地研究设计和实验条件及纳入标准,使研究结果的可信度更高。②能够将钽棒植入失败的病例的股骨头进行组织学处理及观察,从微观角度去分析失败的原因,观察钽棒与股骨头的组织相容性以及诱导骨生长的能力,进一步明确该技术的适用范围及类型。③进行髋关节的生物力学实验,从机械的角度研究钽棒植入的位置的支撑能力和效果,以及股骨头能承受的压力阈值。④钽棒技术目前开展并不足够普遍,目前我们能获取的病例数过少,希望能进行多中心、大样本的联合研究。
[1] Smith SW,Fehring TK,Griffin WL,et al.Core decompression of the osteonecrotic femoral head[J].Bone Joint Surg Am,1995,77:674-680.
[2] Stulberg BN.Optimizing the outcome of core decompression[J].Orthopaedics,2001,16(1):24-31.
[3] Mont MA,Ragland PS,Etienne G.Core decompression of the femoral head for osteonecrosis using pereutaneous multiple small-diameter drilling[J].Clin Orthop Relat Res,2004,429:131-138.
[4] Kim SY,Kim DH,Park IH,et al.Multiple drilling compared with core decompression for the treatment of osteoneerosis of the femoral head[J].Bone Joint Surg Br,2004,86(Suppl 2):S149.
[5] Urbaniak JR,Coogan PG,Gunneson EB,et al.Treatment of osteonecrosis of the femoral head with free vareularized fibular grafting.A long-term follow-up study of one hundred and three hips[J].Bone Joint Surg Am,1995,77(5):681-694.
[6] Vail TP,Urbaniak JR.Donor-site morbidity with use of vascularized autogenous fibular grafts[J].Bone Joint Surg Am,1996 Feb,78(2):204-211.
[7] 咸宝山,姜文学,刘富,等.带旋髂深血管蒂髂骨与骨软骨联合移植治疗股骨头坏死[J].中华骨科杂志,2010,30(1):62-66.
[8] 李军伟,王义生,杨国辉,等.股方肌蒂骨柱加钛网伞状支撑术治疗非创伤性股骨头坏死的初步临床观察[J].中华骨科杂志,2010,30(1):37-41.
[9] Pedersen DR,Brown TD,Poggie RA.Finite element characterization of a porous tantalum maternal for treatment of avascular necrosis[J].Trans Orthop Res Soc,1997,22:598-510.
[10] Cohen R.A porous tantalum trabecularmeta:basic science[J].Am J Orthop,2002,31:216-217.
[11] Bobyn JD,Stackpool GJ,Hacking SA,et al.Characteristics of bone ingrowth and interface mechanics of a new porous tantalum biomaterial[J].Bone Joint Surg Br,1999,81(5):907-914.
[12] Tsao AK,Roberson JR,Christie MJ,et al.Biomechanical and clinical evaluations of a porous tantalum implant for the treatment of early-stage osteonecrosis[J].Bone Joint Surg Am,2005,87(2):22-27.
[13] Nadeau M,Séguin C,Theodoropoulos JS,et al.Short term clinical outcome of a porous tantalum implant for the treatment of advanced osteonecrosis of the femoral head[J].Mcgill J Med,2007,10(1):4-10.
[14] Shuler MS,Rooks MD,Roberson JR.Porous tantalum implant in early osteonecrosis of the hip:preliminary report on operative,survival,and outcomes results[J].Arthroplasty,2007,22(1):26-31.

