NK4基因转染对人乳腺癌细胞MDA-MB-231生物学特性的影响
李松林,李 霏,刘新莉,尹元琴(中国医科大学附属第一医院肿瘤研究所二室,沈阳 000;辽宁省肿瘤医院血液生物治疗科;通讯作者,E-mail:yuandouwang@yahoo.com.cn)
乳腺癌是妇女最常见的恶性肿瘤之一,目前在我国的发病率逐年增加,且有年轻化趋势。因此,研究乳腺癌的治疗新策略显得尤为重要。研究表明,肝细胞生长因子(hepatocyte growth factor,HGF)是由间质细胞产生的一种多功能细胞因子[1],通过结合其受体c-Met使其激活成p-Met,在肿瘤侵袭和转移中发挥着重要的作用[2]。NK4是一种新的肝细胞生长因子拮抗剂,它是由HGFα链的447个氨基酸和4个kringle结构所组成,故命名为NK4,相对分子量是50 kD[3]。NK4能够与c-Met受体结合,但并不激活c-Met受体,因此能够竞争性抑制HGF对c-Met受体的激活作用。研究证实NK4体外可以抑制HGF诱导的多种肿瘤细胞的生长、运动和侵袭[4-7]。但在乳腺癌中的作用,目前国内外少见报道。为此我们构建了NK4重组慢病毒载体[8],并进行转染研究,探讨NK4基因对HGF诱导MDA-MB-231的细胞生长、侵袭的影响。
1 材料与方法
1.1 细胞培养
乳腺癌细胞株MDA-MB-231培养在含10%胎牛血清的DMEM培养基中,置于37℃,5%CO2孵箱中。
1.2 细胞转染
将NK4病毒载体转染到231细胞中,最适感染复数(multiplicity of infection,MOI)为 10,载体转染时培养基中添加聚凝胺调整浓度至8 μg/ml,以正常培养和空白载体转染的细胞作为对照。
1.3 转染细胞NK4基因mRNA水平表达检测
取NK4转染组、空载体组和对照组细胞各5×106,常规提取总RNA,参照NK4基因序列设计引物,上游引物:5’-ATCAGGCAAGATTTGTCAGCG-3’;下游引物:5’GAGCAGTAGCCAACTCTCGGAT-3’。用上述两种引进行RT-PCR反应,阳性者可扩增出453 bp片段。β-actin作为内参照。
1.4 NK4蛋白和p-met蛋白表达的检测
采用Western blot法检测NK4蛋白和p-met蛋白表达。NK4转染组、空载体组和对照组的细胞孵育2 d,分别收集对数生长期的细胞培养液上清和细胞裂解液。聚丙烯酰胺凝胶电泳后,电转移到硝酸纤维膜上,5%牛奶封闭,加入兔抗人单克隆抗体4℃过夜,TBST洗3次,加入二抗,TBST冲洗3次后加入ECL发光液曝光。
1.5 细胞生长曲线测定
按照每孔5×103个细胞接种于96孔板,分为MDA-MB-231组和NK4转染组,每组设5个复孔,每组加入10 ng/ml的HGF。每孔加入MTT溶液10 μl,37 ℃ 培养,4 h 后加入 DMSO 150 μl震荡 10 min。在酶联免疫检测仪OD570nm读取吸光值。抑制率计算公式为:抑制率=1-(实验孔A值-空白孔A值)/(对照孔A值-空白孔A值)。
1.6 细胞侵袭能力测定
采用8 μm的Transwell chamber,对数生长期的MDA-MB-231细胞组,空载体组和NK4转染组,胰酶消化后,用含有10%胎牛血清的DMEM培养基调整成1×105的细胞悬液,上室每孔加入0.5 ml的细胞悬液(即每孔5×104个细胞),下室加入含有10 ng/ml HGF的培养基孵育48 h。取出滤膜,用棉签擦尽上室面Matrigel和未侵袭的细胞,10%中性甲醛固定30 min,常规HE染色,200倍光镜下随机选取5个视野,计数滤膜下室面的细胞数,以平均数作为侵袭指数。
1.7 统计学分析
采用SPSS13.0软件对数据进行 t检验和方差分析及两样本比较的LSD检验。数据以±s表示,以P<0.05为差异有统计学意义。
2 结果
2.1 转染细胞NK4 mRNA基因的表达
对NK4转染组、空载体组和对照组样品进行RT-PCR反应,均可扩增出长度为1 434 bp的特异性条带,而空载体组和对照组则没有特异性条带。说明NK4转染乳腺癌后能够正常转录(见图1)。

图1 三组细胞中NK4基因的表达Fig 1 Identification of NK4 gene
2.2 转染细胞NK4蛋白和p-met蛋白的表达
取NK4转染组、空载体组和对照组细胞培养液上清液进行Western blot实验,结果显示:NK4转染组能够表达NK4蛋白,而对照组和空载体组中无NK4表达,且与对照组和空载体组相比转染组中pmet蛋白的表达明显减弱(见图2)。

图2 各组细胞中NK4及p-met的表达Fig 2 Expression of NK4 and p-met in three groups
2.3 细胞生长曲线测定
结果显示NK4转染组与对照组和空载体组相比能够明显抑制由HGF诱导的细胞生长(P<0.01,见图3)。
2.4 细胞侵袭能力测定
Transwell小室法观察转染NK4基因对乳腺癌细胞侵袭的影响,结果显示,转染NK4能够显著抑制HGF诱导的乳腺癌细胞的侵袭(P<0.01,图4,5,见第248页)。
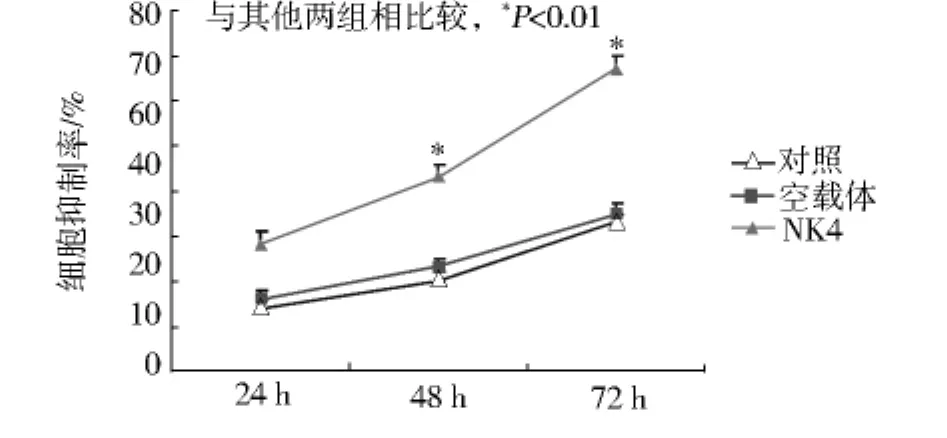
图3 转染NK4对MDA-MB-231细胞的抑制作用Fig 3 The cell inhibition of NK4 on MDA-MB-231

图4 Transwell小室法观察转染NK4基因对乳腺癌细胞侵袭的影响 (×100)Fig 4 Effect of NK4 transfection on MDA-MB-231 invasion by Transwell assay (×100)

图5 对照组、空载体组及转染NK4组48 h后MDA-MB-231侵袭情况对比Fig 5 The inhibition on MDA-MB-231 invasion of null,vector and p-Lenti-NK4 at 48 h
3 讨论
乳腺癌已经成为女性最常见的恶性肿瘤之一,占女性所罹患的全部恶性肿瘤的23%[9],在美国乳腺癌已经成为女性恶性肿瘤第一位[10]。因此研究乳腺癌细胞的侵袭和转移的机制,探索有效地抑制乳腺癌的生长、侵袭和转移的方法显得至关重要。
HGF是由间质细胞产生的一种多功能细胞因子。最初引起对肝细胞具有很强的丝裂原作用而命名[1]。HGF具有诱导细胞有丝分裂、刺激细胞迁移、对抗细胞因子诱导凋亡的作用。通过包括癌细胞在内的多种细胞膜上的特异性受体c-Met发挥生物学作用[2]。HGF/c-Met可以激活蛋白激酶结构域中的PTK,导致丝裂原活化蛋白激酶(MAPK)发生磷酸化上调u-PA(内皮细胞尿激酶-纤溶酶原激活系统),引起一系列的生物反应,诱导基质金属蛋白酶的表达,促进细胞外基质的降解,最终导致肿瘤的侵袭和转移[11]。最近,有研究证实乳腺癌中HGF和c-Met的表达与正常组织相比明显升高,且HGF的水平与乳腺癌的肿瘤大小、临床分期、淋巴结状况及组织学分级有明显关系[12-14]。因此,如果能够抑制HGF与其受体c-Met的结合将对乳腺癌的治疗起到重要作用。NK4是HGF最具代表性的全面的拮抗剂,它具有拮抗HGF和抑制血管生成的双重作用。本实验通过对乳腺癌细胞MDA-MB-231转染NK4重组慢病毒载体,发现转染NK4基因的细胞组能够向培养基中大量分泌NK4蛋白,体外实验结果显示NK4能够竞争性抑制HGF与乳腺癌细胞上cmet受体的结合,抑制了c-Met受体的磷酸化。从而阻断了HGF/c-met信号通路对乳腺癌细胞促肿瘤作用,NK4基因的转染能够明显地抑制乳腺癌细胞的生长和侵袭,为进一步的体内实验和乳腺癌的临床治疗提供了研究基础。
[1] Cooper CS,Park M,Blair DG,et al.Molecular cloning of a new transforming gene from a chemically transformed human cell line[J].Nature,1984,311(5981):29-33.
[2] Zeng Q,Chen S,You Z,et al.Hepatocyte growth factor inhibits anoikis in head and neck squamous cell cancinoma cells by activation of ERK and Akt signaling independent of NK-kappaB[J].J Biol Chem,2002,277(28):25203-25208.
[3] Date K,Matsumoto K,Shimura H,et al.HGF/NK4 is a specific antagonist for pleiotrophic actions of hepatocyte growth factor[J].FEBS Lett,1997,420(1):1-6.
[4] Kuba K,Matsumoto K,Date K,et al.HGF/NK4,a four-kringle antagonist of hepatocyte growth factor,is an angiogenesis inhibitor that suppress tumor growth and metastasis in mice [J].Cancer Res,2000,60(23):6737-6743.
[5] Date K,Matsumoto K,Kuba K,et al.Inhibition of tumor growth and invasion by a four-kringle antagonist(HGF/NK4)for hepatocyte growth factor.[J].Oncogene,1998,17(23):3045-3054.
[6] Hiscox S,Parr C,Nakamura K,et al.Inhibition of HGF/SF-induced breast cancer cell motility and invasion by the HGF/SF variant NK4 [J].Breast Cancer Res Treat,2000,59(3):245-254.
[7] Yue D,Wang Y,Ma P,et al.Effects of transferred NK4 gene on proliferation,migration,invasion and apoptosis of human prostate cancer DU145 cells[J].Asian J Androl,2010,12(3):381-389.
[8] 李霏,李松林,尹元琴.NK4基因重组慢病毒载体的构建及在肝癌细胞中的表达.[J].中国医科大学学报,2011,40(12):1081-1084.
[9] Parkin DM,Bray F,Ferlay J,et al.Global cancer statistics.[J].CA Cancer J Clin,2005,55(2):74-108.
[10] Jemal A,Sieqel R,Ward E,et al.Cancer statistics,2006[J].CA Cancer J Clin,2006,56(2):106-130.
[11] Abounader R,Ranganathan S,Lal B,et al.Reversion of human glioblastoma malignancy by U1 small nuclear RNA/ribozyme targeting of scatter factor/HGF and c-met expression [J].J Natl Cancer Inst,1999,91(18):1548-1556.
[12] Sheen-Chen SM,Liu YW,Eng HL,et al.Serum levels of hepatocyte growth factor in patients with breast cancer[J].Cancer Epidemiol Biomarkers Prev,2005,14(3):715-717.
[13] 王承正,许重杰,毛书明,等.血清肝细胞生长因子水平与乳腺癌临床病理特征的关系[J].新乡医学院学报,2009,26(4):388-390.
[14] 王玉萍,楚天骄,党秋红,等.乳腺癌中肝细胞生长因子及其受体C-Met和血管内皮生长因子表达的意义[J].实用诊断与治疗杂志,2006,20(5):336-338.

