BALB/c小鼠肝肿瘤模型建立过程中胰腺的改变及肝脏超微结构特点
信 波,殷继鹏,王艳霞,崔 颖,张立成,王瑞安(解放军第88医院肿瘤科,泰安 7000;第四军医大学西京医院病理科;第四军医大学西京医院消化病院;第四军医大学唐都医院临床实验与检验、输血科;通讯作者,E-mail:wangra@fmmu.edu.cn)
原发性肝癌(简称肝癌)是当今世界范围内第6常见的恶性肿瘤,但因预后差,生存时间短,死亡率居所有恶性肿瘤的第3位。我国属于肝癌高发地区,新发病例占全球的55%左右,且我国肝癌患者发病年龄较轻、病情进展较快。由于发病早期多无典型的临床症状,初诊肝癌患者多为Ⅲ-Ⅳ期,从而导致肝癌手术切除率较低、总体预后较差[1,2]。因而明确肝癌的发病机制、生物学特性及实现对肝癌的防治是我国医学工作者面临的迫切课题。因此,合适的肝癌动物模型是肝癌基础与临床研究工作中的重要材料。

图1 BALB/c小鼠致肝癌模型在不同时期肝脏组织镜下表现 (HE,×100)Fig 1 Morphological changes of liver tissues in liver neoplasm models of BALB/c mouse at different stage (HE,×100)
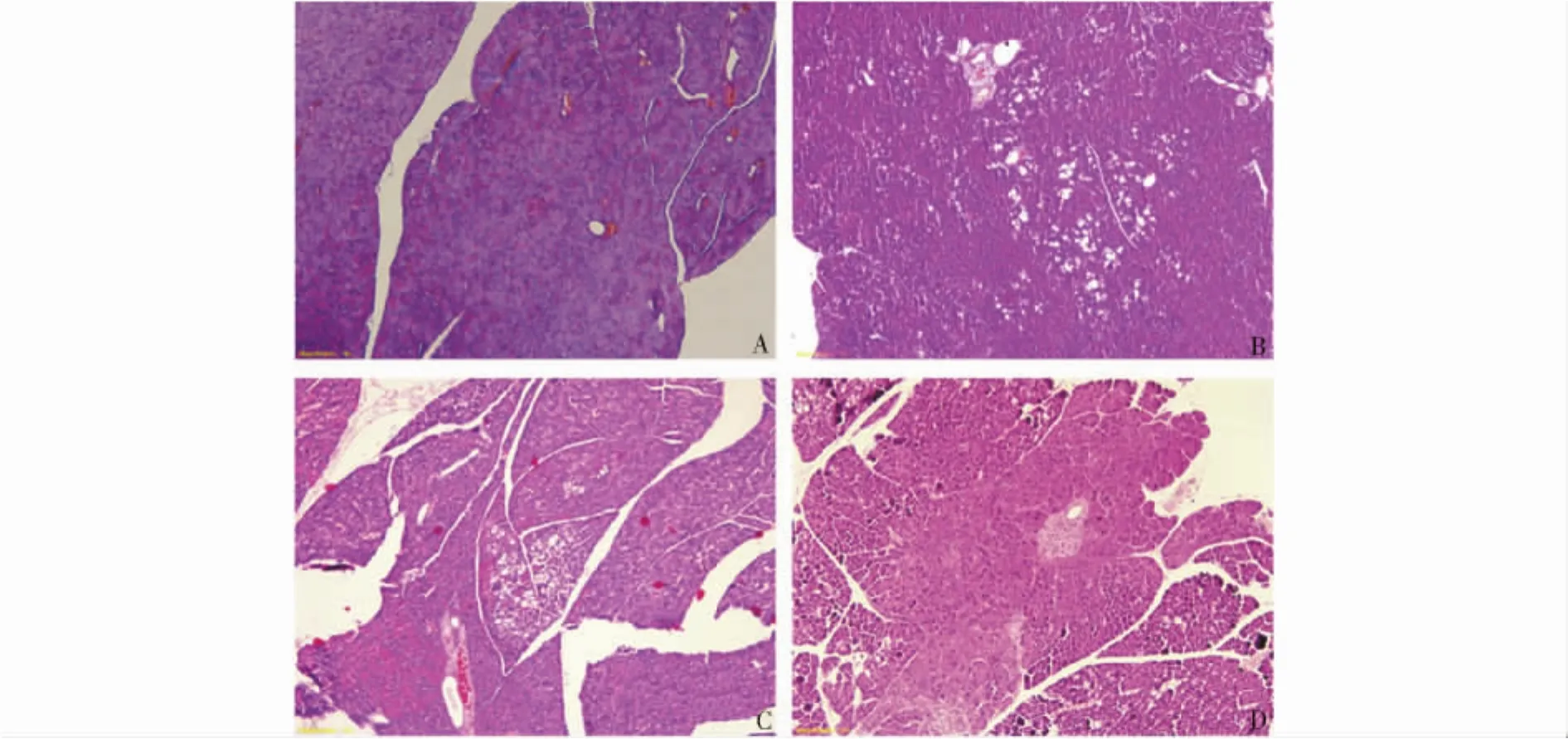
图2 BALB/c小鼠致肝癌模型在不同时期胰腺组织镜下表现 (HE,×100)Fig 2 Morphological changes of pancreas in liver neoplasm models of BALB/c mouse at different stage (HE,×100)
目前虽有报道可用CCl4等化学制剂诱发小鼠肝癌,但成功率偏低,诱导时间较长(8-20个月),且诱癌过程中死亡率高[3]。单纯应用二乙基亚硝胺(DEN)虽能在20周内成功诱发大鼠肝癌[4];但发现单纯使用DEN行小鼠诱发肝癌实验中,可能同时诱发出小鼠肝、肺和消化道等多种肿瘤[5]。且目前在转基因或基因敲除小鼠的相关研究中尚无合适的小鼠肝癌模型可供比较研究[6,7]。故我们尝试采用改进过的DEN/CCl4/乙醇诱导BALB/c雄性小鼠产生肝肿瘤,并在造模过程中观察小鼠肝脏、胰腺及肝组织超微结构的改变。
1 材料与方法
1.1 材料
1.1.1 实验动物 BALB/c雄性健康小鼠,6-8周龄,体重20-25 g,购自第四军医大学实验动物研究所。所有动物实验均符合第四军医大学实验动物研究所管理委员会动物管理和使用的有关规定执行。
1.1.2 主要试剂 DEN购自天津化学试剂研究所;多聚甲醛、CCl4购自天津市红岩化学试剂厂;乙醇购自陕西宝鸡酒精厂;苏木精、伊红购自上海化学试剂厂。
1.2 实验方法
1.2.1 诱癌方法 将小鼠按体重从小到大编号,查随机数字表获得随机数,将每个动物的随机数从小到大排列,1-14号为实验1组(60 d处死组),15-28号为实验2组(90 d处死组),29-42号为实验3组(120 d处死组),43-56号为实验4组(150 d处死组),57-78号为对照组(PBS缓冲液组),即实验组每组14只小鼠和对照组22只小鼠。实验组小鼠第1天腹腔注射DEN 100 mg/kg(生理盐水配制)。第4天开始用CCl4和橄榄油混合液(配制体积比1∶4)灌胃,5 ml/kg,每周2次。第3周再行DEN的生理盐水溶液灌胃1次,50 mg/kg,同时开始用9%的乙醇溶液喂养,从第4周起将CCl4橄榄油溶液灌胃剂量加大至8 ml/kg,每周2次;同时以正常小鼠颗粒饲料喂养。对照组小鼠仅以正常小鼠颗粒饲料喂养,自由饮用蒸馏水,同时以PBS缓冲液灌胃作对照,8 ml/kg,2 次/周。于第 60,90,120 和 150 天处死相应的实验组小鼠并取材肝脏及胰腺组织,对照组小鼠于第60,90和120天各取材4只,余10只对照组小鼠于第150天取材。
1.2.2 光镜下观察 在上述取材时间点取材实验组及对照组小鼠肝和胰腺组织,4%多聚甲醛固定,常规石蜡包埋,制成4 μm厚的连续切片,苏木素-伊红(HE)染色,光镜观察。
1.2.3 透射电镜观察 于给药后第150天时取材实验4组和对照组小鼠肝组织,切成1 mm3小块,投入缓冲的2.5%戊二醛固定液中固定2 h,磷酸蔗糖缓冲液冲洗,1%锇酸后固定1 h,逐步酒精、丙酮脱水,EponS12包埋,制成超薄切片,醋酸双氧铀和枸橼酸铅双重染色,JEM-2000EX透射电子显微镜观察并拍照。
1.2.4 血糖值测定 于给药后第150天时,利用便携式电子血糖仪及试纸条测定小鼠血糖值。测定时,消毒小鼠尾尖,待干燥后剪开尾尖血管,将小鼠尾巴保持下垂,使破损处流出的血液顺利吸进试纸条,记录血糖仪所显示的测试结果。注意剪开尾尖血管后,勿加力挤压,以免组织液混入血样,造成检测结果偏差。
1.3 统计学方法
采用统计软件SPSS 13.0进行数据处理。计量资料数据以±s表示,两组间比较采t检验;计数资料两组间比较采取Fisher确切概率法。检验水准a=0.05。
2 结果
2.1 小鼠肝肿瘤诱发情况
实验组小鼠在诱癌过程中共死亡19只,主要发生在第1-2个月。在相应时间点取材实验组小鼠病变肝组织时,实验1组小鼠存活9只,实验2组存活9只,实验3组存活10只,实验4组存活9只。造模过程中,对照组小鼠未出现死亡,平均体重增加明显,达(34.9±1.9)g;而实验组存活小鼠仅增长至(28.2±2.2)g,较对照组小鼠体重减轻明显(P<0.05)。
肝脏组织镜下观:对照组小鼠在不同的取材时点,肝细胞均排列正常,肝板规则(图1,见第245页)。实验组存活小鼠肝脏组织于给药后第60天出现炎症,第90天发生肝纤维化,第120天肝纤维化改变加重。第150天时,实验4组存活小鼠均出现肝细胞排列紊乱,细胞多呈多角形,胞质丰富,核大,有清楚的核仁,细胞异型性明显,符合中、高分化肝细胞癌(HCC)特征(图1,见第245页)。
2.2 小鼠胰腺及血糖变化
胰腺组织镜下观:正常小鼠胰腺组织结构完整,细胞形态佳。实验组存活小鼠第90天时,胰腺出现散在的脂肪变性;第120天时,脂肪变性范围较前加大,但细胞内变性的程度较前减轻;第150天时,脂肪变性病变范围和程度均加大,甚至出现变性坏死区(图2,见第246页)。
给药后第150天时,测量正常小鼠和实验4组小鼠的血糖值,实验4组小鼠血糖值较对照组小鼠低[(6.33±1.06)mmol/L vs(10.43±2.25)mmol/L,P <0.05]。
2.3 小鼠肝脏组织超微结构改变
造模第150天时,透射电镜下观察肝组织超微结构:对照组肝细胞细胞核以常染色质为主,分布均匀(见图3A);胞质内粗面内质网和线粒体等细胞器的形态、数量及分布正常,未见异常(见图3B);肝细胞胆小管面,微绒毛丰富(见图3C)。实验4组存活小鼠肝细胞胞核大而扭曲,核仁大、量多,胞质少,核浆比例大(见图3D);胞质内线粒体增多造成嗜酸性改变,脂滴沉积和糖原沉积多见,内质网扩张明显(见图3E);细胞间毛细胆管微绒毛减少,外质区扩张,胆汁淤积(见图3F);并可见瘤巨细胞(见图3D)。
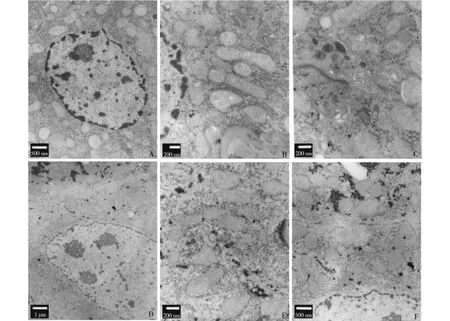
图3 BALB/c小鼠致肝癌模型造模第150天时透射电镜下表现Fig 3 Changes of ultrastructure in liver neoplasms models of BALB/c mouse at 150 d
3 讨论
理想的动物模型,可为研究疾病发病机制和探寻有效治疗途径提供助力。目前DEN诱发的鼠肝癌模型被广泛应用于肝癌病因、发病机制、化学预防等方面的研究。既往经典的DEN诱发肝癌的方式多为由“饮水法”诱发的大鼠肝癌模型,虽然造模方法简单,成癌率高;但其成模时期较长,造模成本较高[8,9]。本研究根据癌变的二阶段学说[10],在第一阶段即特异性的激发阶段,使用小剂量的致癌物DEN使正常小鼠肝细胞转变为潜伏性细胞。在第二阶段即非特异性的促进阶段,选用已知的可促人类肝癌发生的促癌物CCl4和酒精使潜伏性细胞进一步发展成为肿瘤。在诱导过程中实验组小鼠共死亡19只,主要发生在第1-2个月。除因灌胃方法不熟练致死的2只小鼠及冬季动物房气温过低引起冻伤致死的6只小鼠外,其余小鼠死亡考虑与二甲基亚硝胺及CCl4的毒性作用有关。但该诱导方法与之前的诱导方式相比,成模周期较短,致死率较低,且形态学结果提示存活的实验组小鼠成癌率达100%。
在小鼠给药后第150天时,实验组小鼠肝脏肿瘤性病变组织超微结构的改变,包括细胞核形态的改变、核分裂像的增加、巨核细胞的出现,胞质内的脂肪变性和糖原的大量积聚,线粒体结构的改变和毛细胆管的发育不佳等,均与人类肝癌超微结构的改变[11]类似,这为探讨肝癌发生过程中肝细胞超微结构的改变及可能导致的细胞功能改变的相关研究打下了基础。
此外,在造模过程中实验组小鼠胰腺出现脂肪变性,血糖值也较正常小鼠低。考虑实验4组存活小鼠胰腺病变已引起低血糖;造模过程中实验组小鼠状态不佳除了与肝脏病变相关外,还可能与低血糖相关。化学试剂的毒性及肝脏病变可能导致了胰腺病变的发生。胰腺病变这一发现在之前的文献中未见报道;也提示我们在诱发性肝肿瘤造模过程中,应当对相关重要脏器进行观察,可能为提高动物在造模过程中生存率及成功率提供助力。但仍需进一步研究肝肿瘤诱发过程中胰腺的形态改变以及血糖值的变化,以明确其发生机制。
[1] 刘宝瑞,钱晓萍,陈龙邦,等.临床肿瘤学[M].北京:科学出版社,2007:240-247.
[2] 刘煌,刘静.肝癌动物模型的研究进展[J].世界华人消化杂志,2011,19(12):1275-1278.
[3] 徐新保,冷希圣,杨晓,等.一个新的原发性肝细胞癌模型的建立及相关基因表达测定[J].中华实验外科杂志,2004,21(8):93l-934.
[4] 郝光荣.实验动物学[M].2版.上海:第二军医大学出版社,2002:201-213.
[5] 匡志鹏,谢裕安,杨帆,等.C57BL/6J小鼠肝癌动物模型的建立[J].中国普通外科杂志,2007,16(7):657-660.
[6] Bagis H,Arat S,Mercan HO,et al.Stable transmission and expression of the hepatitis B virus total genome in hybrid transgenic mice until F10 generation[J].Exp Zool A Comp Exp Biol,2006,305:420-427.
[7] Halverscheid L,Mannes NK,Weth R,et al.Transgenic mice replicating hepatitis B virus but lacking expression of the major HB-sAg[J].Med Virol,2008,80:583-590.
[8] Christian C,Fritz K,Enrique N.Rat hepatocarcinogenesis induced by N-nitrosodiethylamine and N-nitrosomoropholine continuously administered at low doses[J].Am J Pathol,1991,139:1157-1171.
[9] Tessitore L,Tomasi C,Greco M,et al.A subnecrogenic dose of diethylnitrosamine is able to initiate hepatocarcinogenesis in the rat when coupled with fasting/refeeding[J].Carcinogenesis,1996,17:289-292.
[10] 曾益兴.肿瘤学[M].2版.北京:人民卫生出版社,2006.12-33.
[11] 黄致治,郑少燕,付员根,等.膨胀型肝癌光镜、电镜和免疫组化观察[J].临床与实验病理学杂志,1996,12(3):192-195.

