冠心病患者外周血TL1A表达水平及临床意义
纪玉强,刘佩勇,谢 梅,赵 朝,程曼丽(西安市第一医院心内科,西安 710002;通讯作者,E-mail:jiyuqiang112299@126.com)
冠状动脉粥样硬化性心脏病(coronary heart disease,CHD)简称冠心病,是严重危害人类健康的常见病。近年来越来越多的实验和临床研究发现炎症反应、T细胞参与了动脉粥样硬化发生发展的各个阶段[1,2]。肿瘤坏死因子配体相关分子 1A(tumor necrosis factor lingand-related molecule-1A,TL1A)是新近发现的肿瘤坏死因子超家族的成员,可以诱导内皮细胞凋亡,抑制肿瘤生长,最近研究表明TL1A还可以活化T细胞,促进Th1细胞分泌干扰素γ(interferon γ,IFN-γ),在免疫调节及炎症反应中发挥重要作用[3-6]。为了进一步研究TL1A在冠心病中的作用,本研究检测不同类型冠心病患者外周血中TL1A表达水平,初步探讨TL1A在冠心病中的作用。
1 资料与方法
1.1 研究对象
选取2012-03~2012-12在西安市第一医院心内科住院的冠心病患者90例,根据WHO冠心病的诊断标准分为急性心肌梗死(acute myocardial infarction,AMI)组25例、不稳定型心绞痛(unstable angina pectoris,UA)组30例、稳定型心绞痛(stable angina pectoris,SA)组35 例。
AMI诊断标准为符合以下3项中的任2项:①持续剧烈胸痛30 min以上;②典型的心电图动态演变;③心肌损伤标志物肌酸激酶同工酶(CK-MB)或肌钙蛋白(TnI)等有动态变化。
UA诊断标准:患者入院前48 h内出现过静息性胸痛,一过性的ST段水平或下斜行压低≥1 mm伴或不伴有T波倒置,无CK-MB或TnI升高2倍以上,冠状动脉造影至少有1支血管直径狭窄>50%。
SA诊断标准:典型的劳力性心绞痛伴有运动试验阳性,冠状动脉造影至少有1支血管直径狭窄>50%。
排除标准:6个月内的心肌梗死、发病到抽血时间≥24 h、炎症性疾病、自身免疫性疾病、心房颤动、心脏瓣膜病、肝肾疾病、恶性肿瘤及血液系统疾病。
35例同期住院的经冠状动脉造影证实所有血管直径狭窄<50%及排除冠状动脉痉挛的住院患者为对照组。本研究得到我院伦理委员会批准并取得所有受试者的知情同意。
1.2 方法
1.2.1 主要试剂及仪器 人TL1A ELISA检测试剂盒购自美国R&D公司,RNA提取液TRIzol购自美国Invitrogen公司,逆转录试剂盒购自立陶宛Fermentas公司,SYBR Premix Ex TaqTMⅡ购自大连宝生物工程有限公司,PCR引物由上海生工生物工程技术服务有限公司合成。荧光定量PCR扩增仪(美国Bio-Rad公司),DENLEY DRAGON Wellscan MK 3酶标仪(芬兰Thermo公司)。
1.2.2 实时定量PCR检测外周血TL1A mRNA的表达水平 所有研究对象在入院时抽取静脉血3 ml,利用淋巴细胞分离液分离外周血单个核细胞,加入1 ml TRIzol液提取细胞总RNA,利用逆转录试剂盒进行cDNA第一链合成,所有实验操作均严格按照试剂盒说明书进行。参照Genbank cDNA中的TL1A及内参GAPDH基因序列利用Primer Premier 5.0软件设计引物,TL1A上游引物5’-TTTGGGGAAACAGCCAGTGT-3’,下游引物5’-GGTGTGCCCTTGGCTTATCT-3’,产物大小271 bp;GAPDH上游引物5’-GACAGTCAGCCGCATCTTCT-3’,下游引物5’-GCGCCCAATACGACCAAATC-3’,产物大小104 bp。20 μl PCR 反应体系:10 μl SYBR Premix Ex TaqTMⅡ(2 ×)、PCR 上、下游引物(10 μmol/L)各2 μl、6 μl DNA 模板。PCR 反应条件:95℃ 30 s预变性,95℃ 5 s、60℃ 30 s 40个循环,反应结束后采用Bio-Rad iQ520分析软件进行数据分析。
1.2.3 酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)检测血浆中TL1A水平 所有研究对象在入院时抽取静脉血2 ml,分离血浆-20℃保存待测。采用ELISA试剂盒测定血浆中的TL1A的含量,实验操作严格按照试剂盒说明书进行,每个样本做3个复孔。
1.3 统计学分析
利用SPSS 16.0进行统计学处理,计数资料比较采用χ2检验,计量资料采用±s表示,多组比较采用单因素方差分析,两两比较采用q检验,P<0.05认为差异有统计学意义。
2 结果
2.1 各组研究对象临床资料比较
各组研究对象在年龄、性别、吸烟、高血压、糖尿病、总胆固醇、甘油三酯、低密度脂蛋白胆固醇及高密度脂蛋白胆固醇等因素的差异没有统计学意义(P >0.05,见表1)。
2.2 各组研究对象外周血中TL1A mRNA水平的比较
实验结果发现SA组、UA组、AMI组患者外周血中TL1AmRNA水平明显高于对照组,差异有统计学意义(P<0.05),UA组、AMI组患者与SA组患者相比外周血中TL1A mRNA水平升高,差异有统计学意义(P<0.05,见表2)。

表1 各组研究对象临床资料的比较Table 1 Clinical characteristics of patients in different groups
表2 各组研究对象外周血中TL1A mRNA和血浆TLIA水平的比较(±s)Table 2 Comparison of the levels of TL1A mRNA in the peripheral plasma TL1A levels blood among different groups(±s)
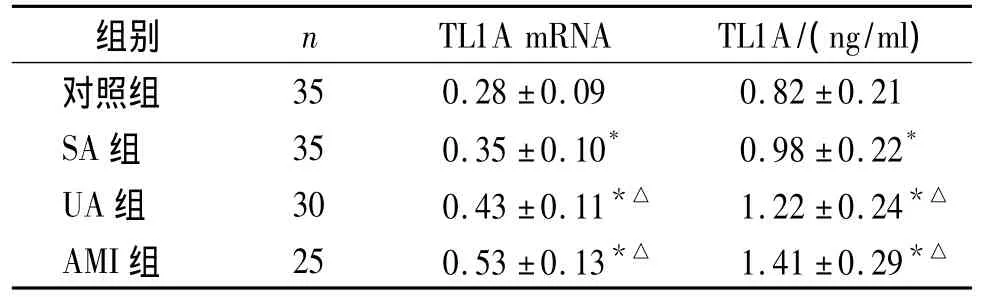
表2 各组研究对象外周血中TL1A mRNA和血浆TLIA水平的比较(±s)Table 2 Comparison of the levels of TL1A mRNA in the peripheral plasma TL1A levels blood among different groups(±s)
与对照组相比,*P<0.05,与SA组相比,△P<0.05
组别 n TL1A mRNA TL1A/(ng/ml)对照组35 0.28±0.09 0.82±0.21 SA组 35 0.35±0.10* 0.98±0.22*UA组 30 0.43±0.11*△ 1.22±0.24*△AMI组 25 0.53±0.13*△ 1.41±0.29*△
2.3 各组研究对象血浆中TL1A水平的比较
实验结果发现SA组、UA组、AMI组患者血浆中TL1A水平明显高于对照组,差异有统计学意义(P<0.05),UA组、AMI组患者与SA组患者相比血浆中TL1A水平升高,差异有统计学意义(P<0.05,见表2)。
3 讨论
冠心病主要由动脉粥样硬化(atherosclerosis,AS)引起,AS发生发展的机制尚未完全清楚,目前认为AS是一种慢性炎症性疾病,多种炎性细胞因子和免疫细胞尤其是巨噬细胞和T淋巴细胞参与了AS的发生发展过程,我们前期研究证实Th1/Th2细胞失衡以及Th17细胞均在粥样斑块的形成及斑块的不稳定性中起重要作用[7-9]。
TL1A是新近发现的属于肿瘤坏死因子超家族成员15的新型细胞因子,其基因定位于染色体9q32,由4个外显子组成,编码含有251个氨基酸的蛋白质。TL1A在内皮细胞尤其在人脐静脉内皮细胞中高表达,T细胞、B细胞、NK细胞、单核细胞及树突状细胞也少量表达,激活状态下表达显著增多。TL1A不仅可以诱导内皮细胞凋亡,抑制肿瘤生长,而且研究表明TL1A可以与死亡受体3结合,为T淋巴细胞活化提供第二刺激信号,可以促进巨噬细胞和中性粒细胞趋化至炎性部位,同时TL1A具有独特的Th1细胞极化作用,促进白细胞介素2(interleukin 2,IL-2)、IFN-γ 等炎性因子的释放[4-6]。此外TL1A能够增强Th17细胞的增殖和分化,促进其释放前炎症因子IL-17[10-13]。国外学者研究发现TL1A在人颈动脉粥样斑块中高表达,TL1A可以诱导细胞高表达促炎性因子和趋化因子,产生细胞外基质金属蛋白酶,促进细胞外基质降解,从而降低斑块的稳定性[14-17]。我们实验结果发现不同类型的冠心病患者外周血中TL1A mRNA水平及血浆TL1A水平明显高于对照组,差异有统计学意义(P<0.05),AMI、UA组患者与SA组患者相比外周血中TL1A mRNA水平及血浆TL1A水平升高,差异有统计学意义(P>0.05)。综合目前关于冠心病及TL1A的研究结果,我们推测冠心病患者体内TL1A水平升高,可能促进巨噬细胞和中性粒细胞趋化,活化T淋巴细胞,分泌炎性细胞因子,促进动脉粥样硬化斑块的形成。同时AMI及UA患者体内TL1A水平明显升高,在促进炎症因子释放的同时,可能促进了Th1及Th17细胞极化,产生细胞外基质金属蛋白酶,降低斑块的稳定性,导致AMI及UA的发生。
综上所述,冠心病患者外周血中TL1A水平增高,可能通过炎性反应和Th1及Th17细胞极化,参与了粥样斑块的形成,导致斑块的不稳定性,但TL1A水平增高及具体作用机制尚待进一步研究,这对预防和治疗冠心病尤其是急性冠脉综合征具有一定的指导意义。
[1] Sarwar N,Thompson AJ,Di Angelantonio E.Markers of inflammation and risk of coronary heart disease[J].Dis Markers,2009,26(5-6):217-225.
[2] Libby P.Inflammation in atherosclerosis[J].Nature,2002,420(6917):868-874.
[3] Hsu H,Viney JL.The tale of TL1A in inflammation[J].Mucosal Immunol,2011,4(4):368-370.
[4] Meylan F,Richard AC,Siegel RM.TL1A and DR3,a TNF family ligand-receptor pair that promotes lymphocyte costimulation,mucosal hyperplasia,and autoimmune inflammation [J].Immunol Rev,2011,244(1):188-196.
[5] Bayry J.Immunology:TL1A in the inflammatory network in autoimmune diseases[J].Nat Rev Rheumatol,2010,6(2):67-68.
[6] Bamias G,Martin C,Marini M,et al.Expression,localization,and functional activity of TL1A,a novel Th1-polarizing cytokine in inflammatory bowel disease[J].J Immunol,2003,171(9):4868-4874.
[7] 赵朝,席新龙,袁祖贻,等.急性冠脉综合征患者辅助性 T细胞亚群的变化及意义[J].山西医科大学学报,2010,41(12):1050-1054.
[8] 纪玉强,赵朝,程曼丽.Th17细胞与动脉粥样硬化[J].中国动脉硬化杂志,2011,19(10):870-874.
[9] 赵朝,苏莹,程曼丽,等,冠心病患者辅助性T细胞亚群17的变化及意义[J].西安交通大学学报:医学版,2011,32(3):311-315.
[10] Jones GW,Stumhofer JS,Foster T,et al.Naive and activated T cells display differential responsiveness to TL1A that affects Th17 generation,maintenance,and proliferation [J].FASEB J,2011,25(1):409-419.
[11] Pappu BP,Borodovsky A,Zheng TS,et al.TL1A-DR3 interaction regulates Th17 cell function and Th17-mediated autoimmune disease[J].J Exp Med,2008,205(5):1049-1062.
[12] Takedatsu H,Michelsen KS,Wei B,et al.TL1A(TNFSF15)regulates the development of chronic colitis by modulating both T-helper 1 and T-helper 17 activation [J].Gastroenterology,2008,135(2):552-567.
[13] Kamada N,Hisamatsu T,Honda H,et al.TL1A produced by lamina propria macrophages induces Th1 and Th17 immune responses in cooperation with IL-23 in patients with Crohn's disease[J].Inflamm Bowel Dis,2010,16(4):568-575.
[14] Kim WJ,Kang YJ,Suk K,et al.Comparative analysis of the expression patterns of various TNFSF/TNFRSF in atherosclerotic plaques[J].Immunol Invest,2008,37(4):359-373.
[15] Bamias G,Stamatelopoulos K,Zampeli E,et al.Circulating levels of TNF-like cytokine 1A correlate with the progression of atheromatous lesions in patients with rheumatoid arthritis[J].Clin Immunol,2013,147(2):144-150.
[16] McLaren JE,Calder CJ,McSharry BP,et al.The TNF-like protein 1A-death receptor 3 pathway promotes macrophage foam cell formation in vitro[J].J Immunol,2010,184(10):5827-5834.
[17] Kang YJ,Kim WJ,Bae HU,et al.Involvement of TL1A and DR3 in induction of pro-inflammatory cytokines and matrix metalloproteinase-9 in atherogenesis[J].Cytokine,2005,29(5):229-235.

