烟草白粉病抗性基因的QTL定位
牟建英 ,钱玉梅,任民,刘艳华,张兴伟,王志德,潘应花
1中国农业科学院烟草研究所/国家烟草行业烟草病虫害监测与综合治理重点开放实验室,青岛 266101;
2 农业部烟草类作物质量控制重点开放实验室,青岛 266101;
3 中国农业科学院研究生院,北京 100081
烟草白粉病是由二孢白粉菌(Erysiphe cichoracearum DC)侵染引起的烟草主要叶部病害之一。白粉病侵染的叶片在调制过程中病斑会继续扩大,叶片薄如纸状,易破碎,缺乏弹性,影响烟叶质量[1]。由于我国大面积种植的烤烟品种均不抗白粉病[1],化学防治仍是白粉病的主要防治方法,除了增加人力、物力投入,还会引起环境污染等生态问题,培育抗病品种是防治烟草白粉病最为经济有效的措施。开展抗性基因的QTL定位,对烟草白粉病抗性基因进行分子生物学研究,对于明确烟草白粉病的抗病机理和分子标记辅助选择育种具有重要意义。
烟草白粉病抗性遗传规律,以及分子标记辅助选择育种等方面的研究较少。李华丽等[2]以台烟7号和白肋21作为杂交亲本,后代自交衍生的127个F2和F2:3家系为材料,检测到1个烟草白粉病加性QTL,贡献率为11.63%,本文利用2317对SSR引物对烟草白粉病抗性基因进行QTL分析,为烟草抗白粉病分子标记辅助选择育种和抗白粉病相关基因的克隆奠定基础。
1 材料和方法
1.1 试验材料
母本台烟7号是抗白粉病品种,父本NC89是感白粉病品种。台烟7号与NC89杂交得到F1,F1自交得到285株F2单株。接种鉴定病原菌为二孢白粉菌Erysiphe cichoracearum DC。所用实验材料均来自中国农业科学院烟草研究所。
1.2 烟草白粉病抗性的接种鉴定
对烟草白粉病抗性的苗期鉴定于2012年在中国农业科学院烟草研究所温室内完成。鉴定材料包括亲本、F1、F2,烟苗5-6叶期采用喷雾接种法接种,孢子悬浮液浓度为1.25×107个/mL,接种20天后调查病情。
根据GB/T 23222-2008中烟草白粉病病害严重度分级标准,逐株以叶片为单位分级调查。
0级:无病斑;
1级:病斑面积占叶片面积的5%以下;
3级:病斑面积占叶片面积的6%~10%;
5级:病斑面积占叶片面积的11%~20%;
7级:病斑面积占叶片面积的21%~40%;
9级:病斑面积占叶片面积的41%以上。
群体抗性分级标准:
高抗:0≤病情指数≤15;
抗病:15<病情指数≤35;
中抗:35<病情指数≤55;
感病:55<病情指数≤80;
高感:80<病情指数≤100。
病情指数(DI):DI=∑(每个病级叶片数×病级数)/(叶片总数×最高病级数)×100。
1.3 DNA提取及SSR体系
DNA提取参照天根生化科技有限公司DNA提取试剂盒提取方法,略有改动。
SSR引物采用2011年Bindler等[3]发布的烟草高密度遗传连锁图谱,共计2317对,由上海生物工程有限公司合成。
PCR反应体系:总体积为10 μL,包括Green Master 2×Mix 5 μL,DNA(30-50 ng·μL-1)1 μL,正反向引物(10 μmol·L-1)各 0.5 μL,ddH2O 3μL。反应程序为:94℃预变性5 min;94℃变性15 s,55℃退火15 s,72℃延伸30 s,35个循环;72℃延伸7 min,4℃保存。其中退火温度因序列不同略有调整。扩增产物用6%非变性聚丙烯酰胺凝胶800V恒电压电泳分离,银染显色后用灯箱进行观察。
1.4 SSR标记筛选、连锁图构建与QTL定位
从2317对SSR引物中筛选在两亲本间表现出多态性的引物,并对部分F2单株进行分析,进一步筛选出能扩增出清晰可统计带型的SSR引物,最后利用得到的SSR引物对285株F2单株进行分析。
用OneMap软件包对F2群体的SSR标记分型数据进行分析,构建遗传连锁图谱,用MapDraw V2.1[4]绘制遗传连锁图。
利用WinQTLCart2.5 软件进行QTL分析[5],利用置换检测1000次重复,估算基因组范围内α=0.05水平上的LOD值。本研究中使用的阈值为LOD≥2.5。
2 结果与分析
2.1 烟草白粉病的抗性鉴定结果
母本台烟7号表现为对白粉病免疫,父本NC89表现为感白粉病,平均病情指数为74.24, F1表现为感白粉病,平均病情指数为76.81, F2表现出抗病性分离,其病情指数分布如图1。F2群体病情指数基本符合正态分布,可以用于QTL分析。
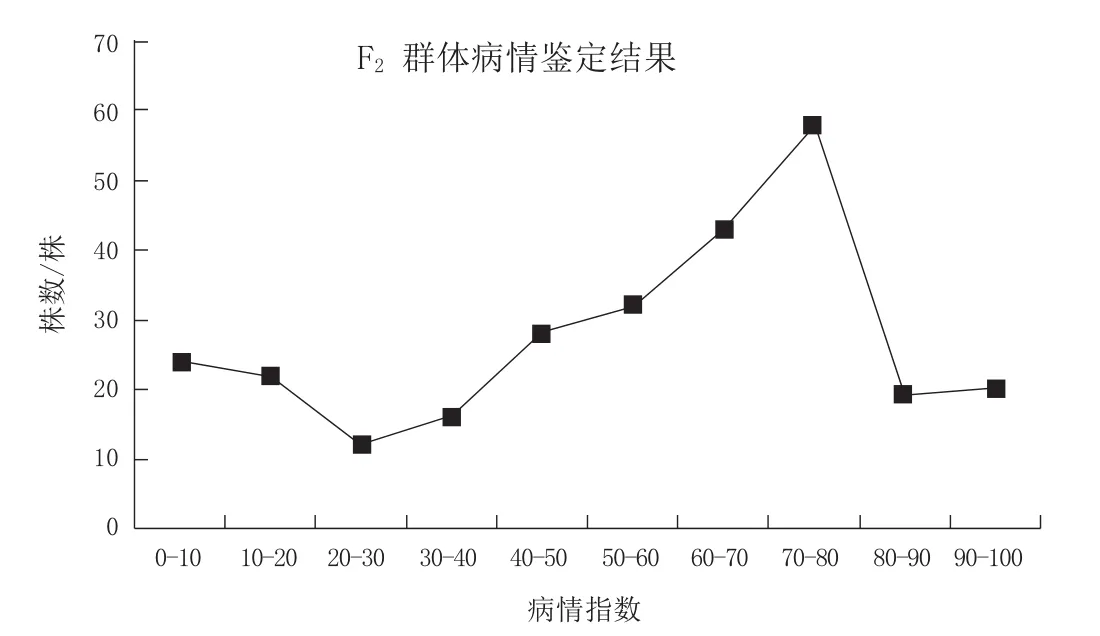
图1 F2群体病情指数分布图
2.2 SSR标记连锁群的构建
利用亲本台烟7号和NC89对2317对SSR引物进行筛选,共得到112对多态性引物,多态率为4.83%。用筛选出的112对多态性引物对部分F2群体单株DNA进行扩增,选择61对多态显著且扩增稳定的SSR引物。用这61对引物对F2群体的285个单株DNA进行扩增,电泳检测,记录带型。
利用OneMap软件在LOD≥3的条件下构建遗传连锁图谱。该图谱全长481.8 cm ,包含45个标记位点,标记间平均遗传距离为10.7 cm 。图谱共包含15个连锁群,每个连锁群平均有3个标记,其中最长连锁群长64.7 cm ,最短的为5.2 cm 。另外有16个标记未整合到该图谱上。
2.3 烟草白粉病抗性基因的QTL
利用WinQTLCart2.5 软件,复合区间作图法对烟草白粉病抗性QTL进行定位。在14号连锁群上检测到1个QTL,暂命名为pm14.1,其加性效应为-14.38,贡献率为21.02%,LOD值为9.45,为减效位点,增效基因来自于感病的父本NC89。Pm14.1 与引物52725 紧密连锁,遗传距离为1.01 cm。
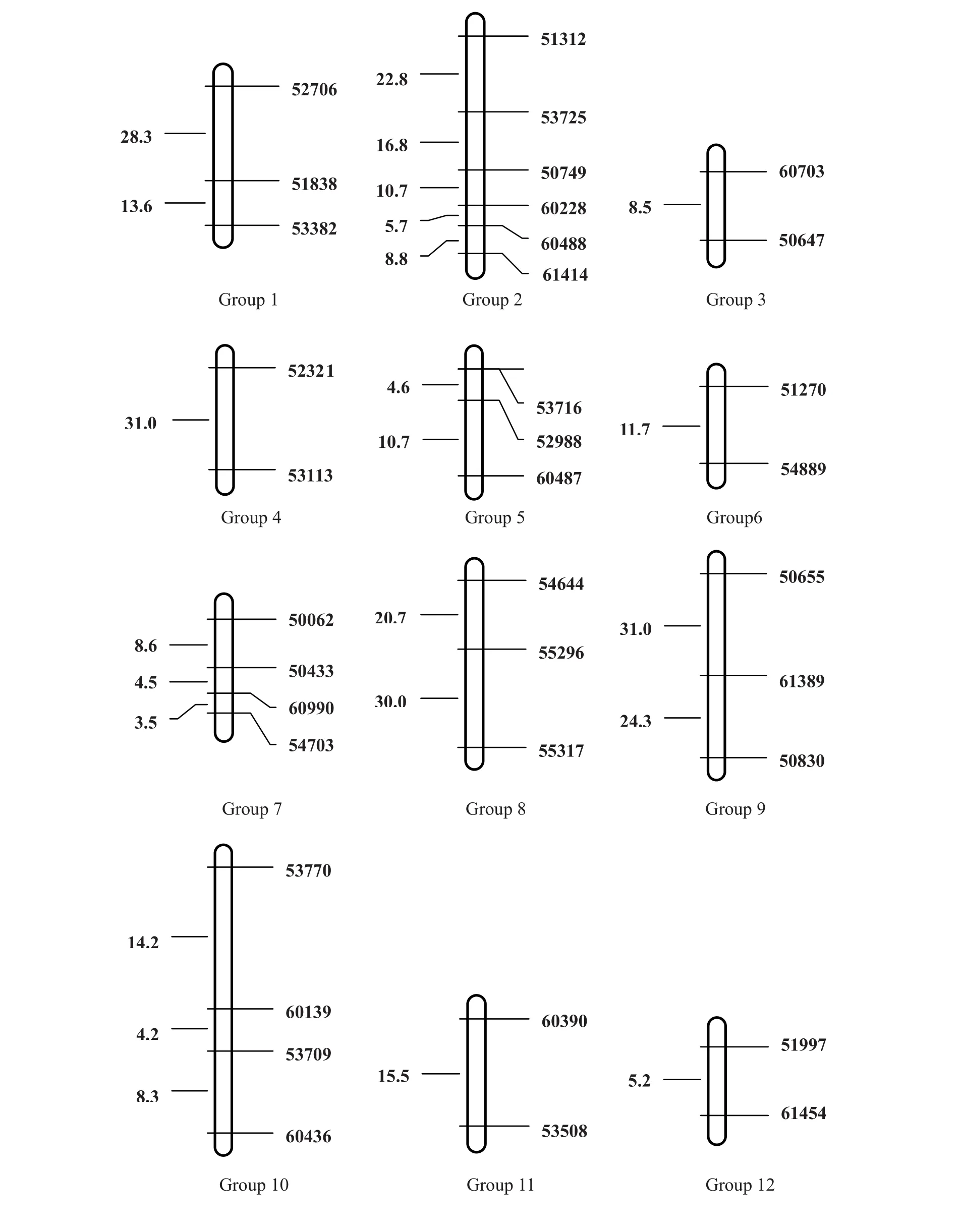
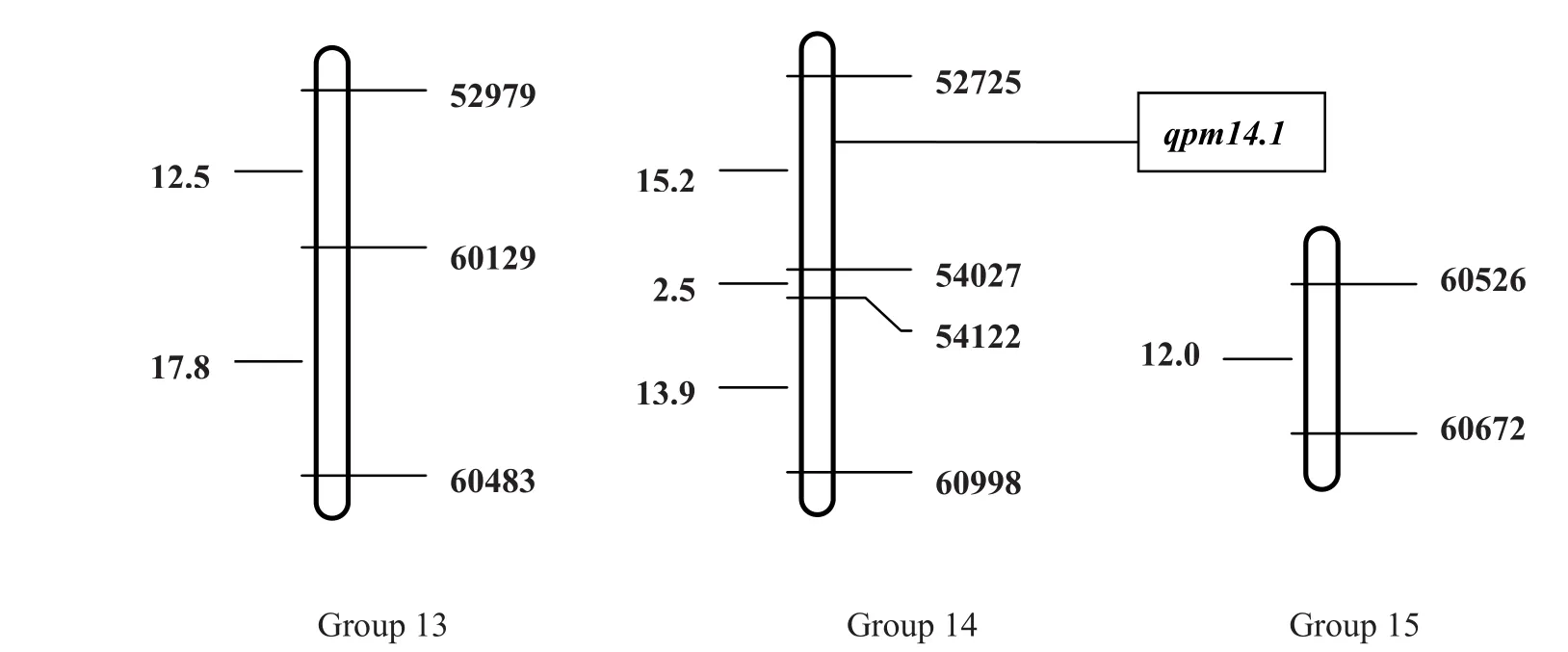
图2 台烟7号×NC89 F2群体SSR标记连锁群的构建及烟草白粉病抗性基因的QTL定位
3 讨论
目前,关于烟草白粉病抗性遗传规律的研究很少,而且结果也不尽一致。主要观点有:Kokubu品种表现为重复隐性等位基因控制的遗传[1];Hicks55、Pobeda3、TB22三个品种的抗性均表现为显性单基因遗传[1];塘蓬抗性表现为隐性基因遗传[6]。导致不同结果的原因可能有以下几方面:首先,烟草品种不同,其抗性遗传机制可能不同;其次,烟草白粉菌种类不同,接种时可能是病菌混合体【瓜单囊壳〔Sphaerotheca fuliginea(Schlecht.)Poll.〕,二孢白粉菌(Erysiphe cichoracearum DC.)】而不是单孢培养物,也会导致不同的鉴定结果;再次,不同研究所采用的抗性鉴定方法及分级标准也不尽一致;最后,环境对白粉病的发生也有较大的影响。而本研究所采用的烟草品种NC89,是我国栽培种植面积较大的品种[7],选其作为亲本可使本研究结果具有较好的代表性。同时,菌种为纯化后的单一菌种,接种及发病调查严格按照国家标准执行,严格控制环境温湿度。以上措施有效保证了研究结果的可靠性和准确性。
本研究检测到一个烟草白粉病抗性QTL位点,该位点与SSR标记52725紧密连锁,遗传距离为1.01 cm,与李华丽等以往的研究相比,在加性效应上方向相同,均为负值,但贡献率相差较大。据此可认为两者为不同的QTL位点。由于数量性状遗传在一定程度上受到环境的影响,因此,检测到的QTL数量及效应可能存在不同程度的差异[8-11],本研究认为可以在不同的环境条件下对烟草白粉病抗性基因进行进一步的QTL分析,以期获得不同环境条件下的QTLs位点,对已得到的QTL位点进行验证。
烟草白粉病是烟区广泛分布的真菌性病害,对烟叶产量和品质造成严重影响,随着分子标记技术的发展,为发掘、鉴定种质资源中QTL的等位变异提供了有效的技术手段,通过标记辅助选择培育聚合不同QTL等位变异的高抗品种,将成为白粉病抗病基因资源鉴定与利用的一条新途径[12]。
4 结论
本研究利用台烟7号×NC89构建的F2群体对烟草白粉病抗性基因进行了QTL分析。检测到1个与烟草白粉病抗性紧密连锁的QTL位点,该QTL位于52725和54027之间,与52725的遗传距离仅为1.01cm,其加性效应为-14.38,贡献率为21.02%。
[1]朱朝贤, 王彦亭, 王智发, 等.中国烟草病害[M].北京:中国农业出版社, 2002: 75-77.
[2]李华丽, 陈美霞, 周东新, 等.烟草六个重要性状的QTL定位[J].作物学报, 2011, 37(9): 1577-1584.
[3]Gregor Bindler, Jörg Plieske, Nicolas Bakaher.A high density genetic map of tobacco obtained from large scale microsatellite marker development[J].Theor Appl Genet,2011, 123: 219-230.
[4]刘仁虎, 孟金陵.MapDraw.在Excel中绘制遗传连锁图的宏[J].遗传, 2003, 25(3): 317-321.
[5]Zeng Z B.Theoretical basis of separation of multiple linked gene effects on mapping quantitative trait loci [J].Proc Natl Acad Sci USA, 1993, (90):10972-10976.
[6]佟道儒.烟草育种学[M].北京: 中国农业出版社, 1997:439-442.
[7]刘国顺.烟草栽培学[M].北京: 中国农业出版社,2003:106-107.
[8]邢永忠, 徐才国, 华金平, 等.水稻穗部性状的QTL与环境互作分析[J].遗传学报, 2001, 28 (5): 439-446.
[9]白智龙, 袁晓君, 蔡润, 等.黄瓜霜霉病抗性QTL分析[J].自然科学进展, 2008, 18(6): 706-710.
[10]Sakata Y, Kubo N, Morishita M, et al.QTL analysis of powdery mildew resistance in cucumber (Cucumis sativus L.) [J].Theor Appl Genet, 2006, 112: 243-250.
[11]刘龙洲, 蔡润, 袁晓君, 等.黄瓜抗白粉病QTL分子标记定位[J].中国科学, 2008, 38(9): 851-856.
[12]霍纳新, 周荣华, 张丽芳, 等.小麦白粉病抗性QTL分析[J].作物学报, 2005, 31(6): 692-696.

