苏教版选修4“原电池工作原理”教学设计
步月华 李胜荣
(江苏省丹阳高级中学 江苏 丹阳 212300)
一、教材分析
本节内容为高中化学新课程(苏教版)选修4 的专题1 第二单元的重要内容之一。该内容学生在化学2 已有一定的了解,本节是该内容的加深拓展,主要是增加了盐桥的内容。本节课试图以“教师巧妙引导,学生自主探究”的学习方式学习,大致分为:回顾原电池,改良原电池,设计原电池,书写电极反应等几个基本环节。在课程实施过程中,学生动手实验,观察现象,发现问题,提出疑问,分析讨论,师生互动,最后找到解决办法,培养了学生的问题意识、动手能力。
二、教学目标
1.知识与技能
(1)在化学2 的基础上,进一步学习原电池工作原理,探究单液原电池的不足和改进;
(2)学习实验研究的方法,能设计原电池,形成完备的原电池概念,理解构成原电池的条件,掌握电极反应式的书写。
2.过程与方法
(1)通过实验探究原电池原理,学会观察、学会提问、学会思考;
(2) 通过对单液原电池与双液原电池的设计对比,学会比较、评价设计方案。
3.情感态度与价值观
(1)通过自主探究根据现象设疑,根据疑问求解的模式,进行自主学习,激发学习兴趣,培养科学探究态度和科学创新精神;
(2)在小组合作的过程中,培养团结合作的探究学习观念,强化合作意识。
三、教学思路
水果电池视频引入→复习原电池工作原理→学生设计简单原电池→通过实验现象,学生发现单液原电池缺陷→教师启发学生,引出“盐桥”,找到改良方法→师生归纳、总结→学以致用

四、教学过程
[知识回顾]播放水果电池视频,视频中用1280 瓣的橙子给手机充电,场面非常震撼。
[教师] 同学们,刚才的视频中蕴藏着什么化学原理?
[学生回答]原电池原理。
[教师]以下图所示原电池装置为例回忆复习原电池的工作原理。
[学生汇报]Zn 为负极,发生氧化反应:Zn-2e-=Zn2+,锌棒逐渐溶解;Cu 为正极,溶液中的H+在Cu棒表面得电子发生还原反应:2H++2e-=H2↑,铜棒表面冒气泡。电子从锌棒流向铜棒,故电流表指针发生偏转,溶液中阳离子向正极移动,阴离子向负极移动,形成闭合回路。
设计意图:通过复习以稀硫酸为介质的Cu-Zn 原电池,迅速唤醒已学知识。
[板书]一、原电池工作原理
负极: Zn-2e-=Zn2+
正极:2H++2e-=H2↑
总反应:Zn+2H+=Zn2++H2↑
[教师]通过刚才对原电池原理的复习,请同学们来归纳构成原电池的条件。
[学生](1)两个活泼性不同的电极,较活泼的为负极;(2)电解质溶液;(3)构成闭合回路;(4)存在自发进行的氧化还原反应。
[教师]对学生的回答补充提升。
内因:自发进行的氧化还原反应;
外因:(1)两个电极(导体,可同,可不同)
负极:失电子,氧化反应
正极:得电子,还原反应
(2)电解质(提供自由离子——溶液,熔融或固体均可)
(3)闭合回路(“电子岸上走,离子水中游”)
设计意图:拓展已有知识,加深学生对构成原电池条件的认识。
[引入新知]
提出疑问: 反应Zn+Cu2+=Zn2++Cu 是吸热反应还是放热反应? 如何验证?
探究活动一: 向一只试管中加入1.0mol/LCuSO4溶液30mL,再加入适量Zn 粉,用温度计测量溶液的温度,观察温度的变化。
教师演示,请一位同学走上讲台观察实验现象,并向大家汇报所观察到的现象。
[学生汇报] 温度计示数上升,故该反应放热。
[教师] 既然这是一个对外释放能量的氧化还原反应,能否将该反应“Zn+Cu2+=Zn2++Cu”设计成原电池? 请画出装置图,写出电极反应。
[学生]上黑板板演装置图及电极反应式。
装置图:如左图。
电极反应: 负极:Zn-2e-=Zn2+
正极:Cu2++2e-=Cu
总反应:Zn+Cu2+=Zn2++Cu
[教师]请大家根据黑板上的装置图搭建实验装置,观察现象。
[学生]4 人一组,进行分组实验。
[教师]请学生汇报实验现象。
[学生]Zn 棒和Cu 棒表面均有红色物质析出(用时8分钟),电流表示数不稳定,逐渐减小。
[教师激疑]Zn 棒表面为什么会有铜析出?
[学生回答]Zn 棒与CuSO4溶液直接接触,故会发生置换反应,所以Zn 棒表面有红色物质析出。
[教师补充]对,有这种可能。还有一种可能,Zn 棒不纯,Zn 与自身的杂质构成原电池,所以Zn 棒表面会有红色物质析出。
[教师分析]原电池是在两处进行的氧化还原反应,一处失电子,一处得电子,正因为在两处进行,才有电子的定向移动,才有电流的产生,化学能才能转化为电能。要是在一处进行,就没有电子的定向移动,就不会产生电流。所以我们不希望锌与硫酸铜直接发生置换反应,即不希望得失电子都在锌表面进行。
[教师激疑]如何改进原电池,使化学能尽可能转化为电能?
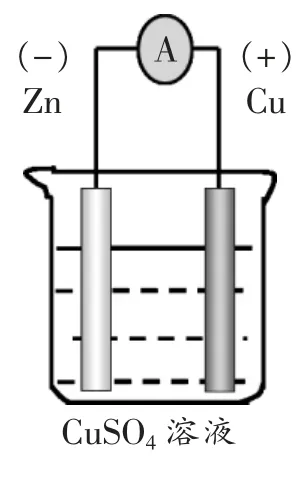
[学生]让Zn 与CuSO4溶液不直接接触,但仍然形成闭合回路。
设计意图:先动手设计,后从自己的设计中发现单液原电池的缺陷,激起学生进一步探究改进方法。培养了学生的动手能力和问题意识。
[新知介绍]
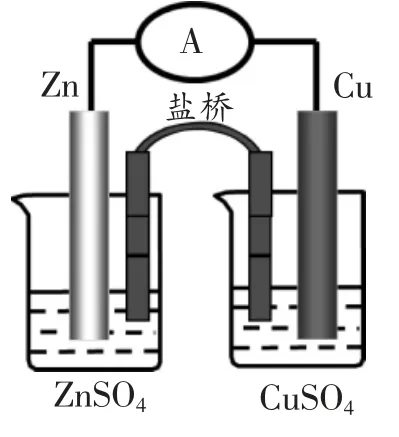
探究活动二:用盐桥将置有锌片的ZnSO4溶液和置有铜片的CuSO4溶液的烧杯连接起来,然后将锌片和铜片分别用导线与电流表相连,观察现象。
[教师]进行演示实验,请学生说出实验现象。
[学生] 电流表指针偏转,且电流稳定。
[教师]介绍盐桥:盐桥中一般装有含KCl 饱和溶液的琼脂,K+和Cl-能在琼脂内自由移动。当将盐桥拿开,电流表指针不偏转,故盐桥起着形成闭合回路的作用。
[教师]走向学生,向学生展示盐桥,并提问:琼脂像什么?
[学生]果冻、牙膏、豆腐、浆糊等。
[教师]琼脂会流出来吗?
[学生]不会。
[教师]对,琼脂与果冻、牙膏、豆腐、浆糊一样,是一种不能流动的固液混合物,以固体为主。
[交流讨论]
判断导线中电子的流向及盐桥中离子的移动方向,写出电极反应及总反应。
[学生回答] 电子从锌棒流向铜棒,盐桥中阳离子(K+)向正极区溶液移动,阴离子(Cl-)向负极区溶液移动。电极反应为:
负极:Zn-2e-=Zn2+
正极:Cu2++2e-=Cu
总反应:Zn+Cu2+=Zn2++Cu
[教师总结]负极区Zn-2e-=Zn2+,锌离子进入溶液,使负极区溶液带正电荷,阻止Zn 继续失电子进入溶液,从而使原电池反应不能顺利进行,故盐桥中的阴离子(Cl-)将向负极区溶液移动,中和正电荷,使溶液呈电中性,这样原电池反应才能持续进行。同理,盐桥中的阳离子(K+)将向正极区溶液移动。正极区和负极区的电解质溶液要不与电极材料反应,一般我们选择与电极材料对应的盐溶液,故实验中我们选择Zn/ZnSO4溶液、Cu/CuSO4溶液。
设计意图:通过探究实验来考察学生对原电池基础知识的理解,通过对实验过程中相关问题的探讨,帮助学生更好地理解双液原电池,有助于学生分析问题,解决问题能力的提高。
观看视频:探究活动二实验的微观模拟动画。

设计意图:通过形象的动画展示,加强形象思维。
[板书]二、双液原电池的优点
单液原电池的缺陷:电极材料与电解质溶液直接接触反应,化学能部分转化为热能,降低了电池的能量利用效率。
双液原电池的优点:避免了电极材料与电解质溶液的直接反应,提高了电池效率,增加了电池寿命。
[学以致用]设计原电池
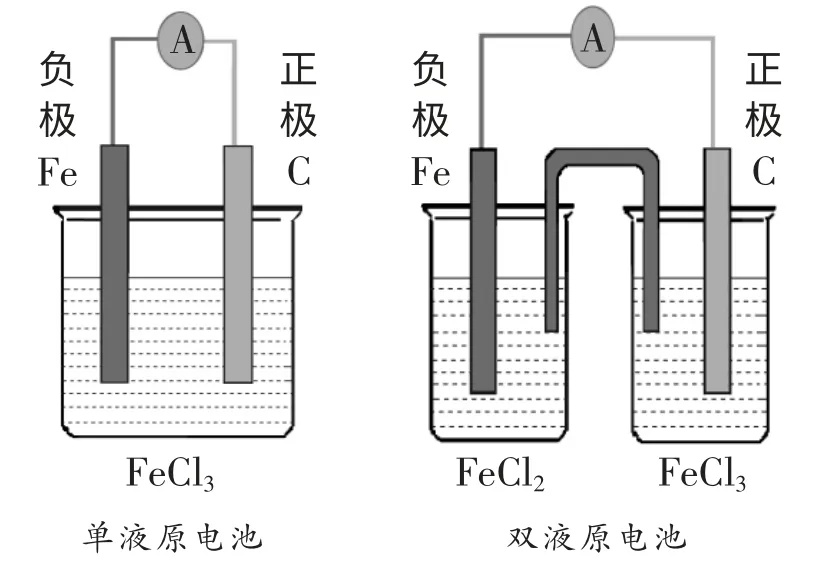
例1:将反应Fe+2Fe3+=3Fe2+,设计成原电池,画出装置图。
[教师分析]将总反应拆成两个半反应,负极:Fe-2e-=Fe2+;正极:2Fe3++2e-=2Fe2+。根据电极反应式应选择Fe 作负极,正极材料只要能导电,活动性比Fe 弱就行,若设计成单液原电池,则电解质溶液中必须含有Fe3+。若设计成双液原电池,正极区电解质溶液中必须含有Fe3+,负极区电解质溶液与负极材料配套选择含有Fe2+的溶液,装置图如下所示:
[板书]三、设计原电池思路
1.写出总反应的离子方程式,并标出电子转移方向和数目。
2.写出正负极反应式。
3.确定电极材料和电解质溶液。
设计意图:通过设计原电池,进一步强化对原电池原理的理解,强化电极方程式的书写。
五、教学反思
本节课以“橙子电池给手机充电的视频”引入,比较新颖,吸引了学生,激发了学生的学习兴趣。通过观看视频,引导学生回顾了原电池的工作原理,然后再以实验情景再现为题材,让学生自己动手设计简单原电池,通过实验现象,学生发现了单液原电池的缺陷,激发学生探究改进的方法。盐桥使双液原电池形成闭合回路,不仅出乎学生的意料,还又一次激发了学生的兴趣,引发了学生的思考。盐桥的引入不仅是一种技术进步,更是思维模式的改变,也提供了一个思想教育的机会“只有解放思想才能推动社会的进步”。本节课采用实验探究式教学,既符合化学的学科特点,也符合学生的心理和思维的发展特点。在探究活动中引导学生逐步由认识、形成新认识,这样得出的结论学生才能真正理解和牢固掌握。实验探究是让学生在具体实验事实的基础上分析问题得出结论,符合学生的思维特点,有利于在形象思维的基础上发展学生的抽象思维。整个过程的设计主要以学生的自主探究和合作学习为主要教学方法,体现了学生为主的课堂教学模式,在教学中,学生体验到了合作学习的好处,尝到了成功的喜悦。通过精心设计问题,不断激发学生的学习动机,也就是说使学生经常处于“愤悱”状态,给学生提供学习的目标、思维和空间,学生自主学习才能真正成为可能。

