等位基因特异荧光PCR法检测CYP2C19基因型
夏长胜,刘 畅,孙媛媛,龙 彦,赵晓涛
(北京大学人民医院检验科,北京100044)
人CYP2C19(cytochrome P450 2C19)是细胞色素氧化酶P450 的主要成分之一,代谢一系列临床上常用药物,活性存在显著的个体差异,表现为血药浓度的个体差异。CYP2C19 基因具有遗传多态性,野生型为CYP2C19* 1/* 1 型,CYP2C19* 2 型和CYP2C19* 3 型是中国人群中最常见的两种等位基因型[1]。CYP2C19* 2 型为CYP2C19 基因第5 外显子681G >A 点突变,导致剪接缺陷[2];CYP2C19* 3型为第4 外显子636G >A 点突变,提前产生终止密码子[3]。这些点突变引起CYP2C19 基因编码的酶活性丧失,代谢底物的能力减弱,使血药浓度增高,从而引起与血药浓度相关的药物不良反应。一般携带2 个无功能等位基因者称为弱代谢者,中国人群中的弱代谢型99%以上为* 2 型纯合子、* 3 型纯合子及* 2/* 3 型杂合子[1]。CYP2C19 基因分型检测结果可用于氯吡格雷、磺脲类药物及其他相关代谢药物的个体化给药指导。
本研究拟使用“等位基因特异PCR”结合荧光探针技术,检测CYP2C19 基因第5 外显子681 位点和第4 外显子636 位点的核苷酸类型,判断CYP2C19 基因型,从而了解人群中CYP2C19 基因型的分布,同时使用金标准DNA 直接测序法评价荧光PCR 法检测结果。
1 材料与方法
1.1 主要试剂
人CYP2C19 基因分型检测试剂盒(荧光PCR法)(苏州旷远生物分子技术公司);血液基因组提取试剂盒(天根生化科技公司)。
1.2 研究对象
选择临床剩余外周静脉EDTA-K2抗凝全血标本,试验样本供者的性别年龄不限。样本排除标准:有输血史,骨髓移植史的患者血液样本。共收集356 例样本,其中男性145 例,女性211 例。本实验获得北京大学人民医院医学伦理委员会批准。研究所用标本为受试者在诊疗中正常采集样本的剩余样本,非为临床试验特意提供,检测结果不作为临床诊断依据,病人姓名用编号代替,受试者权益、安全和隐私能够得到充分保障。基于上述原因,不需与受试者签署知情同意书。
1.3 核酸提取
取300 μL EDTA-K2抗凝全血,提取基因组DNA,最后溶于50 μL洗脱液。如在24 h内检测,于2 ~8 ℃保存,否则-20 ℃以下保存备用。
1.4 PCR 荧光法检测CYP2C19 基因型
按照试剂盒说明书进行操作,对每份标本采用4 管独立的PCR 反应体系,即采用CYP2C19 2G、2A、3G 及3A PCR 反应液分别检测CYP2C19 681G>A 和636G >A 点突变,使用ROX 标记的内参探针对PCR 反应结果进行质量控制,同时每种PCR反应液均做阳性对照(相应质控品作为模板)及空白对照(不加模板)。PCR 反应总体系为25 μL,其中PCR 反应液23 μL,反应酶1 μL,模板1 μL。实时PCR 反应在LightCycler 480ⅡPCR 仪上进行。反应条件:去污染37 ℃2 min;预变性95 ℃3 min;95 ℃20 s,58 ℃30 s,65 ℃45 s,10 个循环;95 ℃20 s,58 ℃30 s设置Fam 及Rox 双通道采集荧光信号,65 ℃45 s,30 个循环;冷却25 ℃1 min。
结果分析:4 种质控品检测反应体系内的目的检测荧光信号和内参荧光信号形成的扩增曲线,其循环阈值(threshold cycle,Ct)均应≤23;否则反应体系异常。4 种反应液的空白对照反应体系,应无扩增信号或者扩增曲线的Ct >23,若空白对照反应体系的扩增曲线的Ct≤23,则反应体系异常。样本基因型判断参考值:对于DNA 样本的4 种检测反应体系,其内参扩增曲线的Ct 值均应≤23,如果内参Ct 值>23,则反应体系异常。在内参扩增曲线的Ct 值正常的情况下,目的检测信号的扩增曲线Ct 值≤23,则为阳性,否则为阴性。基因分型判断见表1。

表1 荧光PCR 法检测CYP2C19 基因型Table 1 CYP2C19 genotyping by fluorescent PCR
1.5 DNA 测序法检测CYP2C19 基因型
DNA 直接测序(Sanger 测序法)检测CYP2C19基因型由北京六合华大基因科技股份有限公司提供服务。
1.6 统计学分析
应用SPSS16.0 软件进行统计学分析。采用McNemar-Bowker(配对卡方)检验分析两种方法有无显著性差异。计算Kappa(K)值;K 值的判定:K >0.75,一致性好;0.40≤K≤0.75,一致性较好;K<0.4,一致性差。
2 结果
DNA 直接测序法检测结果示例见图1 ~2。CYP2C19 基因型检测结果见表2。CYP2C19 * 1/* 1型、CYP2C19* 1/* 2 型、CYP2C19* 2/* 3 型、CYP2C19* 3/* 3 型、CYP2C19* 2/* 2 型及CYP2C19* 1/*3 型的频率分布:使用荧光PCR 法检测时分别为46.6% (166/356)、33.2% (118/356)、2.0% (7/356)、0.8% (3/356)、10.7% (38/356)及6.7%(24/356);采用DNA 直接测序法时分别为46.3%(165/356)、33.4% (119/356)、2.0% (7/356)、0.8% (3/356)、11.0% (39/356)及6.5% (23/356)。两种方法检测CYP2C19 基因型具有一致性(P=0.392),且一致性较好(K =0.987);两种方法基因型检测结果一致率为99.2%。人群中弱代谢型包括CYP2C19* 2/* 2 型、CYP2C19* 2/* 3 型及CYP2C19* 3/* 3 型,此3 种基因型约占13.5% ~13.8%。CYP2C19* 1、* 2 及* 3 等位基因频率分别为66.6%、28.2%及5.2%(荧光PCR 法),分别为66.3%、28.7%及5.0%(DNA 测序法)。
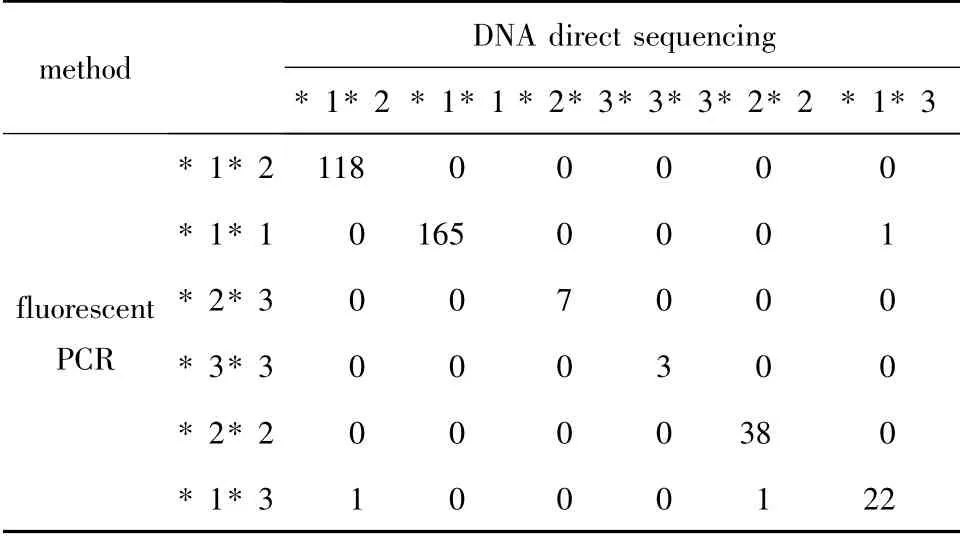
表2 二种方法检测CYP2C19 基因型结果Table 2 The results of CYP2C19 genotypes by two methods


3 讨论
迄今已知34 个CYP2C19 等位基因(http://www.cypalleles.ki.se/cyp2c19.htm)获得确定。本研究使用等位基因特异荧光PCR 法和DNA 直接测序法对CYP2C19 基因636 及681 位点核苷酸的多态性进行检测,即检测了CYP2C19* 1、* 2 及* 3三种等位基因。结果显示人群中弱代谢型包括CYP2C19* 2/* 2 型、CYP2C19 * 2/* 3 型及CYP2C19* 3/* 3 型,约占13.5% ~13.8%。由于CYP2C19 基因多态性和民族及地域相关,此前国内一项研究表明汉族和白族的CYP2C19 弱代谢型分别占19.8%及13.4%[1]。本研究未对民族信息进行相关分析,或许是结果同此前研究有差异的原因。另有研究表明高加索人中CYP2C19 弱代谢型仅占3% ~5%,而亚洲人中CYP2C19 弱代谢型占13% ~23%[4]。弱代谢型肝药酶CYP2C19 的活性丧失,从而影响一系列由其代谢的药物的药效。由于亚洲人群中CYP2C19 弱代谢型占比较高,为保障临床相关药物安全使用,如氯吡格雷、磺脲类药物等的个体化给药指导,临床实验室宜尽早开展CYP2C19 基因型的检测。
人CYP2C19 基因的多态性为先天遗传,后天的疾病不会改变该基因型,也与性别和年龄无关。临床检测仅需抽取2 mL左右外周血标本即可进行。CYP2C19 基因636 和681 位点核苷酸的多态性检测,属于定性检测。基因多态性检测的分子生物学方法包括PCR-RFLP(限制性片段长度多态性分析)[1,3,5-7]、DNA 直接测序[8]、单链构象多态性分析[9]、等位基因特异PCR[10]以及基因芯片技术等[11]。但这些方法费时费力,难以用于临床常规检测。荧光PCR 法检测具有高灵敏性、高特异性、操作简便、结果判断简单等特点,便于临床常规检测使用[12]。本研究应用等位基因特异荧光PCR 技术检测CYP2C19 基因636 和681 位点核苷酸的多态性,与DNA 直接测序法测得结果相比,两者基因型总符合率为99.2%,有较高的一致性,仅少数样本存在差异。分析不一致的原因可能是由于荧光PCR 法的灵敏度极高,特异引物扩增结果不完全特异从而导致误判结果;或是操作过程出现失误,此情况可通过重新检测纠正错误。
总之,本研究显示国内北京地区人群CYP2C19弱代谢型约占13.5% ~13.8%,临床实验室应开展CYP2C19 基因型检测以保障用药安全;等位基因特异荧光PCR 技术检测CYP2C19 基因型简便可靠。
[1]Xiao ZS,Goldstein JA,Xie HG,et al.Differences in the incidence of the CYP2C19 polymorphism affecting the Smephenytoin phenotype in Chinese Han and Bai populations and identification of a new rare CYP2C19 mutant allele[J].J Pharmacol Exp Ther,1997,281:604-609.
[2]De Morais SM,Wilkinson GR,Blaisdell J,et al.Identification of a new genetic defect responsible for the polymorphism of (S)-mephenytoin metabolism in Japanese[J].Mol Pharmacol,1994,46:594-598.
[3]de Morais SM,Wilkinson GR,Blaisdell J,et al.The major genetic defect responsible for the polymorphism of S-mephenytoin metabolism in humans[J].J Biol Chem,1994,269:15419-15422.
[4]Goldstein JA,de Morais SM.Biochemistry and molecular biology of the human CYP2C subfamily[J].Pharmacogenetics,1994,4:285-299.
[5]Zuo J,Xia D,Jia L,et al.Genetic polymorphisms of drugmetabolizing phase I enzymes CYP3A4, CYP2C9,CYP2C19 and CYP2D6 in Han,Uighur,Hui and Mongolian Chinese populations[J].Pharmazie,2012,67:639-644.
[6]Yin SJ,Ni YB,Wang SM,et al.Differences in genotype and allele frequency distributions of polymorphic drug metabolizing enzymes CYP2C19 and CYP2D6 in mainland Chinese Mongolian,Hui and Han populations[J].J Clin Pharm Ther,2012,37:364-369.
[7]Zuo LJ,Guo T,Xia DY,et al.Allele and genotype frequencies of CYP3A4,CYP2C19,and CYP2D6 in Han,Uighur,Hui,and Mongolian Chinese populations[J].Genet Test Mol Biomarkers,2012,16:102-108.
[8]Kidd RS,Curry TB,Gallagher S,et al.Identification of a null allele of CYP2C9 in an African-American exhibiting toxicity to phenytoin[J].Pharmacogenetics,2001,11:803-808.
[9]Itoh K,Inoue K,Nakao H,et al.Polymerase chain reaction-single-strand conformation polymorphism based determination of two major genetic defects responsible for a phenotypic polymorphism of cytochrome P450 (CYP)2C19 in the Japanese population[J].Anal Biochem,2000,284:160-162.
[10]Kim M,Kong E.Genetic polymorphisms of cytochrome P450 2C19 in functional dyspeptic patients treated with cimetidine[J].Korean J Physiol Pharmacol,2012,16:339-342.
[11]Park DK,Park HJ,Lee CY,et al.Nanogap-based electrical PNA chips for the detection of genetic polymorphism of cytochrome P450 2C19[J].J Nanosci Nanotechnol,2012,12:5155-5159.
[12]Borlak J,Thum T.Identification of major CYP2C9 and CYP2C19 polymorphisms by fluorescence resonance energy transfer analysis[J].Clin Chem,2002,48:1592-1594.

