3种护坡灌木对干旱胁迫的生理响应
姜雪昊,穆立蔷,王晓春,徐文远
(1.东北林业大学生态研究中心,黑龙江 哈尔滨 150040; 2.东北林业大学林学院,黑龙江 哈尔滨 150040; 3.东北林业大学土木工程学院,黑龙江 哈尔滨 150040)
高速公路边坡长度长、面积大、生态环境十分脆弱,且水土流失在公路建成初期经常发生,所以,选择合理的边坡植物极为重要[1]。边坡植物可以防止水土流失、稳定路基、绿化美化公路边坡,使边坡成为独特的绿色长廊和风景线。美国等发达国家从20世纪30-40年代就意识到了道路建设中生态平衡的重要性,开始在道路边坡开展植被恢复工作[2]。国外对于高速公路边坡植被恢复的研究时间较长,且研究内容全面、成熟,但在植被恢复的生态限制因子等方面报道较少[3]。我国高速公路建设在20世纪90年代后才迅速发展,胥晓刚[4]通过比较13种植物在四川高速公路中的生长适应性发现,狗牙根(Cynodondactylon)、百喜草(Pasplummotatum)、草木樨(Melilotussuavena)、弯叶画眉草(Eragrostiscurvula)具有较强的耐贫瘠、耐旱能力。宁夏古王高速公路边坡生物防护中沙打旺(Astragalusadsurgens)、紫花苜蓿(Medicagosativa)也具有较强的抗逆性[5]。随着人们对植被恢复认识的提高,灌木类、藤本攀缓类、野生草本类等植物在公路边坡防护中不断被应用[6]。
齐泰高速公路(齐齐哈尔至泰来段)位于松嫩平原中西部地区,该地区属于干旱半干旱地区,是松嫩沙地分布的区域,该地区生态系统稳定性较差。本研究以乡土植物为主,优选出紫穗槐(Amorphafruticosa)、柽柳(Tamarixchinensis)和小叶锦鸡儿(Caraganamicrophylla)3种灌木,从耐旱角度出发进行研究,筛选适合种植在黑龙江西部地区公路边坡的护坡植物。由于高速公路边坡土壤水分在自然条件下难以控制,且土壤未经人工淋溶,含有大量NaHCO3,高速公路通车后植物容易受到汽车尾气的影响,在高速公路边坡进行试验不能说明在单一干旱胁迫下植物的生理响应,因此本研究将公路边坡土壤运回东北林业大学林学院干旱棚内进行3种灌木的干旱胁迫试验,并同时于齐泰高速公路K 28+300-K 28+800路段边坡种植3种灌木。植物在干旱边坡能够正常生长是防止公路边坡水土流失、公路两侧路面塌陷的重要因素,通过研究公路段和干旱胁迫下灌木的生理响应,分析3种灌木在干旱公路边坡的适应情况,以期为干旱地区公路护坡植物的选择及种植提供理论依据。
1 材料与方法
1.1试验材料 试验在东北林业大学园林学院苗圃干旱棚内和齐泰高速公路实验公路段边坡(K 28+300-K 28+600)同步进行。试验公路段位于齐齐哈尔市昂昂溪区,当地年降水量415.3 mm,年平均气温3.9 ℃,年平均风速3.3 m·s-1,年蒸发量1 514.8 mm,气温年较差41.8 ℃,年日照百分比64%,年日照时数2 600~2 900 h,生长期(5-9月)日照时数1 300~1 350 h,气候属于干旱半干旱气候[7]。试验所用紫穗槐、柽柳、小叶锦鸡儿分别为同一母系2年龄实生苗,灌木由黑龙江省泰康县苗圃提供。于2010年4月25日分别定植于试验公路段边坡(株距1 m,行距0.87 m,品字形种植)和干旱棚花盆内。花盆上口径30 cm,下口径24 cm,高25 cm,每盆种植1株,栽培基质为齐泰高速公路路基土(土壤为经过淋溶处理的公路边坡土)。
1.2试验方法 灌木用Hoagland完全营养液浇灌并在温室中培养,待8月份充分展叶后选择长势一致的灌木进行模拟试验。结合公路实际干旱情况并参考孙存华等[8]对植物进行干旱胁迫的处理方法,通过人工控制水分模拟公路干旱来研究3种灌木对干旱胁迫的生理响应。每种灌木选择15盆进行干旱胁迫处理,共设置5个胁迫梯度(表1),每个处理3盆。从2010年8月23日开始,每隔5 d进行1次饱和浇水处理,胁迫共进行21 d(表1)。干旱胁迫结束后,在土壤表层以下10~15 cm取土测定土壤含水量,对照、轻度、中度、重度及极重度胁迫5组处理的土壤含水量分别为17.26%、13.98%、10.7%、7.41%和4.13%。通过马喜文等[9]对松嫩平原泰来、甘南县土壤含水量的测定得知,齐泰高速公路路段土壤实际含水量是17%~10%,与本研究受胁迫土壤含水量基本一致。本试验最低土壤含水量为4.13%,低于上述文献中最低土壤含水量。
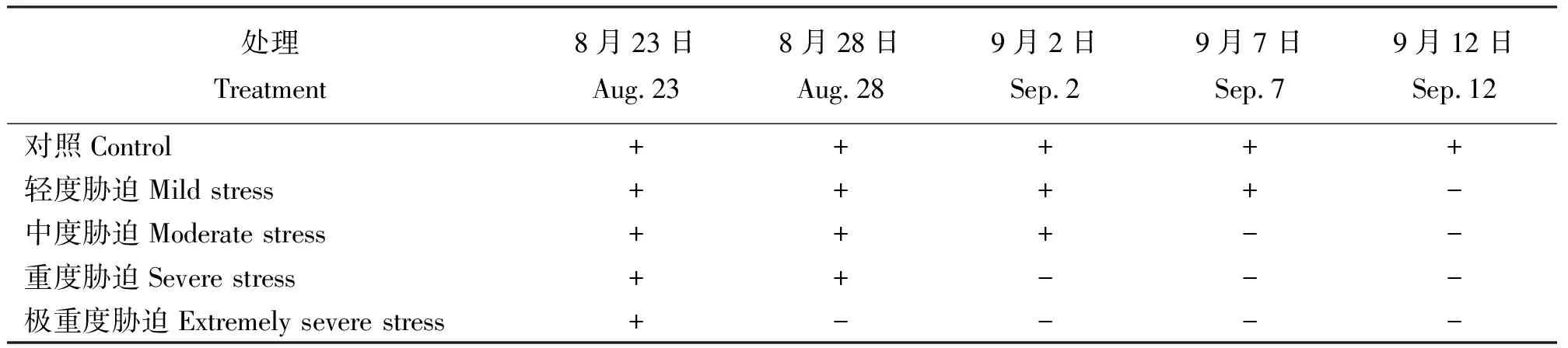
表1 干旱胁迫梯度设计Table 1 Drougt stress gradient design
1.3生理指标的测定 9月13日08:00-09:00分别于干旱棚及试验公路段摘取叶位相同的3种植物叶片数枚,将每个胁迫梯度同种植物叶片混合后测定各项生理指标,每处理3次重复。叶片质膜透性(RPP)的测定采用相对电导率法,叶绿素(Chl)含量测定采用丙酮乙醇混合提取后比色法,丙二醛(MDA)含量及可溶性糖(SS)含量测定采用双组分光光度计法,脯氨酸(Pro)的测定采用磺基水杨酸法,超氧化物歧化酶(SOD)活性测定采用氮蓝四唑(NBT)法[10]。
为了利用各项指标对植物的耐旱性进行综合评价,采用模糊数学隶属函数法对各指标测定进行定量转换。如果指标与耐旱性呈正相关:
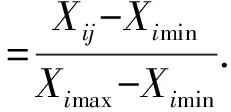
如果指标与耐旱性呈负相关:

式中,Zij为i品种j指标的耐旱性隶属函数值,Xij为i品种j指标的测定值,Ximax和Ximin为各品种中指标的最大和最小测定值。将植物各指标的隶属函数值累加起来,求其平均值,隶属函数值越大,该品种的耐旱性就越强。
1.4数据分析 通过R软件(R 17.0)进行数据处理及分析,采用R软件进行邓肯氏新复极差法进行显著性检验。
2 结果与分析
2.1干旱胁迫对3种灌木叶片质膜透性的影响 紫穗槐RPP随着胁迫加强,整体变化趋势为先降低后升高,变化不大;中度胁迫组RPP最低;轻度胁迫组至重度胁迫组,RPP变化不大;极重度胁迫组RPP与对照组相比明显升高,与其它各处理间差异显著(P<0.05)。柽柳RPP随胁迫加强,呈现升高趋势;极重度胁迫组RPP最大;对照组RPP最小;重度胁迫组、极重度胁迫组叶片RPP均与对照组差异极显著(P<0.01)。小叶锦鸡儿RPP变化在对照组、轻度胁迫组、中度胁迫组间变化不明显;当到达重度胁迫和极重度胁迫时,RPP升高,与对照及轻中度胁迫之间差异极显著(P<0.01)(表2)。
在同一胁迫强度下,3种灌木叶片RPP大小为紫穗槐>柽柳>小叶锦鸡儿。试验公路段3种灌木生理指标均在轻度至重度胁迫范围内。
2.2干旱胁迫对3种灌木Chl总量的影响 在轻度胁迫下紫穗槐Chl总量极显著高于对照(P<0.01),随胁迫增强,Chl总量急剧降低,在中度、重度及极重度胁迫下,Chl总量极显著低于对照(P<0.01)。柽柳叶片Chl总量在3种灌木中最低,每个胁迫梯度下Chl总量均与对照组差异极显著(P<0.01),除轻度胁迫下高于对照外,其它胁迫处理下均低于对照。小叶锦鸡儿Chl总量在轻度胁迫下极显著高于对照(P<0.01),中度和重度胁迫下Chl总量相比对照略有降低,但差异不显著(P>0.01),极重度胁迫组的Chl总量减少,极显著低于对照(P<0.01)(表3)。
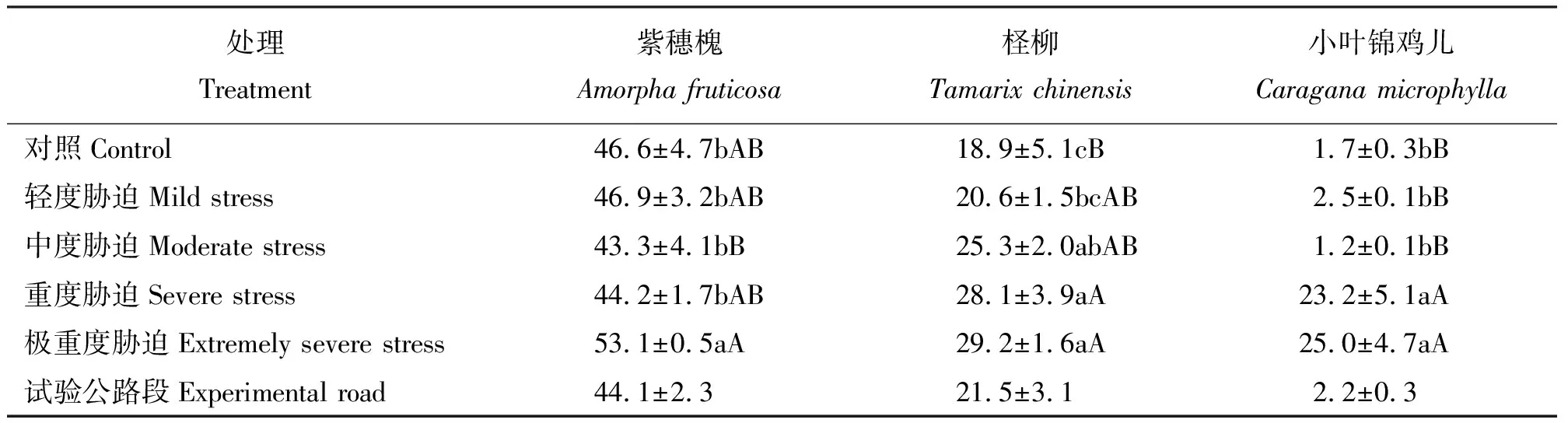
表2 干旱胁迫下灌木叶片质膜透性Table 2 Leaf membrane permeability of three shrubs under drought stress %
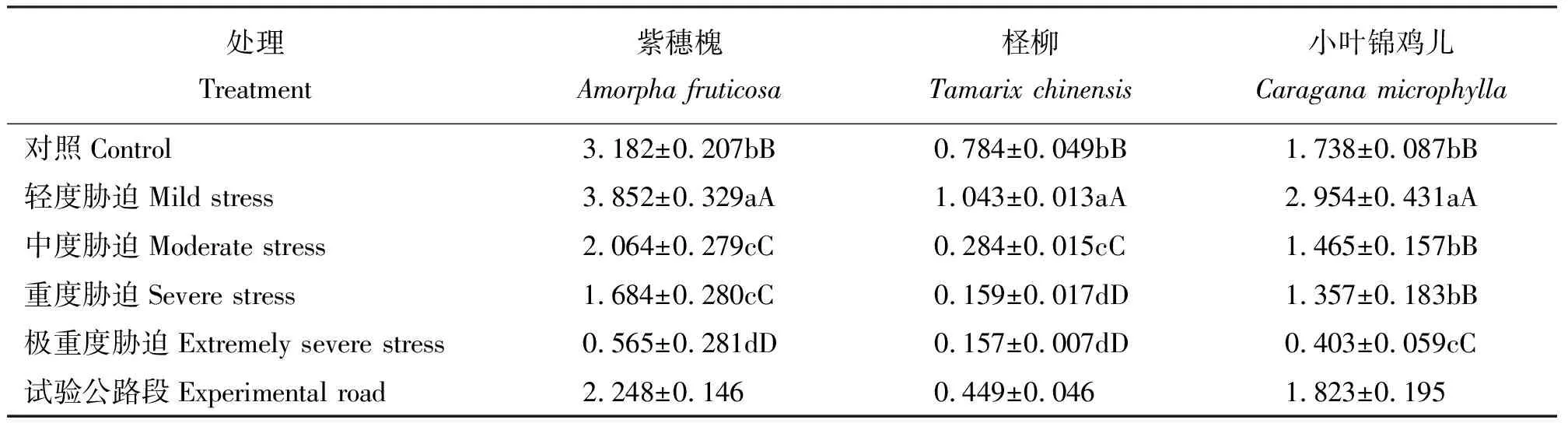
表3 干旱胁迫下灌木叶片Chl总量Table 3 Leaf total chlorophyll of three shrubs under drought stress mg·g-1
3种灌木Chl总量在轻度胁迫组至极重度胁迫组间均呈现下降趋势,中度胁迫组与重度胁迫组Chl含量下降趋势减缓。极重度胁迫组,3种灌木Chl总量均达到最小值。整体上Chl总量依次为紫穗槐>小叶锦鸡儿>柽柳。试验公路段3种灌木生理指标均在轻度至中度胁迫范围内。
2.3干旱胁迫对3种灌木叶片SOD活性的影响 紫穗槐叶片SOD活性随着干旱胁迫程度的加剧表现出两次先升高后降低的过程,对照组SOD活性显著低于其它处理组(P<0.05),轻度胁迫组紫穗槐SOD活性最高,与对照组相比差异极显著(P<0.01)。柽柳叶片SOD活性随着胁迫程度的加重呈现降低-升高-降低的趋势,对照组柽柳叶片SOD活性最小,中度胁迫组柽柳叶片SOD活性达到最大值,与其它处理相比差异极显著(P<0.01)。小叶锦鸡儿叶片SOD活性随着胁迫程度的加重呈现先上升后下降的趋势,对照组叶片SOD活性为所有处理中最低,轻度胁迫组叶片SOD活性相比对照组升高,差异极显著(P<0.01)。轻度胁迫组至中度胁迫组叶片SOD活性略有上升,重度胁迫组叶片SOD活性显著高于其它处理(P<0.01) (表4)。
随着干旱胁迫的加剧,紫穗槐和小叶锦鸡儿SOD活性都经历了先升高再降低的过程。柽柳SOD活性先稍有降低,然后也呈先升高再降低的趋势。紫穗槐、柽柳、小叶锦鸡儿叶片SOD活性分别于轻度胁迫组、中度胁迫组、重度胁迫组达到最大值,试验公路段3种灌木生理指标均在轻度至重度胁迫范围内。
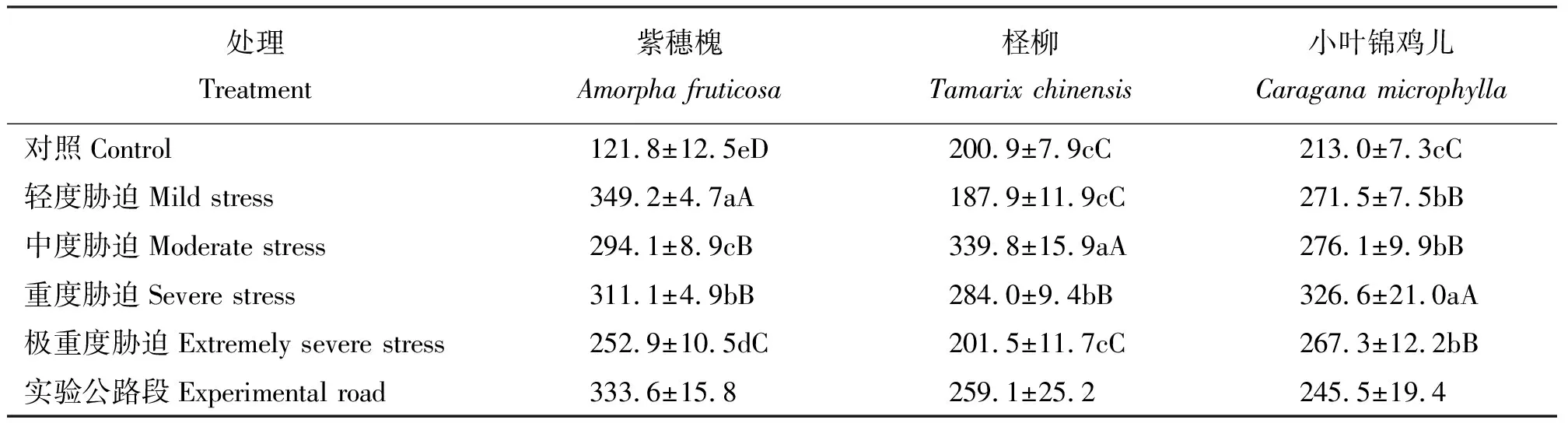
表4 干旱胁迫下灌木叶片SOD活性Table 4 Leaf SOD activity of three shrubs under drought stress U·g-1·h-1FW
2.4旱胁迫对3种灌木叶片MDA含量的影响 紫穗槐叶片MDA含量随着干旱胁迫的加剧呈现出先升高后降低的趋势,对照组的MDA含量最低,与其它处理差异显著(P<0.05),中度胁迫组叶片MDA含量最高,显著高于对照组(P<0.01)。柽柳叶片MDA含量随着干旱胁迫加剧呈现持续上升的趋势,对照组MDA含量最低,极重度胁迫组MDA含量最高且显著高于其它处理(P<0.01)。小叶锦鸡儿叶片MDA含量随着胁迫程度的加重呈现先上升后下降的趋势,对照组MDA含量最低与其它处理之间差异显著(P<0.05),重度胁迫组MDA含量最高显著高于其它处理组(P<0.01)(表5)。
紫穗槐与小叶锦鸡儿MDA含量变化皆为先升高后降低,不同的是紫穗槐叶片MDA含量在中度胁迫时最高,为对照的3.00倍,而小叶锦鸡儿在重度胁迫时最高,为对照的2.16倍。柽柳叶片MDA含量随着干旱胁迫的加剧逐渐增多,极重度胁迫MDA含量为对照的6.64倍。试验公路段3种灌木生理指标均在轻度至中度胁迫范围内。
2.5干旱胁迫对3种灌木叶片可溶性糖含量的影响 紫穗槐叶片SS含量随胁迫的加剧呈先升高后降低趋势,中度胁迫组达到最大值,极显著高于其它处理(P<0.01),对照与极重度胁迫差异不显著(P>0.05)。柽柳叶片SS含量随着干旱胁迫的加剧呈上升趋势,对照组含量最低,极重度胁迫组含量最高,除了轻度干旱组与中度干旱组差异不显著外(P>0.05),柽柳其它处理间差异极显著(P<0.01)。小叶锦鸡儿叶片SS含量在对照组到重度胁迫组呈上升趋势,重度胁迫组SS含量最高,重度胁迫组到极重度胁迫组叶片SS含量大幅下降。中度胁迫组、重度胁迫组与对照组、轻度胁迫组及极重度胁迫组间差异均极显著(P<0.01)(表6)。
3种灌木叶片可SS含量随着干旱胁迫的加剧变化如下:紫穗槐及小叶锦鸡儿SS含量呈现先上升后下降的趋势,中度胁迫组紫穗槐SS含量最高,为对照的2.81倍,重度胁迫组小叶锦鸡儿SS含量最高,为对照的3.38倍;柽柳的SS含量随胁迫的加剧一直升高,极重度胁迫组含量最高,为对照的3.48倍。试验公路段3种灌木生理指标均在轻度至中度胁迫范围内。

表5 干旱胁迫下灌木叶片MDA含量 Table 5 Leaf MDA content of three shrubs under drought stress μmol·g-1
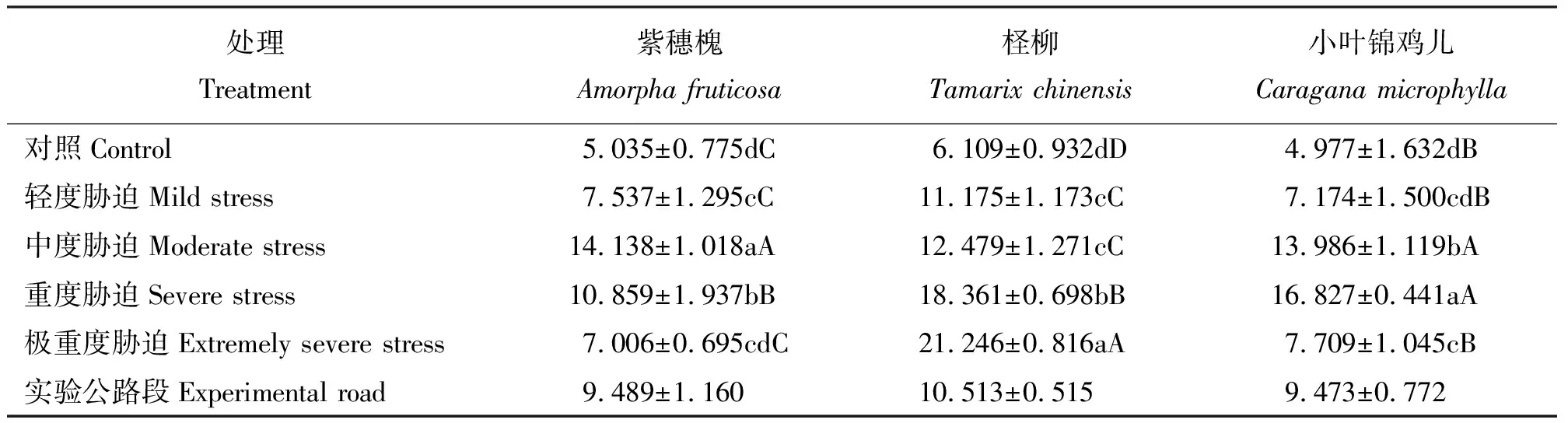
表6 干旱胁迫下灌木叶片可溶性糖含量 Table 6 Leaf soluble sugar content of three shrubs under drought stress mmol·g-1
2.6干旱胁迫对3种灌木叶片Pro含量的影响 3种灌木Pro含量随着干旱胁迫加剧不断增加,均表现为对照组Pro含量最低,极重度胁迫组最高,且二者差异均极显著(P<0.01),紫穗槐、柽柳及小叶锦鸡儿在极重度胁迫组Pro含量分别是对照组的8.13、75.85和15.68倍。试验公路段3种灌木生理指标均在轻度至重度胁迫范围内(表7)。
2.7隶属度函数分析 通过对3种灌木干旱胁迫下生理指标隶属度函数分析可知,紫穗槐的隶属函数度最大,为0.489 23,小叶锦鸡儿次之,为0.487 57,柽柳最小,为0.472 38。3种灌木耐干旱的强弱顺序为紫穗槐>小叶锦鸡儿>柽柳(表8)。
为进一步探讨不同干旱胁迫程度下3种灌木适应性高低,对不同胁迫程度单独对植物生理指标进行隶属度函数分析。由表9可以得出,轻度胁迫下,紫穗槐隶属度函数值最高;中度胁迫下,柽柳隶属度函数值最高;重度胁迫下,小叶锦鸡儿隶属度函数值最高;极重度胁迫下,紫穗槐隶属度函数值最高。可见,紫穗槐适宜种植在轻度干旱和极重度干旱公路边坡,柽柳适宜种植在中度干旱公路边坡,小叶锦鸡儿适宜种植在重度干旱公路边坡。
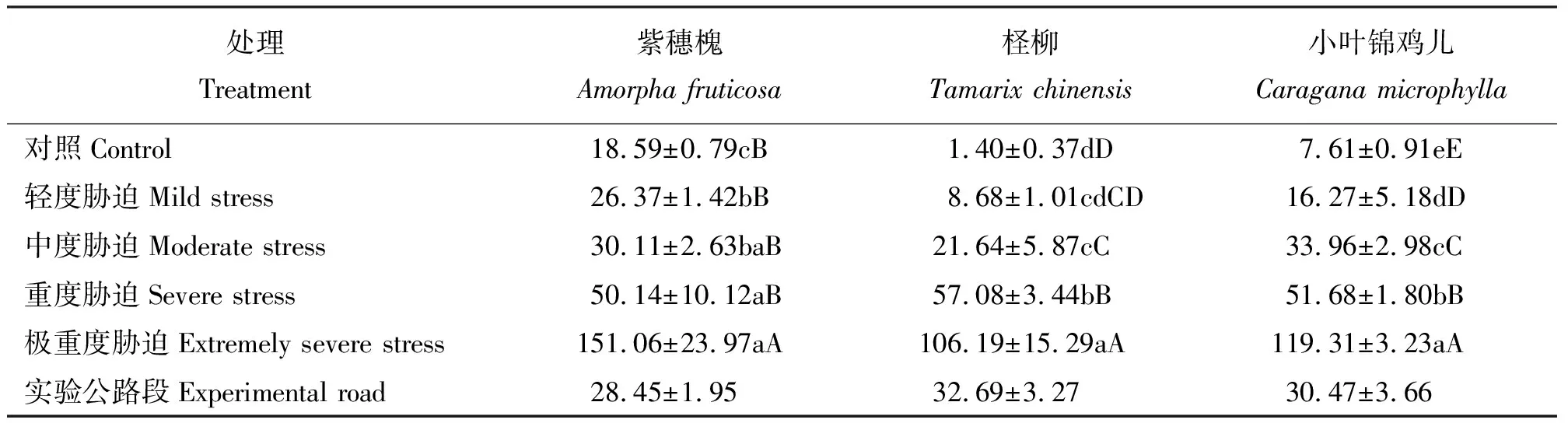
表7 干旱胁迫下灌木叶片脯氨酸含量Table 7 Leaf proline content of three shrubs under drought stress μg·g-1
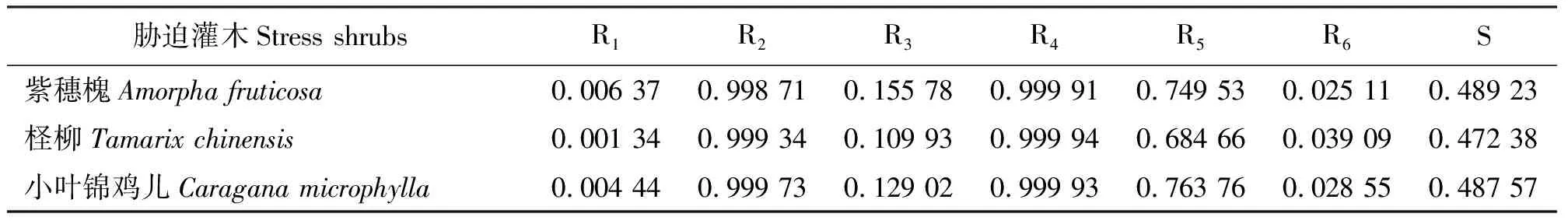
表8 3种灌木生理指标隶属函数Table 8 Subordinate function analysis of seedlings physiological index
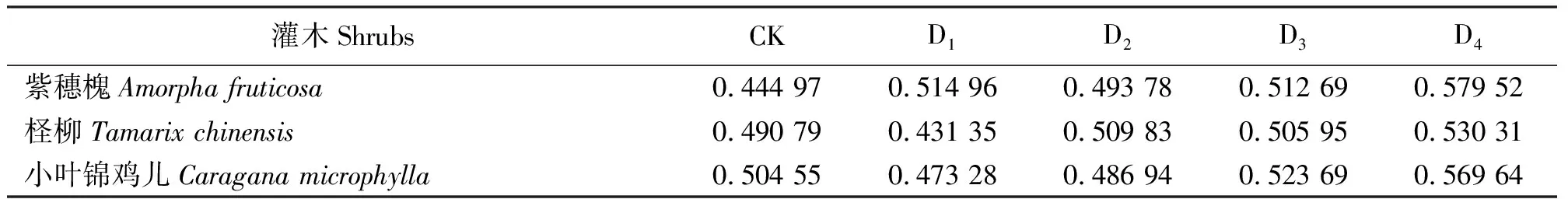
表9 3种灌木不同胁迫程度下生理指标隶属函数Table 9 Subordinative function analysis of seedlings physiological index under stress
3 讨论
3.1干旱胁迫对灌木叶片膜透性的影响 在不适宜植物生长的条件下,植物细胞原生质膜发生膜质过氧化,最终产物为MDA,是植物在非生物胁迫下产生自由基和发生膜损伤的指示器[11]。MDA从膜上释放后,可以与蛋白质、核酸反应,改变这些大分子的构型,或与之产生交联反应,使之丧失功能,还可使纤维素分子间的桥键松驰,或抑制蛋白质的合成。MDA的积累可能对膜和细胞造成一定的伤害,所以其含量的变化可以反映细胞膜受损程度[12]。本研究中,MDA含量测定采用双组分光光度计法,避免可溶性糖对测定的干扰[13]。紫穗槐和小叶锦鸡儿叶片MDA含量都呈现出先升后降的趋势且分别在中度胁迫组和重度胁迫组达到最大值。MDA含量升高由干旱胁迫引起,而下降过程可能由于这两种灌木在度过干旱阈值期后表现出一定耐受性和适应性,这与桂世昌等[14]研究的水分胁迫下扁穗牛鞭草(Hemarthriacompressa)根系MDA含量变化的趋势相一致。而柽柳MDA含量则呈现一直升高的趋势,且到达极重度胁迫时MDA含量高于紫穗槐和小叶锦鸡儿。这可能是因为紫穗槐及小叶锦鸡儿同属豆科植物而柽柳为柽柳科植物,不同科属的植物在各种形态及理化性质上差距较大,从而造成生理指标差异较大。
细胞膜能控制调节细胞内外物质的运输与交换,相对电导率是评定植物对逆境反应的指标之一[15]。膜质过氧化导致膜损坏,使相对电导率增大。细胞膜透性的大小可间接用组织的相对电导率衡量,组织相对电导率越高,说明细胞膜完整性遭到破坏的程度就越大。随着干旱胁迫程度的加重,3种灌木叶片相对电导率均有不同程度的上升,极重度胁迫组与对照组相比,紫穗槐、柽柳和小叶锦鸡儿相对电导率分别增加了13.95%、54.50%和1 370.59%,这与王霞等[16]研究的水分胁迫下柽柳膜透性变化规律一致。可见,干旱胁迫下紫穗槐和柽柳相对电导率受到的影响小于小叶锦鸡儿。
3.2干旱胁迫对灌木叶片光合作用的影响 Chl含量是反映植物光合强度的重要指标,在任何不良因子胁迫下,植物均表现出光合作用强度降低,同化产物供应减少的现象。干旱胁迫条件下植物体Chl含量的变化,指示植物对水分胁迫的敏感性,并直接影响光合产量[17]。3种灌木Chl总量变化随着干旱胁迫的加剧,均表现出先上升后下降的趋势,这与邹春静等[18]研究沙地云杉(Picesmongolica)在水分胁迫下Chl总量变化趋势一致。轻度胁迫组,3种灌木叶片Chl总量相比对照均有一定增加,发生这种情况可能是因为3种灌木较为适应轻度干旱的土壤条件,从而Chl总量在轻度胁迫时有所升高。轻度干旱至极重度干旱造成Chl总量降低的原因是由气孔及非气孔因素两方面的原因所致,胁迫初期的干旱胁迫引起植物叶片气孔关闭,阻碍CO2进入叶内,胁迫后期由于非气孔因素,即蛋白质分解大于合成,叶绿体分解加强,Chl总量下降,从而导致光合作用强度降低[19]。中度胁迫至重度胁迫,紫穗槐和小叶锦鸡儿Chl总量下降减缓,柽柳在重度至极重度胁迫下Chl总量下降减缓,说明3种灌木能通过调节蛋白质分解合成来增强在干旱环境中的生存能力。
3.3干旱胁迫对灌木叶片抗氧化防御系统的影响 SOD是植物氧代谢中一种极为重要的酶,在整个氧化防御系统中,SOD起着重要作用。干旱胁迫下植物体内SOD等酶的活性与植物抗氧化胁迫能力呈正相关[20]。SOD将O-2歧化为H2O2和O2,影响植物体H2O2和O2的浓度,从而可能在保护系统中处于核心地位[21]。紫穗槐和小叶锦鸡儿随着干旱胁迫加剧,SOD活性呈现先升高后降低的趋势,柽柳SOD活性小幅度降低后也呈现先升高后降低的趋势。这与前人研究结果基本一致[22-23]。随胁迫加剧,3种灌木叶片SOD活性为升高趋势,在干旱胁迫下3种灌木增加SOD活性,清除活性氧,抵御膜脂过氧化对植物造成的伤害。重度胁迫至极重度胁迫,3种灌木叶片SOD活性均大幅下降,表明植物体内SOD维持膜系统的稳定性能力是有限的,随着干旱胁迫的不断加剧,这种能力会逐渐丧失。
3.4干旱胁迫对灌木叶片渗透调节的影响 干旱胁迫下,植物不断地积累Pro以及SS,使细胞维持一定的膨压[24],Pro是氨基酸中最为有效的渗透调节物质[25],SS是生物体内重要成分,是生物体中的重要能源和碳源,它可以降低水势,提高植物吸水和保水能力[26]。有研究认为,Pro及SS可以作为渗压剂进行渗透调节,从而增强植物保持水分的能力,稳定体内的渗压平衡,还有研究认为,积累的Pro和SS可能作为一种溶剂代替水参与生化反应[27]。3种灌木Pro含量随着干旱胁迫的加剧呈上升趋势,均在极重度胁迫下达到最大值。这一变化趋势与相对电导率变化趋势呈正相关,这与赵纪东等[28]的结果一致。随着干旱胁迫的加重,紫穗槐和小叶锦鸡儿叶片SS含量先升高后降低,这可能是由于干旱胁迫加剧,水分的进一步缺乏,叶片气孔关闭,叶绿体类囊体结构受破坏,光合速率显著下降,光合产物合成受阻,因此,深度干旱胁迫时叶片内SS的积累有可能趋于减慢和停止[29],柽柳SS一直上升。植物体内Pro和SS的增加保持了细胞与环境渗透平衡,防止了植物体水分散失,还有可能直接影响体内蛋白质的稳定性。
4 结论
紫穗槐、柽柳和小叶锦鸡儿在5个干旱胁迫梯度下,通过对Chl、RPP、Pro、MDA、SOD以及SS 6项生理指标测定得出3种灌木能通过自身的反馈调节机制抵御干旱胁迫带来的伤害。3种灌木在实验公路段边坡的生理指标基本处在干旱试验对照到中度胁迫之间,说明3种灌木在齐泰高速公路能适应更加干旱的土壤环境。通过对生理指标的隶属函数分析得出,3种灌木对干旱胁迫适应性由高至低依次为:紫穗槐>小叶锦鸡儿>柽柳。紫穗槐适宜种植在轻度干旱和极重度干旱边坡,柽柳适宜种植在中度干旱边坡,小叶锦鸡儿适宜种植在重度干旱边坡。
试验公路段3种灌木立地条件比干旱棚内差(种苗至采样仅下过两场小雨,仅在种苗后浇过一次透水),但是各项生理指标很少达到重度胁迫水平,且均未达到极重度胁迫水平,说明3种灌木适应公路试验段的立地条件,可以作为齐泰高速公路护坡植物。在干旱胁迫试验过程中发生了灌木根系在花盆中盘旋生长,甚至有根系通过渗水孔生长出花盆外的现象,在一定程度上对试验造成影响,在以后的试验中应采用大型种植槽对灌木进行种植,以防止花盆影响根系自然生长。
[1] 王云,龙春林,刘怡涛,等.植物在高速公路边坡防护中的应用[J].水土保持研究,2005,12(6):199-202.
[2] 孙书存,包维楷.恢复生态学[M].北京:化学工业出版社,2005.
[3] 刘春霞,韩烈保.高速公路边坡植被恢复研究进展[J].生态学报,2007,27(5):2090-2098.
[4] 胥晓刚.高速公路陆域生态恢复研究[D].成都:四川农业大学,2004.
[5] 张淑娥,王思成,兰剑,等.宁夏古王高速公路边坡生物防护植物选择研究Ⅱ草本植物抗性研究[J].宁夏农学院学报,2004,25(2):29-32.
[6] 陈迎辉,朱开明,罗怀斌.攀援植物在潭邵高速公路石方边坡绿化中的应用技术[J].湖南林业科技,2004,31(2):33-35.
[7] 中国气象局,国家气象信息中心.中国地面国际交换站气候标准值年值数据集(1961-2000) [EB/OL].[2012-01-01] (2000-01-01) http://cdc.cma.gov.cn.
[8] 孙存华,李扬,贺鸿雁,等.藜对干旱胁迫的生理生化反应[J].生态学报,2005,10(25):2556-2561.
[9] 马喜文,陈棣,荣建东.松嫩平原西部旱作农业区旱情分析[J].黑龙江水专学报,2004(3):48-49.
[10] 中国科学院上海植物研究所.现代植物生理学实验指南[M].北京:科学出版社,2004.
[11] Alexieva V,Sergiev I,Mapelli S,etal.The effect of drought and ultraviolet radiation on growth and stress markers in pea and wheat[J].Plant, Cell and Environment,2001,24:1337-1344.
[12] 姜英淑,陈书明,王秋玉,等.干旱胁迫对2个欧李种源生理特征的影响[J].林业科学,2009,45(6):6-10.
[13] 赵世杰,许长城,邹琦,等.植物组织中丙二醛测定方法的改进[J].植物生理学通讯,1994,30(3):207-210.
[14] 桂世昌,杨峰,张宝艺,等.水分胁迫下扁穗牛鞭草根系保护酶活性变化[J].草业学报,2010,19(5):278-282.
[15] 王友保,刘登义.Cu、As及其复合污染对小麦生理生态指标的影响[J].应用生态学报,2001,12(5):773-776.
[16] 王霞,侯平,尹林克,等.水分胁迫对柽柳组织含水量和膜透性的影响[J].干旱区研究,1999,16(2):12-15.
[17] Reuveni J,Gale J,Zeroni M.Differentiating day from night effects of high ambient [CO2] on the gas exchange and growth ofXanthiumstrumariumL exposed to salinity stress[J].Annals of Botany,1997,79:191-196.
[18] 邹春静,韩士杰,徐文铎,等.沙地云杉生态型对干旱胁迫的生理生态响应[J].应用生态学报,2003,14(9):1446-1450.
[19] 夏阳.水分逆境对果树脯氨酸和叶绿素含量变化的影响[J].甘肃农业大学学报,1993,28(1):26-31.
[20] 陈善福,舒庆尧.植物耐干旱胁迫的生物学机理及其基因工程研究进展[J].植物学通报,1999,16(5):555-560.
[21] 阎成士,李德全,张建华.植物叶片衰老与氧化胁迫[J].植物学通报,1999,16(4):398-404.
[22] Jimenez C,Pick U.Differential reactivity of [beta]-carotene isomers fromDunaliellabardawiltoward oxygen radicals[J].Plant Physiology,1993,101:385-390.
[23] 蒋明义,杨文英,徐江,等.渗透胁迫诱导水稻幼苗的氧化伤害[J].作物学报,1994b,20(4):733-738.
[24] McCue K F.Hanson A D.Drought and salt tolerance:Towards understanding and application [J].Trends in Biotechnology,1990,8:358-362.
[25] 李德全,邹琦,程炳嵩.植物渗透调节研究进展[J].山东农业大学学报,1991,22(1):87-90.
[26] Dure L.Plant responses to cellular dehydration during environment stress[J].Plant Physiology,1993,103(10):91-93.
[27] Bohnert H J,Jensen R G.Strategies for engineering water-stress tolerance in plants[J].Trends in Biotechnology.1996,14:89-97.
[28] 赵纪东,傅华,吴彩霞.水分胁迫对白刺幼苗生物量和渗透调节物质积累的影响[J].西北植物学报,2006,26(9):1788-1793.
[29] 潘瑞炽,王小菁,李娘辉.植物生理学[M].北京:高等教育出版社,2004:102-104.

