烟草青枯菌在杂草根部的定殖和传病作用
方树民,顾钢,陈玉森,黄春梅,陈顺辉
1福建农林大学植物保护学院,福州 350002;2福建省烟草农业科学研究所,福州 350003;3 福建农林大学生命科学院,福州 350002
青枯菌(Ralstonia solanacearumE.E.Smith)具有广泛的寄主范围,迄今已发现的寄主超过50多个科数百种植物,且不断有新的寄主被发现[1,2],但该病菌的侵染能力较复杂,多数植物不表现症状[3]。这些寄主在病菌存活的生命循环中所起的作用如何,在缺乏感病寄主的条件下青枯菌以何种形式在何种场所越冬,都是青枯病综合治理中必须要解决的问题。1965年Dukes等报道美国南佐治亚州新开垦的处女地首次栽培的几种经济作物发生青枯病,从中分离到的青枯菌并接种到几种本地杂草上可以引起枯萎症状,由此认为其侵染源可能来自带菌杂草[4]。此后洪都拉斯、澳大利亚、菲律宾和印度等相继从香蕉、番茄和马铃薯等田间杂草上分离到青枯菌[3,5-8]。林骏奇等从台湾非感病寄主田生长的9种杂草根部分离到青枯菌,经生理生化反应测定,确认为生物型Ⅲ[1],这些带菌的杂草中除个别显症外[4,7],绝大多数无症状表现,病菌潜伏在杂草根部或根际土壤中存活,甚至形成系统侵染[1,9],其作用是增加土壤菌量,加重寄主发病;当栽培作物解体时起了交替寄主的作用[6,10],延续青枯菌在土壤中的存活。在印尼,带菌杂草硬毛巴豆(Croton hirtusL’Hér)被认为是木薯细菌性枯萎病的初侵染源[6,10],此外青枯菌还能在多年生杂草上周年存活,从中释放出的病菌通过沟灌感染马铃薯[11]。但这些表象由于缺乏对杂草带菌情况作系统调查和分类评价,青枯菌能否在一年生杂草上越冬并起传病作用尚不明确。
为此,本研究采用菌株抗利福平标记法,对烟草青枯菌在不同种杂草根部寄生和腐生状况作系统调查,通过人工接种模拟试验弄清冬季烟草青枯菌在杂草根部的消长情况,监测是否为翌年烟草青枯病发生的初侵染源;以带菌杂草根埋入无病盆土中并移栽烟草监测杂草传播青枯病的能力。希冀建立一套以杂草根部定殖菌量与诱发烟草青枯病能力的评价体系,明确烟田的防除重点,为制定烟草青枯病综合防治措施提供重要的理论指导依据。
1 材料与方法
1.1 不同种杂草根部带菌测定
从2007年起设置烟草青枯病诱发圃,供试菌株t101鉴定为青枯菌小种Ⅰ生物型Ⅲ[12],经利福平抗药性标记后[13],用浓度为10μg·mL-1的利福平PSA液体培养基,置于180r·min-1摇床,28℃培养36h后,配成浓度为3×109cfu·mL-1的悬液备用。每年4月下旬将感病品种红花大金元烟苗浸入菌液15min后移栽田间并浇灌菌液。10d后出现“半边疯”青枯凋萎症状,取土样测出菌量≧106cfu·g-1,直至7月中旬多数烟株枯死;8月上旬重栽烟苗任其自然发病。
不同季节从病圃中挖取整株杂草,剪取根洗净后分别作带菌测定。依据测出的根带菌密度,评价不同杂草根感染青枯菌程度:感(S),根带菌量≧ 105cfu·g-1;中感(MS),104cfu·g-1≦根带菌量<105cfu·g-1;低感(LS),根带菌量< 104cfu·g-1。
试验所用的49种杂草来源:病圃里自然生长的杂草、异地采集杂草籽撤入病圃和烟区采集杂草移入病圃。每种杂草均参照《福建植物志》中描述的方法做种的鉴定[14]。
1.2 杂草不同部位带菌测定
供试马齿苋、鬼针草等11种杂草,参照任铁和林骏奇等的方法[1,15],对杂草的根表、根内、茎、叶及根际土壤作带菌测定。
1.3 不同种杂草根残体带菌测定
非病田采集牛筋草、龙葵等22种杂草,洗净根土后取每种杂草根3~5g,用线捆绑并埋入病土5~10㎝深,另一端挂标签并露出土表,当气温≧20℃时隔7d取样,洗净根土后作带菌测定。根据测出的烂根带菌密度,评价青枯菌在不同杂草根残体上的腐生程度:高度腐生(H),烂根带菌量≧ 106cfu·g-1;中度腐生(M),104cfu·g-1≦烂根带菌量<106cfu·g-1;低度腐生(L),烂根带菌量<104cfu·g-1。
1.4 不同温度下2种杂草根和烂根带菌测定
非病田采集早熟禾、看麦娘及烟苗(CK)移栽入含菌量107cfu·g-1的盆土里,并分别埋入捆绑的2种杂草的根,置于光暗交替(30W)的气候箱里(温度设10℃、15℃、20℃、25℃和30℃等5个处理),7d后分别取样作带菌测定,所得数据参考梁晨等的方法作图分析[16]。
1.5 青枯菌在杂草根部越冬监测
从病圃取土样(青枯菌密度5.36×106cfu·g-1),浇灌菌液增至3.27×108cfu·g-1后装入盆钵。2010年12月22日从无病田采集早熟禾、看麦娘、繁缕、牛繁缕、胜红蓟和辣子草等6种一年生杂草分别栽入以上带菌的盆土,试验在露天下进行,晴天酌情浇水。之后每隔20d取每种杂草的根作带菌测定。2011年2月20日从各处理分离青枯菌并挑取典型菌落移到PSA斜面上培养36h后加水5mL,配成细菌悬液,用注射法浸注烟草叶片,观察产生的枯斑反应,确认菌落的致病性[17],此项带菌测定延续至4月1日。另外,从福建省烟草研究所砂质重病田,取病土装入盆钵,并从该病地采集看麦娘栽入;同时从无病田采集看麦娘栽入无病盆土作为对照。
1.6 带菌杂草根腐烂时传播青枯菌监测
继1.5试验,3月中下旬多数处理的杂草处于衰老阶段,胜红蓟地上部枯死仅残留地下根茎;以带菌杂草的根为接种体移入无病盆土,栽入同种杂草后监测杂草根腐烂时青枯菌增殖和传播情况。冬后做第一次杂草翻埋入土处理,每种杂草从病盆土中连根拔起,剪取茎叶用水冲洗后埋入10㎝以下的无病盆土;取杂草根用清水反复冲洗至水清无浊(另取水样检测确认冲洗后的水不带菌),捞起挤干水备用。分别取早熟禾、看麦娘、繁缕、牛繁缕等4种杂草根各130g,胜红蓟和辣子草根各70g,各自混入10㎝以上无病盆土(供试土壤为水稻土,淹浸3个月后晒干,经检测确认不带菌)。4月3日从无病田采集迟生长的早熟禾等4种杂草及初春生长的胜红蓟等2种杂草分别栽入对应的无病盆土;自4月13日至5月13日每隔10d取杂草烂根、生长的杂草根及土壤样品作带菌测定。
此外,自然病土盆栽来自病田的看麦娘,按同样方法取出埋入无病盆土(CK2),再从无病田采集看麦娘分别栽入自然病盆土(CK1)和无病盆土(CK2)为自然病土和病田杂草对照。无病盆土生长的无病看麦娘埋入盆土,再移栽无病的看麦娘为空白对照(CK3)。
以上所有试验根的取样和处理、青枯菌分离和计数均参照方树民、原秀纪等的方法[12,18],所得数据采用SAS9.1.3软件分析处理。
1.7 冬后埋入土壤中带菌杂草传播烟草青枯病试验
继1.6试验5月14~15日人工接种病盆土生长的6种杂草和3个看麦娘对照,做第2次翻埋入土处理。每种杂草剪取茎叶埋入10㎝以下盆土,每盆称取根75g混入10㎝以上盆土,每种杂草处理3盆(盆径45㎝)。5月16日移栽感病品种红花大金元烟苗,每盆11~13株,试验常规管理,露天下进行;自6月15日始见发病起,每隔10d检查1次病情直至8月4日。
1.8 带菌杂草根传播烟草青枯病试验及根残体观察
从青枯病病圃中取7种杂草根样品及无病田采集的马齿苋(CK)测出根带菌:马齿苋1.38×107cfu·g-1,红辣蓼 1.80×106cfu·g-1,空心莲子草 1.47×106cfu·g-1,无芒稗 9.86×106cfu·g-1,马唐 1.20×107cfu·g-1,牛筋草 3.37×107cfu·g-1,胜红蓟 8.21×107cfu·g-1和马齿苋(CK)0 cfu·g-1。红辣蓼、空心莲子草、无芒稗、马唐、牛筋草等5种杂草剪除茎叶,留下根群,洗净根土并挤干水后,分别称取杂草的根210g并分别混入10㎝以上的无病盆土。因取材限制,马齿苋根55g加茎687g,胜红蓟根85g加茎叶828g,各自将茎叶埋入10㎝以下盆土,根混入10㎝以上盆土;采自无病田的马齿苋按同样方法处理作为对照(CK)。以上每种杂草处理3盆,6月15日移栽烟苗,每盆11~13株。
自7月1日起每隔10d检查1次病情直至8月19日,8月20日检查各处理埋入盆土中杂草根的腐烂程度并作带菌测定。病情分级标准、发病率和病情指数计算方法参照方树民等的方法[19]。依据最终所得烟草青枯病发病率,评价不同杂草之带菌的根传播青枯病的作用:强[S.g],烟草青枯病发病率≧70%;中[M],30%≦烟草青枯病发病率<70%;弱[W],烟草青枯病发病率<30%。
2 结果与分析
2.1 青枯菌在不同种杂草根部的寄生状况
从烟草青枯病病圃中取49种杂草根样品,用含利福平的选择性培养基作分离测定所得结果(表1)经方差分析表明不同种杂草根部定殖的菌量有显著或极显著差异。根据检测出的青枯菌数量可分3类,感(S):腋花蓼、胜红蓟、香附子和马齿苋等7种杂草,根带菌密度 1.24×105cfu·g-1~ 8.97×105cfu·g-1,占14.3%;中感(MS):簇生卷耳、无芒稗、裸花水竹叶和龙葵等18种杂草,根带菌密度1.15×104cfu·g-1~ 8.94×104cfu·g-1,占 36.7%;低感(LS):黄鹌菜、千金子、红花酢浆草和稗草等24种杂草,根带菌密度 4.08×103cfu·g-1~9.00×102cfu·g-1,占49.0%。这些杂草地上部生长正常未见青枯凋萎症状,根系也未见变黑腐烂,青枯菌呈潜伏侵染。49种杂草归属植物分类学的16个科,其中菊科和禾本科有19种,占38.7%,证实青枯菌小种Ⅰ有更宽的寄主范围[9]。
同一青枯病圃不同季节杂草优势群落更替后的带菌状况,1月10日牛繁缕和看麦娘根检测出的 菌 量 分 别 为 1.37×103cfu·g-1和 1.27×103cfu·g-1,4月10日辣子草和早熟禾根检测出的菌量分别为3.76×103cfu·g-1和 1.87×103cfu·g-1,7 月 10 日牛筋草和千金子根检测出的菌量分别为1.25×104cfu·g-1和2.68×103cfu·g-1,10月10日胜红蓟和无芒稗根检测出的菌量分别为 1.20×105cfu·g-1和 2.73×104cfu·g-1,说明青枯菌在一种杂草群落消亡后能转移到另一种再生的杂草群落根部寄生。
2.2 青枯菌在不同种杂草不同部位的分布
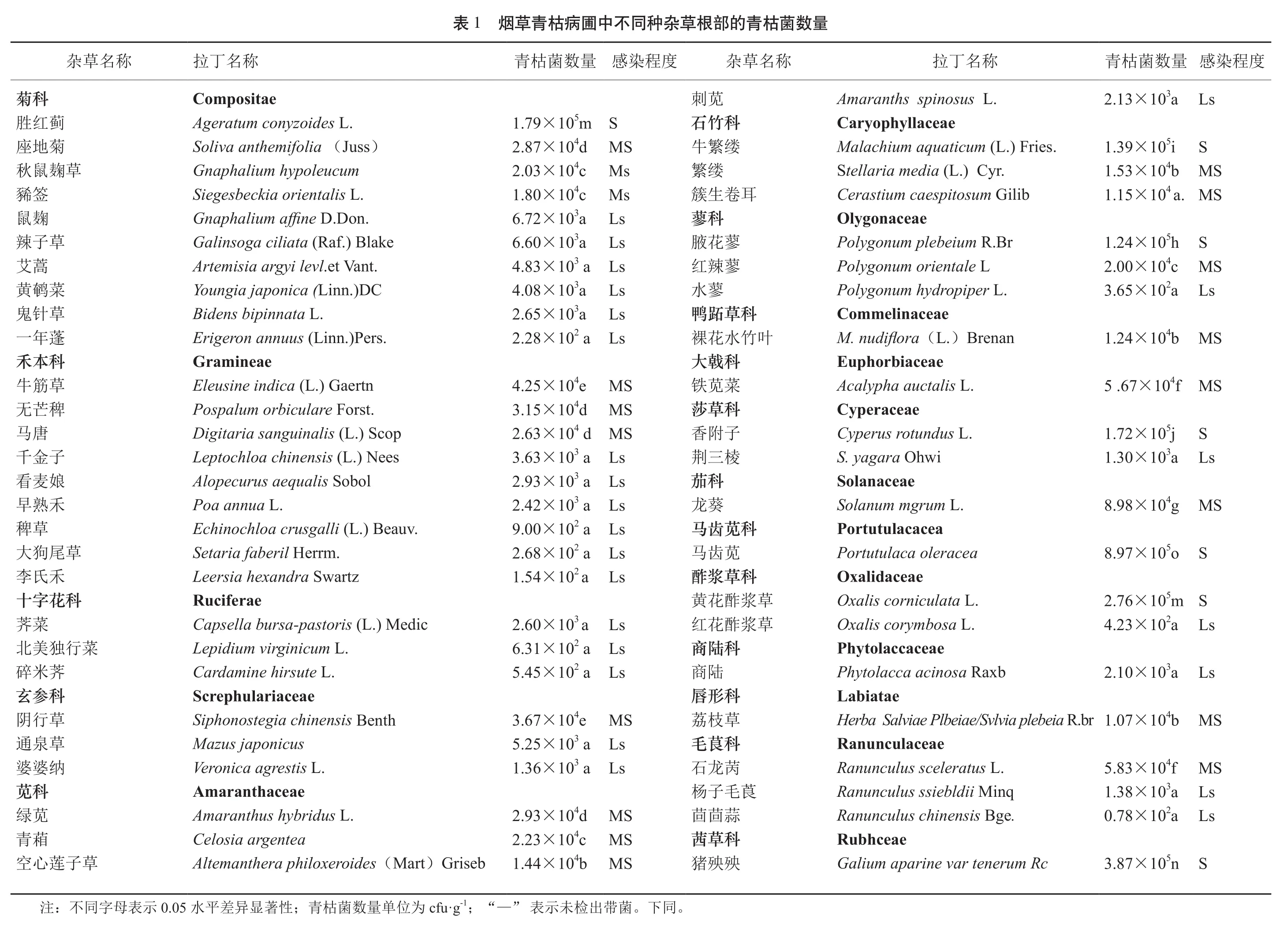
杂草根际土壤带菌测定显示11种杂草根际土壤均带菌,测出密度 4.33×102cfu·g-1~ 5.56×104cfu·g-1,但杂草不同部位测定结果(表2)显示鬼针草和牛筋草等11种杂草的不同部位测出青枯菌平均数量之间存在显著差异,其中鬼针草带菌的密度最低3.35×102cfu·g-1;不同种杂草带菌数量从低到高递增,马齿苋带菌密度最大9.11×104cfu·g-1。杂草不同部位青枯菌分布情况,鬼针草和商陆2种杂草只是根表带菌,测出密度分别为 1.34×103cfu·g-1和 1.64×103cfu·g-1,占18.2%;早熟禾和无芒稗等6种杂草根内外带菌,测 出 密 度 为 1.05×103cfu·g-1~ 1.33×104cfu·g-1, 占54.5%;牛筋草和马齿苋等3种杂草根、茎、叶带菌,测出密度 1.05×104cfu·g-1~ 9.11×104cfu·g-1,占27.3%。杂草不同部位青枯菌分离频率,根表100%,根内72.7%,茎和叶均为27.3%。
测定结果显然土壤中青枯菌均能聚集在杂草根表,并能侵入根内增殖,其菌量愈多形成系统侵染的可能性也越大。
2.3 青枯菌在不同种杂草根残体上的腐生能力
将无症状表现的21种杂草根埋入病地诱集青枯菌腐生(表3),依据从杂草烂根中检测出的青枯菌数量可分为3类:高度腐生(H),牛筋草和水蓼等8 种 杂草,测出菌量3.36×107cfu·g-1~3.38×10-6cfu·g-1,占38.1%;中度腐生(M),无芒稗和座地菊等7种杂草,测出菌量 8 .77×105cfu·g-1~ 1 .84×104cfu·g-1,占33.3%;低度腐生(L),石龙苪和稀签等6种杂草,测出菌量 6 .49×103cfu·g-1~ 2 .40×102cfu·g-1,占28.6%。
不同杂草的根腐烂时孳生的青枯菌数量之间存在显著差异,与正常生长的杂草根测出之菌量相比,牛筋草和通泉草等10种杂草根腐烂时青枯菌繁殖数量增加95%以上,占47.6%;香附子和黄鹌菜等5种杂草烂根测出菌量减少70%以上,占23.8%。
表2 杂草不同部位的青枯菌数量

表3 烟草青枯病地不同种杂草烂根的青枯菌数量
2.4 温度对青枯菌在2种杂草根寄生和腐生能力的影响
不同温度下从病盆土中取早熟禾、看麦娘的根及烟草根(CK),检出带菌数量(图1,表4)显示,10℃以上青枯菌在早熟禾和看麦娘的根部定殖数量,随温度上升菌量呈指数增长,30℃时达最大值。当温度≦25℃下青枯菌在看麦娘根部定殖数量高于早熟禾,25℃以上早熟禾根部定殖菌量则高于看麦娘。然而在不同室温下青枯菌在烟草根部定殖数量和增长速率均超过这2种杂草。从2种杂草烂根测出菌量显示(图1),当温度达10℃以上时,青枯菌在早熟禾和看麦娘的烂根增殖数量皆显著高于两者根部的定殖数量;20℃以下青枯菌在看麦娘烂根增值数量显著高于早熟禾;当温度≧20℃时,早熟禾烂根增殖数量则显著高于看麦娘。
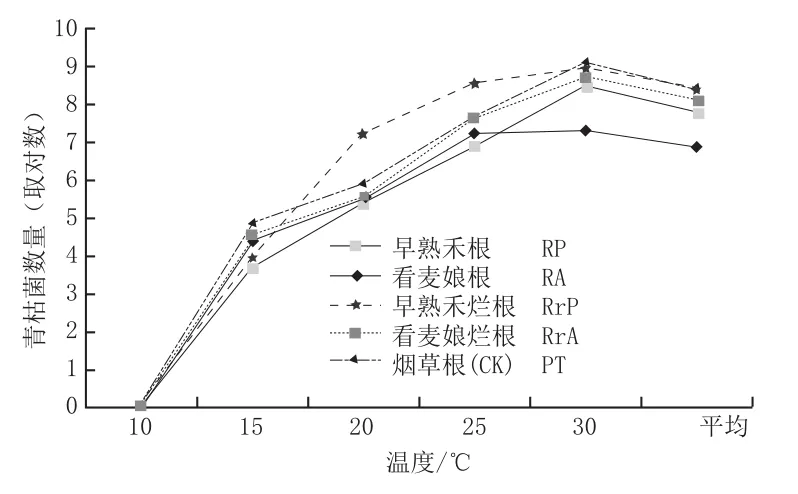
图1 早熟禾、看麦娘的根和烂根与烟草根(CK)的青枯菌数量对数比较
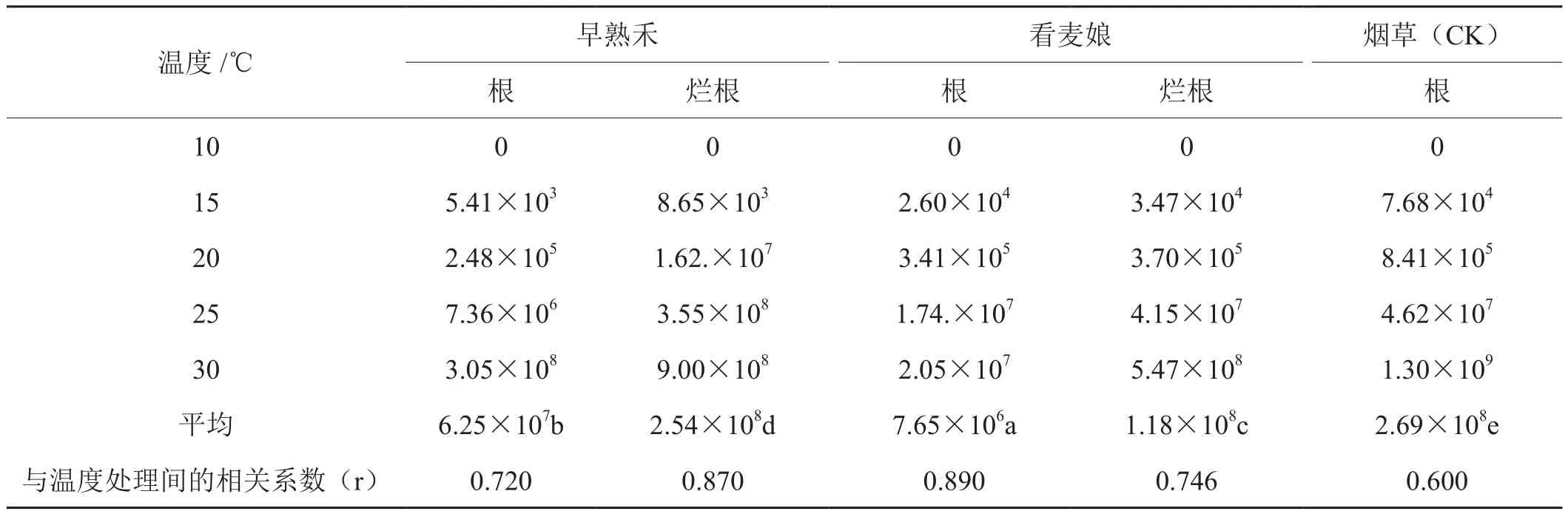
表4 温度对青枯菌在2种杂草根部寄生和腐生能力的影响
2.5 青枯菌在杂草根部的越冬状况
冬季来临时,将无症状表现的6种一年生杂草和烟草(CK)栽入带菌盆土,监测根部青枯菌的消长结果看出(表5)栽入病盆土20d后6种杂草根部均感染青枯菌,测出菌量 1.56×104cfu·g-1~ 3.35×105cfu·g-1,均值1.43×105cfu·g-1。此后由于冬季低温持续影响,青枯菌数量连续下降,至2月20日跌入谷底,均值8.97×103cfu·g-1,之后随春季气温回升,种群数量均有上升,4月1日均值3.62×104cfu·g-1,呈V形曲线,这种情形与青枯菌在烟草根部定殖数量极为相似。但不同种杂草根部青枯菌的越冬状况有明显差异,冬后早熟禾根部定殖菌数量上升到1.23×105cfu·g-1;越冬期间看麦娘根部定殖菌数量稳定在≧104cfu·g-1,均值 1.00×105cfu·g-1;牛繁缕则较低,均值9.09×103cfu·g-1;辣子草根带菌数量从6.81×104cfu·g-1起,持续减少,至3月12日降到未测出的水平,之后稍微回升至9.97×102cfu·g-1。显然,冬季不同种杂草根部定殖的青枯菌数量均出现波动,辣子草受影响较大,看麦娘则较稳定,但随春季气温的回升,各处理的种群数量都有不同程度增长。

表5 冬季青枯菌在不同种杂草根部的消长状况
2.6 带菌杂草根腐烂时青枯菌继续增殖与侵染生长的杂草根并传入土壤
冬后,衰老的带菌杂草洗净根土后移入无病盆土并栽入迟生初长的同种杂草、监测根腐烂时青枯菌数量和传播情况结果看出(表6)6 种杂草根腐烂时青枯菌持续增殖30~40d,不同种杂草烂根增殖数量有很大差异。早熟禾根移入盆土30d菌量均达106cfu·g-1,40d后降至 7 .42×102cfu·g-1,均值达 2 .6×106cfu·g-1;看麦娘根腐烂时青枯菌增殖数量出现波动,但稳定在>104cfu·g-1的水平;牛繁缕、胜红蓟和辣子草3种老化根腐烂30d时仍可测出带菌,过后降至未测到的水平。早熟禾和看麦娘的根腐烂时释放出的青枯菌均能侵染正在生长的同种杂草根,测 出 密 度 0.69×102cfu·g-1~ 3.42×104cfu·g-1和 0.76×102cfu·g-1~ 1.37×104cfu·g-1; 栽 后 40d 繁缕、牛繁缕和辣子草生长的根测出较低的菌量6.87×102cfu·g-1~ 8.25×102cfu·g-1,而胜红蓟生长的根始终未测出带菌。
栽后30d早熟禾和看麦娘处理的土壤中均测出带菌,密度为 1.08×103cfu·g-1~ 2.38×103cfu·g-1和1.91×102cfu·g-1~ 5.56×102cfu·g-1,然而牛繁缕、胜红蓟和辣子草3种处理的土壤均未测出带菌。由此显示土壤菌量少难被检测,显然在缺乏感病寄主的情形下,青枯菌有赖于杂草根残体中腐生或转移侵染生长的杂草根来延续在土壤中的存活期。

2.7 越冬后土壤中带菌杂草对翌年烟草青枯病发生的影响
冬后6种一年生带菌杂草处理和3个看麦娘对照处理,移栽烟草作青枯病系统观察的结果表明(表7)不同杂草处理的烟草青枯病发生迟早有显著差异。移栽30d后人工接种,自然病土和病地杂草(看麦娘)处理均在6月15日首次发病,发病率分别为7.1%、18.2%(CK1)和6.7%(CK2)。此后每隔10d出现1次青枯病发生期,持续3次,6月25日辣子草、胜红蓟处理发病率均为6.7%;繁缕和早熟禾处理7月5日发病率16.7%和6.7%;牛繁缕处理发病最迟,7月15日发病率7.6%。各处理发病后蔓延快慢有明显差异,自然病土加自然病地杂草看麦娘处理(CK1)7月5日最早达发病高峰,发病率72.7%,看麦娘和辣子草处理7月15日和25日出现高峰,发病率分别为64.3%和65.3%。至8月4日各处理的病情趋于稳定,不同处理最终形成的病害数量之间存在显著差异。看麦娘和辣子草处理显示较强的传病能力,发病率分别为85.7%和71.4%,二者之间存在显著差异;胜红蓟和繁缕处理的发病率分别为46.7%和48.1%,二者之间差异不显著;早熟禾和牛繁缕处理呈弱的传病力,发病率分别为26.7%和23.1%,二者之间的病情指数差异显著。自然砂质病田生长的看麦娘移入无病水稻土(CK2)的处理,青枯病发生早、蔓延慢,发病率42.9%;无症状表现的看麦娘移入无病盆土(CK3)的处理,所栽烟草生长正常,始终未见发病。由此可以证明供试土壤和烟草均不带菌的情形下,烟草青枯病发生的侵染源来自不同种的带菌杂草,无论人工接种或自然病土、自然病田杂草(看麦娘)的处理均能引起烟草青枯病发生早,表现强或中的传病能力。
2.8 带菌杂草根传播烟草青枯病及根残体观察
7种带菌杂草根和无病田生长的马齿苋分别埋入无病盆土并移栽烟草,监测青枯病发生情况结果表明(表8),烟草移栽后15d马齿苋处理最早发病(7月1日),发病率11.8%;其次红辣蓼、胜红蓟、空心莲子草和无芒稗处理7月10日发病,发病率分别为57.1%、7.1%、6.7%和6.7%,其中红辣蓼处理始发期出现较高的发病率;马唐和牛筋草处理发病较迟(7月20日和30日),发病率分别为7.8%和9.1%。至8月19日各处理的病情趋于稳定,马齿苋、红辣蓼、胜红蓟和空心莲子草4个处理的发病率分别为94.1%、100%、85.7%和93.3%,显示较强的传病能力,其中马齿苋、红辣蓼和胜红蓟处理三者病情指数之间无显著差异;无芒稗和马唐处理发病率为35.7%和38.5%,两者间无显著差异;牛筋草处理发病率27.3%,呈现较弱的传病能力。与此形成鲜明对照的是来自无病田的马齿苋移入无病盆土(CK)处理的烟草生长正常,始终未见发病。
带菌杂草根埋入盆土65d后检查残体腐烂程度并作带菌测定结果看出,马齿苋完全腐烂解体,未见任何残留迹象;红辣蓼根已变成黑色残体,测出带菌1.74×106cfu·g-1;胜红蓟主根变黑腐烂须根消失,测出带菌1.74×105cfu·g-1;无芒稗和马唐的2种根残体较明显,测出带菌1.63×105cfu·g-1和5.09×105cfu·g-1;空心莲子草和牛筋草的2种根腐烂较慢,有明显的根迹象,测出带菌2.06×107cfu·g-1和7.99×105cfu·g-1。可见除马齿苋根易烂外,参试6种带菌杂草根腐烂过程中青枯菌继续繁殖,持续时间超过65d,并持续释放青枯菌侵染生长的烟草根,导致青枯病不同程度发生。
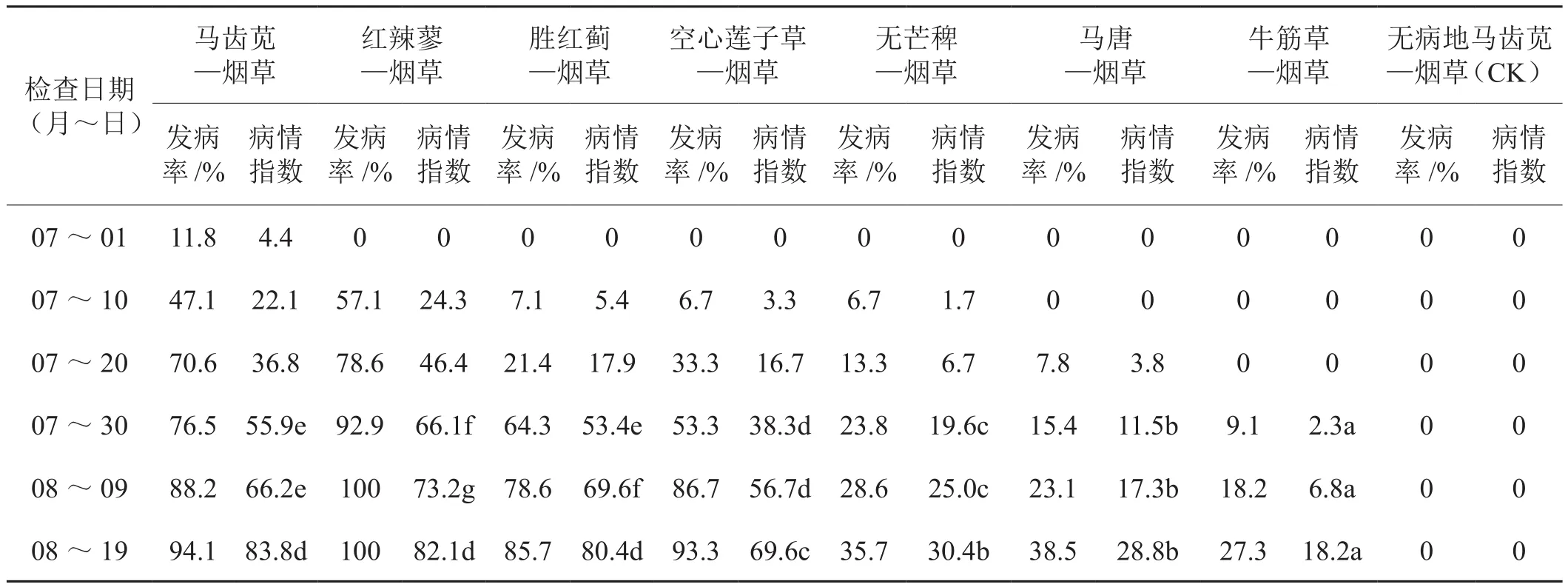
表8 不同种带菌杂草根传播烟草青枯病的作用
3 讨论
青枯菌不仅可以侵染杂草活体并存活于死腐的根组织里,但鲜见直接从杂草根部分离青枯菌的报道[1,3,7-8],方树民等利用利福平标记的选择性培养基则获得了成功[13,18,20]。随着杂草群落的更替,青枯菌则通过转主寄生来完成有效的周年循环,这种共生状态,导致短期内的轮作效果难以奏效[21],常见的杂草,空心莲子草、看麦娘、红辣蓼等一旦感染青枯菌即可通过雨水或灌溉水流入烟田,成为一种难以切断的侵染源即为佐证。
牛筋草和早熟禾根腐烂时青枯菌数量增多,但呈潜伏状态而难以表达致病作用,却为后作烟草提供了初侵染源,导致烟草青枯病发生迟且轻;冬季青枯菌在辣子草根部定殖数量及根腐烂时的繁殖菌量,与胜红蓟和繁缕处理相比,明显较低,但却具有较强的传病能力。这与Quimio等报道的前茬为马齿苋、牛筋草和刺苋等杂草的番茄青枯病病田,63d后经前二者处理的番茄枯萎率显著和略高于对照休耕田,刺苋处理的枯萎率则显著低于对照相吻合[6](表1)。显然感病寄主、杂草残体和土壤之间相互作用存在2种可能,一种是有利于感病寄主根系生长发育,提高抗病能力,对病原菌的侵染和扩展起到抑制作用,产生抑病效应;另一种则是削弱寄主抗性,利于病菌侵染,起到助病作用。但这一假设还需要通过试验获得更多的证据支持。
看麦娘种群数量下降到谷底时其根系定殖的青枯菌比烟草根仍增加了21.4%,冬后埋入无病土中的看麦娘根腐烂时青枯菌持续增殖超过40d,烟草移栽后30d,3个根带菌的看麦娘处理都最早发病;红辣蓼根腐烂时青枯菌数量增加99.8%,后作烟草始见发病率高,病情发展急速,30d后发病率即达90%以上。该结果与廖咏梅报道的根带菌的看麦娘若与砂质土结合,作物发病后30d即可引起流行的田间事实高度吻合[22]。由此说明青枯菌在土壤中的存活和延续以及侵染循环很大程度上取决于杂草寄主的种类和更替[3]。
研究结果可以推导出评价杂草寄主危害性的主要依据:(1)感病寄主播种或移栽及生长期田间占优势或常见的杂草种类。(2)带菌杂草根腐烂时青枯菌增殖数量及持续时间。(3)能在杂草根部安全越冬并具较强的传病能力。
4 结论
(1)烟草青枯菌生物型Ⅲ能在不同种的杂草根部定殖,但寄生部位有异,而且检出的带菌量还受到温度的影响。少数仅在根表寄生,多数能在根内外寄生,能从杂草的根部侵入后沿维管束扩展成系统侵染,但根茎叶均未见症状,呈潜伏性侵染。
(2)烟草青枯菌能在带菌杂草根腐烂时继续生长繁殖,持续时间与根腐烂的难易和解体速度快慢有关,红辣蓼和空心莲子草的根腐烂时青枯菌持续增殖超过65d,菌量平均超过106cfu·g-1,并释放出青枯菌侵染正在生长的植物根。
(3)冬季青枯菌能在看麦娘根部维持较稳定的种群数量,根腐烂时持续增殖超过40d,翌年成为有效的初侵染源,引起烟草发病早且重;红辣蓼和空心莲子草的根腐烂时青枯菌繁殖数量增加95%以上,传病能力强。因此,这些杂草应视为烟田青枯菌的危险性杂草寄主,但不同地理生态条件下可能分布不同种的杂草群落。弄清当地优势杂草群落及其带菌根的传病能力,对制定烟草青枯病综合防治措施有重要的指导作用。
[1]林骏奇,徐世典,曾国钦.台湾青枯病菌之杂草寄主[J].植物保护学会会刊,1999,41:277-292.
[2]崔宁宁,廖绍波,王胜坤,等.林木青枯病研究进展[J].植物保护,2009,36(6):22-29.
[3]Moffett M L, Hayward A C. The role of weed species in the survival of Pseudomonas solancearum in tomato cropping land Australas [J]. Plant Pathol,1980,9:6-8.
[4]Dukes P D, Morton D J, Jenkins S F Jr. Infection of indigenous hosts by Pseudomonas solancearum in south Georgia[J]. Phtopathpathology,1965,55:1055(Abstr.).
[5]Berg L A. Weed hosts of the SFR strain of Pseudomonas solancearum,causal organism of bacterial wilt of banans [J].Phytopathology.1971,61:1314-1315.
[6]Quimio A J, Chan H H. Survival of Pseudomonas solancearum E.F.Smith in the rhizosphere of some weed and economic plant species [J].Philipp Phytopathol,1979,15:108-121.
[7]Sunaina V Kishore V, Shekhawat G S. Latent survival of Pseudomonas solancearum in potato tubers and weeds[J].Zeitschrift fur Pflanzenkrankheiten und Ptlanzenschnutz,1989,96:361-364.
[8]Soares A M Q, Lopes C A. Bacterial wilt(Pseudomonas solancearum)on two weed species of the tamily [J].Labiatae Fitopatogia Brasileira, 1994,19:581-584.
[9]Granada G A, Sequeira L. Survival of Pseudomonas solancearum in soil,rhizosphere and plant roots[J]. Can J Microbiol, 1983,29:433-440.
【】【】
[10]Hayward A C. Biology and epidemiology of bacterial wilt caused by Pseudomonas solancearum[J]. Annu Rev Phytopathol, 1991,29:65-87.
[11]Olsson K. Overwintering of Pseudomonas solancearum in Sweden[C]//Sequeira L, Kelman. Proc. Int. Plann. Conf.Workshop Ecol. Control Bact. Wilt, Ist. Raleigh, N.C. State Univ,1976:105-109.
[12]方树民,纪成灿,顾钢,等. 烟草青枯病菌生理分化的研究[J].中国烟草学报,1998,4(1):38-43.
[13]方树民,唐莉娜,陈顺辉,等. 作物轮作对土壤中烟草青枯菌数量及发病的影响[J].中国生态农业学报,2011,19(2):377-382.
[14]福建科学技术委员会,《福建植物志》编写组. 福建植物志-第4卷[M].福州:福建科学技术出版社,1989:75-97.
[15]任铁. 玉米根际细菌和根表细菌对固氮螺旋菌生长的影响[J].微生物学报,1986,26(1):76-79.
[16]梁晨,吕国忠. 土壤真菌分离和计数方法的探讨[J].沈阳农业大学学报,2000,31(5): 515-518.
[17]方树民,陈顺辉,顾钢,等. 烟草青枯病菌浸注烟苗的显症反应与对杂草根部带菌检测[J].中国烟草学报,2006,12(3):31-34.
[18]原秀紀,小野邦明.タバコ立枯病菌の新しい選択培地による検出定量法[J].植物防疫,1984,38(2):76-79.
[19]方树民,陈剑芳,顾钢,等.烟草品种抗青枯病鉴定中相关因素分析[J].植物保护学报,2001,28(2):121-128.
[20]Weller D M,Seater A W. Rifimpicin-resistant Xanthomonas physeoli Var fuscans and Xanthononas phasedicola :Tools for field study of bean bight bacteria [J].Phytophthol,1978,68:778-781.
[21]姚革. 细菌性青枯病研究进展[J].植物保护,1989(1):31-33.
[22]廖咏梅,张桂英,罗家立,等. 土壤条件与番茄青枯病发生关系的探讨[J].广西植保,1997(3):13-16.

