荷叶离褶伞菌丝体富硒条件的研究
高慧娟,杨霞霞,杜学基,苏凤贤,张芬琴,席亚丽,魏生龙
(1.河西学院食用菌研究所,甘肃张掖734000; 2.河西学院农业与生物技术学院,甘肃张掖734000)
荷叶离褶伞是一种珍稀的野生食用菌,蛋白质含量高、氨基酸种类齐全,具有很高的营养价值[1]。由于其野生子实体数量较少,目前人工规模化栽培技术还不很成熟[2],而采用液态发酵技术可以获得大量的菌丝体。研究表明,荷叶离褶伞菌丝体中蛋白质的均衡性优于子实体,营养价值比子实体更高,且极具生产和食用价值[3]。硒作为人体必需的微量元素,能激发人体免疫球蛋白及抗体的产生,具有抗衰老作用[4]。食用菌因具有较强的富硒能力[5],将其在添加了Na2SeO3的培养基中进行液体发酵,通过菌丝细胞内物质代谢,使无机硒安全有效地转化为有机硒多糖和硒蛋白,大大提高食用菌的营养价值和应用范围。本研究以液体发酵培养的方式制备富硒荷叶离褶伞菌丝体,通过单因素和正交实验,探讨灭菌条件、加硒浓度,发酵时间和添加硒时间,对荷叶离褶伞生物量和富硒量的影响,初步确定荷叶离褶伞的最佳富硒发酵培养条件,以期对荷叶离褶伞菌丝体富硒研究提供一定的参考和依据。
1 材料与方法
1.1 材料与仪器
荷叶离褶伞 由河西学院食用菌研究所提供; Na2SeO3、KH2PO4、MgSO4等化学试剂 均为国产分析纯;PDA培养基:马铃薯200g,葡萄糖20g,KH2PO41g,MgSO41g,加水定容至1000mL。
S70-CJ-18U洁净工作台 上海博迅实业有限公司医疗设备厂;LGJ-18冷冻干燥机 北京松源华兴科技发展有限公司;DHG-9123A电热恒温鼓风干燥箱 上海齐欣科学仪器有限公司;LDZX-50FBS立式压力蒸汽灭菌器 上海申安医疗器械厂;ZHWY-200B恒温培养震荡器 上海智城分析仪器制造有限公司。
1.2 实验方法
1.2.1 菌种活化培养 将荷叶离褶伞母种菌丝块接入新鲜固体培养基上,置于22℃恒温培养箱中避光培养15d后,再转接一次,22℃培养15d,备用。
1.2.2 硒对荷叶离褶伞菌丝体生长和富硒量的影响 研究培养基灭菌条件、硒添加浓度、发酵时间和添加硒的时间对富硒菌丝体干重和富硒量的影响,再采用正交实验法优化最佳富硒条件。
1.2.2.1 发酵液中硒浓度范围选择 在250mL三角瓶中,加入100mL的液体培养基和Na2SeO3溶液,使硒在培养基中的终浓度分别为0、5、10、15、20、30、40、50、60、70、80、90μg/mL,每个浓度设三个平行对照,121℃灭菌20min。冷却至室温后,每瓶接入6片直径为6mm的菌丝块,置于121r/min,22℃的恒温培养震荡器上培养12d。测定菌丝体干重,以确定发酵液中添加硒浓度的范围。
1.2.2.2 发酵液中硒浓度对富硒菌丝体干重及富硒量的影响 在250mL三角瓶中,加入100mL的基础培养基和一定量的Na2SeO3,使硒在培养基中的终浓度为0、1、2、4、5、6、8、10μg/mL,每个浓度设三个平行对照,121℃灭菌20min。冷却至室温后,接入6片直径为6mm的菌丝块,置于恒温摇床(121r/min,22℃)上培养12d,测定菌丝体干重和富硒量,以确定富硒菌丝体最佳添加硒的浓度。
1.2.2.3 灭菌条件对富硒荷叶离褶伞菌丝体干重的影响 在250mL三角瓶中,加入100mL的液体培养基,在每个瓶中加入 Na2SeO3,使硒的终浓度为10μg/mL,分别在 115℃、20min,115℃、30min,121℃、20min和121℃、30min的条件下灭菌,每个灭菌条件设三个平行对照。冷却至室温后每瓶接入6块直径为6mm的菌丝块,置于121r/min,22℃的恒温摇床培养12d。测定菌丝体干重,以确定富硒菌丝体的最佳灭菌条件。
1.2.2.4 发酵时间对富硒菌丝体干重及富硒量的影响 在250mL三角瓶中,加入100mL的液体培养基,在每个瓶中加入 1.2.2.2中最佳硒浓度的量,在1.2.2.3的最佳灭菌条件下灭菌,冷却至室温后,接入6片直径为6mm的菌丝块,置于恒温摇床(121r/min,22℃)上培养,培养时间分别设定为7、9、11、12、13、15、16d,同一培养时间设定三个重复,测定菌丝体干重和富硒量。
1.2.2.5 硒添加时间对荷叶离褶伞菌丝体干重及富硒量的影响 在250mL三角瓶中,加入100mL的液体培养基,分别在发酵的第0、2、4、5、6、8、10、11d,加入1.2.2.2中最佳硒浓度,同一加入时间设定三个重复,在1.2.2.3的最佳灭菌条件下灭菌,冷却至室温后接入6片直径为6mm的菌丝块,置于恒温摇床(121r/min,22℃)上培养测定菌丝体干重和富硒量。
1.2.2.6 荷叶离褶伞菌丝体富硒条件的正交实验设计 在单因素实验基础上,为了获得荷叶离褶伞菌丝体对硒富集的最佳工艺条件,利用正交实验法,以发酵液中添加硒浓度、灭菌条件、硒的添加时间和发酵时间作为考察因素,选取3个水平进行实验。采用L9(34)正交表进行正交实验设计,设计因素水平表见表1。将对应的各因素进行填入表2,按表2安排的条件进行实验,每个处理3个重复,同时以不加入Na2SeO3发酵液为对照,确定最佳富集硒工艺条件。

表1 荷叶离褶伞富集无机硒正交实验因素水平表Table 1 Factors and levels for L9(34)orthogonal array design of Lyophyllum decastes
1.2.3 菌丝体干重的测定 摇床培养结束后,将100mL发酵液经300目滤网过滤,蒸馏水反复洗涤菌球后,置于真空冷冻干燥机中冷冻至干燥,称重即得菌丝体干重[6]。
1.2.4 富硒量和富硒率的测定 采用亚甲蓝还原法进行测定[7]。取7支试管,分别加入0.1mg/mL的Na2SeO3溶液0.0、1.0、3.0、5.0、7.0、9.0、10.0mL,加蒸馏水定容至10mL。再依次加入掩蔽剂5mL,甲醛5mL,碱性硫化物1mL和0.005%亚甲基蓝2滴,置于31℃水浴中观察褪色时间。以时间的倒数为横坐标,硒浓度为纵坐标,绘制标准曲线。
1.2.4.1 富硒量的测定 取0.3mL发酵液,加入9.7mL蒸馏水,再依次加入掩蔽剂5mL,甲醛5mL,碱性硫化物1mL和0.005%亚甲基蓝2滴,置于31℃水浴中观察褪色时间,从标准曲线上读出硒含量。用培养液中加入的硒量减去测得的剩余硒含量,即为菌丝体富硒量。
1.2.4.2 富硒率的计算 富硒率的计算:
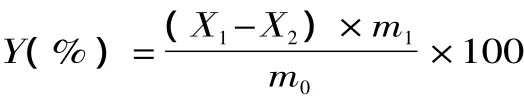
其中:X1表示富硒菌丝体中硒含量(μg/g),X2表示空白菌丝体硒含量(μg/g),m1表示富硒菌丝体干重(g),m0表示添加于培养基中的硒含量(g)。
1.2.4.3 隶属度的计算[8]正交结果中有菌丝体干重和富硒量两个指标,将两个指标转化为隶属度,隶属度的计算方法如下:

1.2.4.4 隶属度综合分的计算 将富硒量和菌丝体干重的权重分别取0.6和0.4,计算得隶属度综合分=干重量隶属度×0.4+富硒量隶属度×0.6。
2 结果与分析
2.1 发酵液中硒浓度范围的选择
由图1可知,Na2SeO3浓度在0~80μg/mL时,荷叶离褶伞均能生长,且随着硒浓度的增加,菌丝体干重量减少。当硒浓度等于10μg/mL时,菌丝体干重量降低至空白对照组的0.41倍,硒浓度在10~80μg/mL时,菌丝体干重量下降较为平缓。说明荷叶离褶伞发酵液中添加Na2SeO3对其菌丝体生长有抑制作用,其大小取决于硒浓度,硒浓度越大这种抑制作用越强。而且培养基的颜色随着Na2SeO3浓度的增加,呈现淡粉色到粉红色的变化,说明灭菌会促使Na2SeO3还原为硒单质,因此从生产富硒荷叶离褶伞的角度考虑,培养基中的Na2SeO3的浓度应低于10μg/mL,最终确定择硒浓度0~10μg/mL为硒最佳添加量。

表2 灭菌条件对荷叶离褶伞菌丝体的影响Table 2 Effect of sterilization conditions on mycelia of Lyophyllum decastes

图1 硒浓度对荷叶离褶伞菌丝体生长速率的影响Fig.1 Effect of Selenium concentration on mycelia growth rate of Lyophyllum decastes
2.2 发酵液中硒浓度对富硒菌丝体干重及富硒量的影响
测定发酵液中留存的无机硒的含量,标准曲线如图2所示,以硒含量为纵坐标,褪色时间的倒数为横坐标作图,得到回归方程为y=1708.1x-1.5571,R2=0.9945。

图2 硒含量标准曲线Fig.2 The standard curve of selenium content
为了选择合适的 Na2SeO3浓度,进一步将添加的Na2SeO3量细化,测定荷叶离褶伞菌丝体干重、富硒量和富硒率,结果见图3。
由图3可知,发酵液中添加Na2SeO3浓度会使荷叶离褶伞菌丝体干重下降,而所有处理组相比,其菌丝体干重又随着Na2SeO3浓度增加,出现小幅先增加后降低的趋势。当Na2SeO3浓度为5μg/mL时,菌丝体干重达到最大值,为0.5783g/100mL,随着浓度的进一步增加,菌丝体干重又开始下降。其中即使富硒菌丝体干重的最大值仍低于未添加Na2SeO3组菌丝体干重,其机理有待进一步研究。于此同时,检测随着Na2SeO3浓度的增加,荷叶离褶伞菌丝体富硒量和富硒率呈现先显著升高后略有下降低的变化趋势,其中Na2SeO3浓度为5μg/mL时,菌丝体中的富硒率达到最大值77.86%;而富硒量在Na2SeO3浓度为6μg/mL时达到最大值0.7864mg/g。综合菌丝体干重和富硒量的结果,选择 Na2SeO3的浓度为5μg/mL作为发酵的最佳浓度。

图3 发酵液中硒浓度对富硒菌丝体干重及富硒量的影响Fig.3 Effect of concentration of sodium selenite on mycelia dry weight and Selenium content of Lyophyllum decastes
2.3 灭菌条件对富硒荷叶离褶伞菌丝体干重和富硒量的影响
不同灭菌条件可能影响荷叶离褶伞菌丝体生长,为了确定上述观点,设定不同灭菌条件,观察培养基的颜色和测定菌丝体干重,结果见表2。
由表2可以看出,随着灭菌温度的增加和时间的延长,培养基的颜色由浅黄色色逐渐变为粉红色。当采用115℃、20min的灭菌条件时,菌丝体干重和富硒量达到最大,为0.3510g/100mL和0.3618mg/g,且污染率为0。说明在高温长时间的灭菌条件下,PDA培养基质中的无机硒,会被氧化成硒单质,变为粉红色[9],单质硒的存在不利于荷叶离褶伞菌丝对硒的富集,但是有利于菌丝体干重的积累,说明单质硒对菌丝体的毒害作用较小。结合灭菌条件对荷叶离褶伞菌丝体干重和富硒量的影响,选择115℃、20min的灭菌条件为最佳灭菌条件。
2.4 发酵时间对富硒菌丝体干重及富硒量的影响
在最优灭菌条件和加硒浓度已经确定的情况下,研究发酵时间对荷叶离褶伞菌丝体干重和富硒量的影响,结果见图4。
由图4可知,菌丝体干重随着发酵时间的延长呈现先增加后降低的趋势,并于发酵12d时达到最大0.4893g/100mL;而菌丝体对硒的富集量和富硒率随培养时间的变化规律与菌丝体干重呈现相同的趋势,也在发酵的第12d达到最大,分别为1.1063mg/g和76.95%。以上结果表明,在硒浓度不变的情况之下,随着发酵时间的延长,菌丝体开始生长速度增加,待菌丝体干重量达到最大后,菌丝体逐渐老化、溶解,干重量又逐渐减少。因此确定发酵的最佳时间为12d。

表3 正交实验结果Table 3 Results of orthogonal experiment
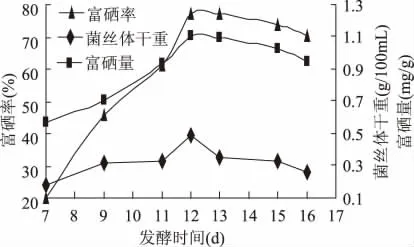
图4 不同发酵时间对菌丝体干重和富硒量的影响Fig.4 Effect of fermentation time on mycelia dry weight and selenium content of Lyophyllum decastes
2.5 硒添加时间对荷叶离褶伞菌丝体干重及富硒量的影响
在发酵的不同时间内加入Na2SeO3,观察添加时间对荷叶离褶伞菌丝体干重、富硒量和富硒率的影响结果见图5。
由图5可知,随着硒添加时间的延长,荷叶离褶伞菌丝体干重、富硒量和富硒率出现先增加后降低的开口向下的抛物线形状,在发酵的第6d加入Na2SeO3后,菌丝体干重达到最大值0.8171g/100mL,而菌丝体富硒量在第5d加入后达到0.742mg/g的最大量,在第5d和第6d加入Na2SeO3对富硒率的影响不大。综上,选择发酵第5d添加Na2SeO3为富硒培养实验中最佳加硒时间。

图5 硒添加时间对富硒菌丝体干重量和富硒量的影响Fig.5 Effect of add time of Na2SeO3on mycelia dry weight and selenium concent of Lyophyllum decastes
2.6 荷叶离褶伞菌丝体富硒条件的正交实验
按表1的设计,进行正交实验,由于菌丝体干重和富硒量两个指标的重要性不一样,要得到富硒的荷叶离褶伞菌丝体,既要得到高的富硒量,还要得到多的菌丝体,故而将富硒量和菌丝体干重权重分别取0.6和0.4,每个实验号的隶属度综合分数作为总指标进行直观分析,即综合分=干重量隶属度×0.4 +富硒量隶属度×0.6,所以在进行条件优化时只采用隶属度综合分为指标计算K值,结果见表3。
从正交结果来看,加入Na2SeO3的浓度对实验影响最大,其次为Na2SeO3添加时间,最后为发酵时间。最优富硒培养条件为:A1C2D3B3,即:培养基灭菌条件为115℃、20min,加硒浓度为4μg/mL,在发酵的第5d加入Na2SeO3,发酵13d。
实验中最佳的培养条件组合没有出现在正交表中,按照上述分析得到的最佳富硒条件进行验证,结果得到的菌丝体的干重量达到0.8232g/100mL,富硒量达到0.7040mg/g,较正交实验中每组结果都高,说明此条件是发酵过程中得到荷叶离褶伞菌丝体的最佳富硒条件。
3 结论与讨论
荷叶离褶伞菌丝体具有一定的富硒能力,在发酵开始时加入Na2SeO3对荷叶离褶伞菌丝体生长具有抑制作用,这种抑制随着Na2SeO3的浓度的增加呈现增加趋势;对Na2SeO3分别在发酵的不同时间添加,随着添加时间的延长,菌丝体干重量和富硒量呈现先增加而后降低的趋势,而且菌丝体干重较空白对照增加明显;不同灭菌条件也影响荷叶离褶伞菌丝体的富集硒的能力;说明在荷叶离褶伞富硒的发酵过程中,发酵条件可以有效的提高菌丝体的干重和富硒量。
在单因素实验的基础上,进行正交实验,优化的最佳培养条件为:培养基灭菌条件为115℃、20min,加硒浓度4μg/mL,在发酵的第5d加入Na2SeO3,发酵 13d,得到菌丝体干重和富硒量分别为0.8232g/100mL和0.7040mg/g,其中菌丝体干重较不加硒的空白培养基中增加了11%,这可为今后荷叶离褶伞菌丝体富硒的食品或药品的开发研究提供理论支持,具有一定的现实意义。
荷叶离褶伞菌丝体能将无机硒转化为有机硒,提高人们对硒的摄入的安全性,同时可以提高荷叶离褶伞的利用附加值,具有广阔的应用前景。
[1]席亚丽,王志江,王晓琴,等.荷叶离褶伞子实体、菌丝体和发酵液营养成分比较分析[J].食品科学,2010,31(6): 155-157.
[2]李永红,柴红梅,李树红,等.离褶伞研究进展[J].中国食用菌,2008,27(2):10-12.
[3]席亚丽,茆爱丽,王晓琴,等.荷叶离褶伞子实体、菌丝体及发酵液蛋白质营养价值评价[J].菌物学报,2010,29(4): 603-605.
[4]王俊,黄明,徐幸莲,等.硒及富硒功能食品研究进展[J].江苏农业科学,2003,2:54-56.
[5]余杰,崔鹏举,崔仕超,等.鸡腿菇菌丝深层培养富硒的研究[J].食品与发酵工业,2008,34(7):93-97.
[6]张汉燚,王志江,席亚丽,等.荷叶离褶伞中试发酵条件与培养基优化研究[J].中国酿造,2012,31(1):96-99.
[7]陈安天,顾浩,梁平,等.亚甲蓝还原法测定微量硒的实验条件研究[J].交通医药,2012,16(6):724-725.
[8]李云雁,胡传荣.实验设计与数据处理[M].北京:化学工业出版社,2008:135.
[9]蒋华东,何晓红,张礼霞,等.一株假单胞菌(Pseudomonas alcaliphila MBR)好氧还原亚硒酸钠为红色单质硒[J].微生物学报,2010,50(10):1347-1352.

