QT 间期对RR 间期变化的响应及HRV 与QTV 的关联性分析
朱 逸 杨啸林 彭 屹
(中国医学科学院基础医学研究所 北京协和医学院基础学院,北京 100005)
引言
体表心电图,特别是动态心电图(Holter 心电图),作为无创和连续的监测手段,在诊断和预测心律失常和心肌缺血事件的发生,以及药效评价等心脏安全评测方面具有重要而不可替代的位置。心电图间期时间序列是Holter 心电图数据中包含的重要信号,其中RR 间期和QT 间期在临床上最为基础,相关的应用基础研究具有更为重要的意义。RR间期指两个心拍之间的时间间隔,窦性心率条件下,连续心拍间瞬时心率的微小涨落,称为心率变异性(heart rate variability,HRV)。心室复极化时程通常以QT 间期代表,QT 间期指QRS 波起始至T 波终点的时间间隔,虽然体现的是心室除极和复极的总过程,但其主要成分是心室复极。与HRV 类似,QT 间期变异性(QTV)是指同一导联上逐拍QT 间期的微小涨落。
心脏自身节律主要受自主神经功能的调节。已有的研究证明,QT 间期的ST 段相当于心室肌细胞动作电位2 相平台期,这一间期的长短呈RR 间期依赖性;T 波反映心室肌细胞动作电位3 相快速复极过程,该间期不仅受自主神经的直接调节,而且受心室状况如心肌缺血、电解质紊乱、以及心脏本身病变等因素的影响[1-3]。如心肌缺血发生时,除对自主神经活性的影响,伴随心肌缺血产生的缺氧、酸中毒和细胞外K+升高,均有可能改变心肌细胞的电生理特性,表现为静息电位幅度的改变和动作电位持续时间的变化等,更多地体现在QTV 变化上[4]。QTV 也被认为是评价心律失常风险的更为敏感的指标[5-6]。同样,就RR 间期和QT 间期之间的联系和区别,研究两者的关系和关联程度及其生理和病理方面的影响因素,是一种了解和判断心脏安全的有效手段。文中从QT 间期对于RR 间期变化的响应,以及HRV 和QTV 关联性分析两个角度,介绍相关的分析方法和研究进展。
1 QT 间期对RR 间期变化的响应
QT 间期对RR 间期变化的响应可分为心率适应(rate adaption)和滞后适应(hysteresis adaption)两个生理过程,这两个过程是相互独立的[7],因此可以根据研究需要分别考虑或者同时考虑。临床实践中,为降低心率对QT 间期的影响,通常采用QT 间期校正(QTc)模型,其中最常用的Bazett 模型(QTc = QT/RR0.5)和Fridericia 模型(QTc = QT/RR0.33)体现的就是典型的心率适应,仅使用即时心率对QT 间期进行校正。事实上,这种类型的校正是存在限制条件的。
Pueyo 等对QT 间期对心率改变的响应进行了系统的研究[8-9]。首先,提出一种新颖的方法评估QT 间期对心率动态改变的滞后适应性响应。该方法通过计算一个QT 间期之前不同窗宽RR 间期的加权平均值以估算窗内所有RR 间期对心室复极时程的影响。通过全局最优化算法获得权重分布,利用10 种不同的回归模型对进行曲线拟合,并对不同模型的最小回归残差进行比较分析,利用其中回归残差最小的模型,估计QT 间期在适应RR 变化时的延迟。平均来说,150 个心拍的响应窗宽(大约2.5 min)可以使响应模型具有良好的准确度,虽然存在明显的个体差异。而且不同的病理情况下,不同的最佳拟合模型会在响应窗宽上产生差异,频繁变化的RR 间期将会增加响应窗的宽度。
随后,Pueyo 等采用自适应方法进行进一步研究[9]。构建一时变系统,由一个线性FIR 时变滤波器和一个时变零记忆非线性函数组成,RR 间期作为输入,QT 间期作为输出,其中,线性部分考虑了前一时段中的RR 间期对该QT 间期的影响,非线性部分的输入为同一时段RR 间期通过线性滤波器后的平均值。线性滤波器的一阶权重代表QT 间期对其前一个RR 间期的依赖性,当心率发生突然且明显的改变时,该值下降,强调了利用前一时段RR 间期在分析QT/RR 关系中的重要性,也说明对于QT 间期的即时心率校正,必须在心率平稳的前提下才有意义。线性条件下还可以观察到QT/RR 的滞后现象在心率下降时更加明显。该模型的有效性在合成数据和正常人心电图数据中得到验证。
Seethala 等研究不同初始心率水平下QT 间期对心率突变的响应[10]。10 名受试都曾接受过治疗室上性心动过速的射频消融手术。通过心脏起搏器,分别设定60 ~140 次/min 的初始心率水平,而在每一初始水平下,通过注射多巴酚丁胺(10μg/kg/min)使心率发生快速变化,运用回归方程,建立以RR 间期预测QT 间期的模型。QT 间期对心率突变的响应存在两个明显的时相,分别为呈线性的对心率变化即时响应的快变过程和呈指数型的逐步到达稳态的慢变过程(时间常数约为1 min)。快变过程是QT 间期对即时心率的响应,而慢变过程则是QT 间期对前一时段内RR 间期的响应。同时在实验中,分别用各自的标准差表征HRV 和QTV。在窦性心率条件下,QTV 在多巴酚丁胺的作用下明显增加,而此时HRV 降低,反映出心率变化后,QT间期在适应期,特别是在即时响应期通过增加自身的变异性以适应心率的变化。需要注意的是,即时响应所占的比例有限,既使在多巴酚丁胺作用时均值为13.28%。说明在心率不稳定时,只考虑即时心率适应将出现较大偏差。
Malik 等的研究结果[11]提示我们,对于即时心率校正,校正模型的选择也对QTc 的准确性有不可忽视的影响。该研究基于统计建模,提出引入QT/RR 曲率模式,研究进行个体化QTc 计算,以提高QTc 的准确性。心电信号取自352 名健康受试者(男性和女性各176 名)。对于每个受试者,选取1 440 个心电图相关片段,这些片段由QT 间期和相应的经过个体化QT/RR 时滞校正的RR 间期组成。在进行即时心率QT 间期校正算法的研究中,QT/RR 曲率模式分别用对应于不同生理状态的12 个回归方程拟合。在RR 间期为400 ~1600 ms 的范围内,对每个数据段,分别进行用上述12 个回归方程拟合,然后利用残差最小化分析,确定某段心电图的最优回归模型,并同时套用与该回归模型相对应的QTc 计算方法,得到校正后QT 间期。将个体化最优模型产生的QTc 与全纪录中只用一种拟合方式的QTc 进行对比分析。结果表明,任何一种回归模型用于全部数据都会低估或者高估QTc。以RR 在500 ms 水平为例,线性模型导致的QTc 误差为几个毫秒,而对数线性回归模型的误差则超过10 ms,虽然男性和女性的具体误差数值有别,但在同一数量级上。不同个体和同一个体的不同片段均存在QT/RR 回归曲率模式的差异,提示在QT 间期进行心率校正时,应考虑这些差异。随意选择的回归模型会对QTc 估计带来更多误差。常用的线性和对数-线性回归模型,如果不检测其使用条件,可能成为准确性较差的模型。
上述研究结果表明,QT 间期不仅仅由前一拍的RR 间期决定,更依赖于前一时段中的RR 间期。相应的QT 间期校正也可分为心率校正模型和时滞校正模型或兼而有之。临床上最常用的Bazett 校正模型和Fridericia 校正模型仅使用即时心率来预测QT间期长度,并没有考虑QT 间期对RR 间期的慢响应过程。因而这种类型的校正只有在心率平稳时具有较高的准确性。当然,平稳的心率可以通过测量前休息,测量时取卧位等实现,这时的QT 间期已经完成滞后适应的慢响应过程,适应了基准心率,此时采用即时心率校正既简便也可基本满足需要。即便如此,如文献[11]研究结果的提示,校正模型的选择对于减小校正误差具有重要意义。同时需要指出,在研究短时心率变化的场合,如运动测试和某些病理状况引起的心率突变,滞后适应对于QTc 计算是不可以忽略的。
2 HRV 和QTV 之间的关联性分析
RR 间期和QT 间期调节机制的不同,不仅体现在两者在绝对数值上的响应关系,也体现在HRV 和QTV 联系与区别。
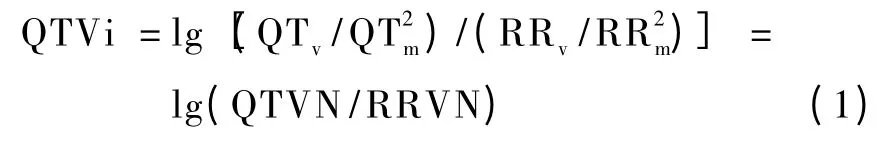
Baumert 等研究在原发性高血压患者中,其升高的交感神经活性是否导致QTV 增加[12]。受试包括23 位原发性高血压患者,以及9 位正常人作为对照。交感神经活性通过记录安静态冠状窦中去甲肾上腺素分泌量(cardiac NE spillover)获得,QTV 指数(QT variability index,QTVi)表示为[13]式中,QTv和RRv分别为所分析段QT 和RR 间期的方差,QTm和RRm分别为相应的均值。与正常人对比,原发性高血压患者的cardiac NE spillover 和QTVi 均显著升高(QTVN 上升,而RRVN 降低)。相关性分析显示,原发性高血压患者的QTVN 与cardiac NE spillover 有一定的相关性(r2=0.31,P =0.002),而在正常对照组中这种相关性则不存在(r2=0.20,P =0.23),这两者的区别具有启示作用,可能的机制在于QTVN 和cardiac NE spillover 的相关性需要在交感神经激活到一定水平时才能体现,正常人安静状态时cardiac NE spillover 还不足以达到这样的水平,而且该作者在其对抑郁症和恐慌症患者所做研究中也发现该现象[14]。Cardiac NE spillover 是心交感神经活动的直接测量指标,该研究表明,在原发性高血压人群中,心室复极不稳定性的增加和心交感神经过度兴奋有关,同时以QTVN 表征的QTV 升高,而以RRVN 表征的HRV降低,提示在交感神经活性增强时,自主神经对心室的直接调控增加,导致了HRV 与QTV 变化方向上的差别。
Piccirillo 等利用起搏器诱发充血性心力衰竭模型的狗进行实验[15]。实验狗共6 只,处于可自由活动状态。通过植入的装置直接记录并通过无线电发射心脏自主神经交感支和迷走支的电活动信号,同时记录心电图。分析实验狗在心衰发生之前(baseline)和发生之后(CHF)短时指标的变化,以及这些变化与所记录的心脏自主神经电活动信号的对应关系。在所选择的时长为5 min 的心电图中,提取RR 间期和QT 间期等间期序列,以短时变异性(short-term variability,STV)表示各间期的变异性,以基于自回归功率谱和交叉谱的相关函数衡量RR间期与QT 间期的关联程度。分析结果表明,CHF发生后,QT 间期的STV 较baseline 时显著升高,RR间期与QT 间期的相关函数值均显著降低,提示CHF 导致心室复极化的离散度增加,受RR 间期的调控程度也在减低。此外,线性回归分析显示交感神经活动与QT 间期的STV 呈正相关,而迷走神经活动与QT 间期的STV 指标呈负相关。此研究直接证明了自主神经对心室复极化过程的影响,也表明RR 间期和QT 间期的关联程度在病理条件下的变化,CHF 发生时,QT 间期受RR 间期的调控程度降低。
Porta 等最初提出一个动态线性参数模型,用于分析心室复极化变异性受HRV 和其他因素的影响,其中心室复极化间期以R 波顶点和T 波顶点的时间间隔表示(RT 间期)[16]。通过模型的参数辨识和频谱分解将RT 变异性(RTV)分解为RR 间期相关和RR 间期无关两个部分。11 位健康受试,实验处于3 种情形:静息状态、直立状态和控制呼吸状态。在低频段(0. 1 Hz 左右),较之静息状态,直立时RTV 中与RR 间期相关的比例增加,而与RR 间期无关的比例没有改变;同样是在低频段,与自然呼吸状态相比,控制呼吸对于RTV 中RR 间期相关部分和RR 间期无关部分均没有影响。
文献[17]的研究在文献[16]的基础上深化。在倾斜直立实验中,直立板的倾斜角以15°为间隔,在15° ~90°之间改变,形成6 种倾斜状态,15 名健康人以随机顺序在这6 种状态中记录心电图,同时记录胸廓运动以反映呼吸节律。检测RR 间期,呼吸节律,心室复极时程的测量取自两种RT 间期,即R 波峰值和T 波峰值的时间差(RTa)或是R 波峰值和T 波终点的时间差(RTe)。采用名为ARXRRXRAR 的参数化线性开环模型描述RTV,某个心拍的RT 间期被认为与其前的RT 间期,当前和以前的RR 间期、之前的呼吸节律以及用AR 模型描述的噪声有关。将RTV 分解为3 个部分:与RR 间期相关部分(RR - related RTV),与呼吸相关部分(R -related RTV)以及与RR - R 无关部分(RR - R unrelated RTV)。通过归一化方差χ2的比较,静息状态下,RR - related RTV 和RR - R unrelated RTV在RTV 中占很大比重,而且在直立板倾斜角逐渐增大造成交感神经活动增强时,RTV 的增大主要是因为RR -R unrelated RTV 增加所致,提示其可以取代总RTV 作为衡量心室交感神经活性的指标。
基于类似的实验设置,文献[18]同时从时域和频域两个角度,对直立板倾斜角逐渐增大时HRV 和RTV 的变化行为进行对比分析。时域分析指标为RR 和RT 间期序列的方差,频域谱分析基于AR 模型,并且以各频点的平方相关函数衡量RR 间期和QT 间期之间谱参数的相关性。随着直立板的倾斜角度增大,神经活性增强,迷走神经活性减弱,HRV和RTV 在变化行为上的差异逐渐显现,在方差方面表现为:随着倾斜角度的增大,RR 间期序列的方差减小,而RT(RTa和RTe)间期序列的方差增大,意味着HRV 减小,但RTV 增大。频域分析显示:低频段,RT 间期序列的功率随倾斜角增大而上升,而RR间期序列的功率与倾斜角无关;高频段,RR 间期序列的功率随倾斜角上升而降低,RT 间期序列的功率保持恒定。低频段HRV 的稳定性可能是缓冲动脉血压变化的压力反射器的作用,但压力反射器并不影响心室复极化的改变。高频段RTV 的稳定性则可能是呼吸造成的,与自主神经系统无关。可见此时心室复极化的变异性可用以衡量心交感神经的控制,HRV 则与迷走神经调节有关。
研究结果对于量化心室复极化时程与RR 间期变异性的耦合关系具有重要的指导意义,而且这种关联性分析包含了心脏自主神经调节的信息,当研究心脏对心室的控制时,除了传统的变异性指标,应该监测心室复极化时程和RR 间期之间相关的耦合性分析。
Almeida 等利用文献[16]中低阶线性自回归(autoregressive,AR)模型,将QTV 分解为与HRV相关和不相关两个部分,并通过计算功率谱密度将其量化[19]。通过计算功率谱之间的比例关系,估算在低频段(LF:0. 04 ~0. 15 Hz)和高频段(HF:0.15 ~0.4 Hz)内由HRV 引起的QTV 的比重。在对正常人群的心电图分析中,对于绝大部分(19/23)的分析段,QTV 与HRV 不相关的部分不小于40%。显然,QTV 中有相当部分并不是由HRV 导致的,其他因素对QTV 的影响也是不可忽视的。当然,由于所使用的模型并没有考虑非线性关系的存在,对估算的比例会有一些影响,而且QTV 和HRV在线性分析所表现出的不相关性并不一定表示它们彼此之间缺乏生理依赖关系。
QTV 和HRV 的耦合关系蕴含心脏自主神经调节的重要信息,联合分析QTV 和HRV,表征它们的关联性并研究其变化,对于评估心脏自主神经的调节作用,是一个重要的方面。心脏自主神经对窦房结的调节作用表现为心率和HRV 的动态改变,其对心室的直接调节作用,体现在RR 间期和心室复极化间期的耦合关系上。生理安静条件下,QT 间期主要受RR 间期的调节,同时也受自主神经的直接调节,使得QTV 中很大一部分是受HRV 驱动的,两者的一致性相对较高。病理条件下,这种耦合关系会发生一定程度的改变,而且已有的一些研究结果也证实了这一点。
Murabayashi 等利用European ST - T Database中68 条各持续2 h 并包含缺血段的心电图数据,就缺血段和非缺血段,分别进行归一化后的HRV 和QTV 时域指标对比[20]。研究发现,心肌缺血时段HRV 指标较非缺血段无显著变化,而QTV 指标却显著升高。Nahahoni 等对急性前壁心肌梗塞后的患者和正常对照组进行QT 间期和RR 间期的复杂度对比分析,复杂度以关联维数(PD2)表征[21]。研究发现,只在正常对照组中,两者的复杂度表现出高度相关,而这种相关性在患者组中几乎不存在;与正常对照组相比,患者在心肌梗塞后,QT 间期序列的复杂度显著升高,而其RR 间期序列的复杂度却比较显著降低,反映了心肌梗塞后自主神经损伤造成的影响。文献[22]利用 Physionet (www.physinet.org)中Long-term ST-T Database 包含的心肌缺血心电图数据,对心肌缺血过程中RR 间期序列和相对应的QT 间期序列进行短时交叉递归定量分析(cross recurrence quantification analysis ,CRQA),同时将缺血段前后各5 min 的心电图数据作为对照。分析结果表明,与对照段相比,心肌缺血发生时,表示递归图中垂直和水平结构数量的CRQA 指标显著增大,意味着RR 间期对QT 间期的调控作用减弱。
已有大量的研究表明,交感神经的过度兴奋所致的心脏自主神经失衡更易诱发恶性心律失常和心源性猝死[23-24],心脏自主神经状态的监测是心脏安全性评估的一个重要方面。利用HRV 分析可无创评估心脏自主神经系统中交感神经和迷走神经活动的张力及其两者的平衡[25],但分析指标易受年龄、性别、和昼夜节律等因素影响[26-27],置信区间令人满意的标准需要大样本量的支持。所以目前大量的研究,依然以年龄、性别相仿的健康人作为对照,难以真正用于临床。QTV 分析作为衡量心室复极化的无创检测指标,也存在类似的问题。
HRV 与QTV 的关联性分析在评测心脏自主神经活动具有潜在的用途,而且其关联性分析指标受个体差异(年龄、性别、昼夜节律等)和病理影响也是值得注意的问题。文献[28]选取Physionet 中Fantasia Database 和Normal Sinus Rhythm Database两个参据库的心电图数据,运用符号动力学分析指标,分别进行健康年长者和年轻人以及健康人的昼夜差异分析。结果表明,对于配对的RR 间期和QT间期序列的分析指标,即配对0V% 和配对2UV%,它们的互信息值与年龄、性别和昼夜无显著差异;而如果分别单独应用HRV 指标或者QTV 指标,上述个体差异造成的影响有明显的统计学意义。因此,联合分析QTV 和HRV,表征它们的一致性并研究其变化,对于评估心脏自主神经的调节作用,蕴含着不可忽视的信息。
3 结语
QT 间期与RR 间期之间,以及QTV 与HRV 之间的耦合关系,在正常安静的生理条件下其相关性表现得最为明显,这些关系可能因生理条件和病理因素的影响而发生变化。正确地量化这些耦合关系,对于认识和诊断病理过程,是十分有意义的。量化的过程需要实验与分析方法的结合,具有直接测量数据的实验是方法学建立的基础。在QTV 与HRV 之间耦合关系的研究方面,耦合指标的选择也是需要深入研究的。就QTV 与HRV 分析,在时域、频域、非线性等分析域,研究不同指标关联性分析方法,以及关联程度的影响因素,对于弱化个体差异,突出病理变化的影响,进而推动实际应用是非常必要的。
总之,充分利用动态心电图这一无创监测技术所提供的数据,发现其中所蕴藏的信息,对于心脏安全评测相关的研究和探讨,对于心脏自主神经状态用于心脏安全的评测,有着十分重要的意义。
[1] Ahnve S,Vallin H. Influence of heart rate and inhibition of autonomic tone on the QT interval[J]. Circulation,1982,65(3):435 -439.
[2] Magnano AR,Holleran S,Ramakrishnan R,et al. Autonomic nervous system influences on QT interval in normal subjects[J].J Am Coll Cardiol,2002,39(11):1820 -1826.
[3] Gastaldelli A,Emdin M,Conforti F,et al. Insulin prolongs the QTc interval in humans[J]. Am J Physiol Regul Integr Comp Physiol,2000,279:R2022 -R2025.
[4] Cascio WE,Johnson TA,Gettes LS. Electrophysiologic change in ischemic ventricular myocardium: Influence of Ionic,metabolic and energetic changes [J]. J Cardiovasc Electrophysiol,1995,6:1039 -1062.
[5] Varkevisser R,Wijers SC,van der Heyden MAG,et al. Beat-tobeat variability of repolarization as a new biomarker for proarrhythmia in vivo [J]. Heart Rhythm,2012,9:1718 -1726.
[6] Lengyel C,Orosz A,Hegyi P,et al. Increased short - term variability of the RT interval in professional soccer players:possible implications for arrhythmia prediction[J]. PLoS ONE,2011,6(4):e18751.
[7] Malik M,Hnatkova K,Novatny T,et al. Subject-specific profiles of QT/RR hysteresis [J]. Am J Physiol Heart Circ Physiol,2008,295:H2356 -H2363.
[8] Pueyo E,Smetana P,Caminal P,et al. Characterization of QT interval adaptation to RR interval changes and its use as a risk -stratifier of arrhythmic mortality in amiodarone - treated survivors of acute myocardial infarction [J]. IEEE Transactions on Biomedical Engineering,2004,51(9):1511 -1520.
[9] Pueyo E,Malik M,Laguna P. Beat - to - beat adaptation of QT interval to heart rate [C]//Proceedings of the 27th Annual Conference Engineering in Medicine and Biology. Shanghai:IEEE,2005:2487 -2478.
[10] Seethala S,Shusterman V,Saba S,et al. Effect of β-adrenergic stimulation on QT interval accommodation[J]. Heart Rhythm,2011,8(2):263 -270.
[11] Malik M,Hnatkova K,Kowalski D,et al. Importance of subject- specific QT/RR curvatures in the design of individual heart rate corrections of the QT interval [J]. J Electrocardiology,2012,45:571 -581.
[12] Baumert M,Schlaich MP,Nalivaiko E,et al. Relation between QT interval variability and cardiac sympathetic activity in hypertension[J]. Am J Physiol Heart Circ Physiol,2011,300:1412 -1417.
[13] Berger RD. QT variability [J]. J Electrocardiology,2003,36 Suppl:83 -87.
[14] Baumert M,Lambert GW,Dawood T,et al. QT interval variability and cardiac norepinephrine spillover in patients with depression and panic disorder[J]. Am J Physiol Heart Circ Physiol,2008,295:H962 -H968.
[15] Piccirillo G,Magrì D,Pappadà MA,et al. Autonomic nerve activity and the short-term variability of the Tpeak-Tendinterval in dogs with pacing - induced heart failure [J]. Heart Rhythm,2012,9:2045 -2050.
[16] Porta A,Baselli G,Caiani E,et al. Quantifying electrocardiogram RT-RR variability interactions [J]. Medical & Biological Engineering & Computing,1998,36:27 -34.
[17] Porta A,Tobaldini E,Gnecchi-Ruscone T,et al. RT variability unrelated to heart period and respiration progressively increases during graded head-up tilt [J]. Am J Physiol Heart Circ Physiol,2010,298:1406 -1414.
[18] Porta A,Bari V,Badilini F,et al. Frequency domain assessment of the coupling strength between ventricular repolarization duration and heart period during graded head - up tilt [J]. J Electrocardiology,2011,44:662 -668.
[19] Almeida R,Gouveia S,Rocha AP,et al. QT variability and HRV interactions in ECG:quantification and reliability [J]. IEEE Transactions on Biomedical Engineering,2006,53 (7):1317 -1329.
[20] Murabayashi T,Fetics B,Kass D,et al. Beat-to-beat QT interval variability associated with acute myocardial ischemia[J]. J Electrocardiology,2002,35(1):19 -25.
[21] Nahahoni E,Strasberg B,Adler E,et al. Complexity of the dynamic QT variability and RR variability in patients with acute anterior wall myocardial infarction [J]. J Electrocardiology,2004,37:173 -179.
[22] Peng Yi,Sun Zhongwei. Characterization of QT and RR interval series during acute myocardial ischemia by means of recurrence quantification analysis[J]. Medical & Biological Engineering &Computing,2011,49(1):25 -31.
[23] Goldberger JJ,Cain ME,Hohnloser SH,et al. American Heart Association/American College of Cardiology Foundation/Heart Rhythm Society Scientific Statement on Noninvasive Risk Stratification Techniques for Identifying Patients at Risk for Sudden Cardiac Death:A Scientific Statement from the American Heart Association Council on Clinical on Cardiology Committee on Electrocardiography and Arrhythmias and Council on Epidemiology and Prevention [J]. Circulation,2008,118:1497 -1518.
[24] Task Force of the European Society of Cardiology and the North American Society of Pacing and Electrophysiology. Heart rate variability: standards of measurement, physiological interpretation and clinical use[J]. Circulation,1996,93:1043-1065.
[25] 许亮,彭屹. 心率变异性在反映心脏自主神经损伤和重构中的应用[J]. 中国生物医学工程学报,2007,26:618 -622.
[26] Koskinen T,Kähönen M,Jula A,et al. Short - term heart rate variability in healthy young adults [J]. Autonomic Neuroscience:Basic and Clinical,2009,145:81 -88.
[27] Tulppo MP,Kiviniemi AM,Hautala AJ,et al. Physiological background of the loss of fractal heart rate dynamics [J].Circulation,2005,112:314 -319.
[28] Zhang Jing,Peng Yi. Assessment of cardiac autonomic state based on RR and QT interval series and symbolic analysis[C]//Computing in Cardiology. Hangzhou:IEEE,2011,38:689 -692.

