微囊化对HepG2 细胞渗透压调节基因表达影响及调控研究
肖 静 张 英 于玮婷 王 为 马小军*(中国科学院大连化学物理研究所,大连 6023)
2(南通大学公共卫生学院,南通 226019)
引言
细胞微囊化是将细胞包埋在具有半透膜性质的微囊膜内并保持其活性的过程,囊内细胞呈三维立体多细胞聚集生长,更接近在体细胞组织特性,因此在异体移植[1]、细胞大规模培养[2]、药物控释筛选[3]等领域广泛应用。但微囊化细胞依然存在纤维化、囊内细胞坏死、体外培养时增殖速率降低、生长延迟期增加等问题。这些问题的解决依赖于对微囊环境及囊内细胞行为的充分认识。
近年来,虽然研究者们从物质传递方面对微囊环境进行了探索,对微囊化细胞代谢规律有了初步认识,但因微囊微环境的复杂性而使结果相对局限。现在研究发现,除了物质传递因素外,微囊制备应用过程中还存在多种“胁迫”应激因素,如热“胁迫”、氧化“胁迫”、渗透压“胁迫”等,这些应激因素可通过诱导基因表达和相关信号传递,调控囊内细胞生长和功能[4-5]。但目前相关研究多建立于微生物模型如微囊化酵母细胞,在动物细胞微囊化研究中未见相关报道。而事实上,酵母等微生物生长代谢规律有异于哺乳动物细胞,且动物细胞对渗透压等外界环境变化更为敏感,因此有必要以微囊化动物细胞为模型,对微囊微环境以及相关细胞应激反应进行考察,以便为微囊化技术改进和应用提供更多数据。
鉴于以上情况,本研究选择以HepG2 为模型,同时设置平面对照和三维对照,考察微囊化对渗透压调节相关的钠/肌醇转运蛋白(sodium/myoinositol cotransporter,SMIT)和牛磺酸转运蛋白(taurine transporter,TAUT)基因表达影响,另外添加抗渗透压物质牛磺酸和海藻糖进行外源性干预,以了解囊内细胞生存状态,为优化微囊化细胞培养提供实验依据。
1 材料和方法
1.1 材料
实验用人肝癌细胞株HepG2 购自ATCC,海藻酸钠、聚赖氨酸、胰蛋白酶、Hoechst 33258、牛磺酸、海藻糖购自Sigma 公司,白蛋白检测试剂盒购自Bethyl 公 司,Trizol 裂 解 液、RT-PCR 试 剂 盒 购 自TaKaRa 公司,MEM 培养液购自Hyclone 公司,胎牛血清购自北京元亨圣马生物技术研究所,其他试剂均为国产分析纯。实验仪器包括YD-4 型微胶囊静电液滴发生器(中国科学院大连化学物理研究所,中国)、CX31 数码图像采集系统(Olympus 公司,日本)、PCR 仪(Eppendorf 公司,德国)、微量紫外定量分析仪(NanoDrop 公司,日本)、全自动酶标仪(Labsystems 公司,芬兰)、LS55 荧光分光光度计(PerkinElmer 公司,英国)。
1.2 方法
1.2.1 细胞培养
平面细胞:HepG2 细胞用MEM 培养液(15%胎牛血清、100 U/mL 青霉素、100 U/mL 链霉素、1 mM丙酮酸钠)5% CO2细胞培养箱中常规培养。
微囊化细胞:细胞生长至对数期,用0.25% 胰酶消化离心收集,悬浮于1.5% (W/V)海藻酸钠溶液,细胞密度2 ×109/L。利用微囊静电液滴发生器喷入0.1 M CaCl2溶液形成海藻酸钙胶珠,电压400 V,频率0.05 Hz,脉宽2 ms,然后用0.05% (W/V)多聚赖氨酸包裹,再与0.15% (W/V)海藻酸钠溶液反应,最后用55 mM 柠檬酸钠溶液液化,微囊直径为(300 ± 50)μm。获得微囊化HepG2 细胞37℃,5%CO2培养箱中培养。
多细胞球:多细胞球体采用liquid overlay 技术获得[6],先将20 g/L 琼脂糖0.5 mL 在6 孔板上铺一薄层,冷却后接种HepG2 细胞(1 ×106/L)2 mL,其余培养过程同微囊化细胞。
1.2.2 细胞生长形态学观察用相差显微镜观察微囊化细胞是否存在破裂,多细胞球是否存在崩解现象。
1.2.3 MTT 法测定细胞活性
平面细胞:待测孔加入20 μL MTT 溶液(5 mg/mL,PBS 溶液配制,4℃避光保存),37℃培养4 h,镜下观察有不溶性甲臜颗粒生成,弃上清加入200 μL DMSO 溶解结晶。微囊化细胞:待测孔加入100 μL MTT 溶液,37℃孵育24 h 后筛网过滤收集微囊,溶于1 mL DMSO 溶液。
检测时吸取平面细胞或微囊化细胞紫色DMSO溶解上清液100 μL,置酶标仪测定每孔OD 值,测定波长570 nm,参考波长620 nm。
1.2.4 DNA 分析法测定细胞数量
平面细胞胰酶消化后用含proteinase K 裂解液50℃孵育12 h,释放DNA;微囊化细胞用PBS 清洗破囊,加入含proteinase K 裂解液释放DNA。加入荧光染料Hoechst 33258,测定荧光光度值变化(Ex =355 nm,Em =460 nm),根据细胞数和DNA 荧光光度标准曲线确定细胞数。
1.2.5 Real Time-PCR 检测基因表达
提取细胞总RNA,两步法进行反转录和实时PCR,反转录条件为37℃ 15 min,85℃ 15 s;实时PCR 条件为:预变性95℃30 s,PCR 反应95℃5 s、60℃20 s,扩增40 个循环,引物设计如表1。
1.2.6 ELISA 检测白蛋白分泌水平
白蛋白检测依试剂说明书,每检测孔加100 μL 样品或标准品,用酶标仪测定450 nm 的吸光度值。
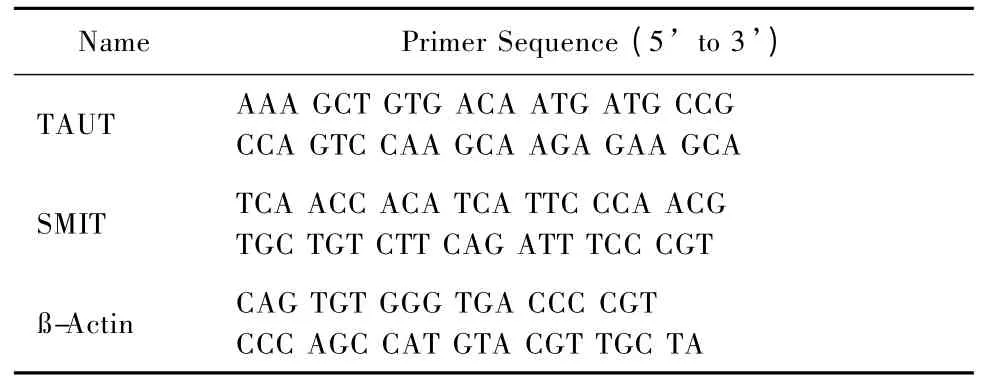
表1 基因引物设计Table. 1 Primer sequences of different gene detected by PCR
1.2. 7 牛磺酸和海藻糖对细胞生长和蛋白合成影响
分别配置含有不同浓度牛磺酸(0.5、1.5、1.0、2.0 mM)和海藻糖(0.05、0.1、0.2、0.5 mM)的培养液,培养微囊化细胞或平面细胞。于培养不同时间留取上清,检测白蛋白含量,MTT 法测定细胞活性,DNA 分析法测定细胞数量。
1.3 统计学分析
2 结果
2.1 不同培养方式下细胞生长情况
由于三维细胞球本身也会出现基因表达改变,因此为了解微囊化细胞出现的基因表达变化,究竟是来源于细胞三维生长方式本身,还是微囊微环境作用的结果,在实验中同时考察了同天数下平面细胞和普通三维细胞球,分别作为微囊化细胞的平面对照和三维对照。如图1 所示,不同培养方式下,细胞的生长方式有很大差异。对多细胞球,细胞在琼脂糖凝胶处理后的培养板上无法贴壁生长,而是在培养液中自动聚团,形成形状大小不规则的细胞团。细胞增殖速度很快,在第6 d 时,细胞团直径已达100 μm 左右,但因缺乏外在束缚,细胞团结构松散出现明显崩解,分散成较小的细胞团后各自增殖,不断重复聚团—崩解—聚团的生长过程[见图(b)]。而如图1 中(c)~(e)所示,微囊化细胞虽然也是以细胞团方式在囊内聚集生长,但生长相对缓慢且以数个分散细胞团的方式进行聚团,逐渐汇集。到培养第16 d 细胞团大小达到100 μm 左右,并在培养第28 d 时聚集成较大细胞团,占据大部分囊内空间。
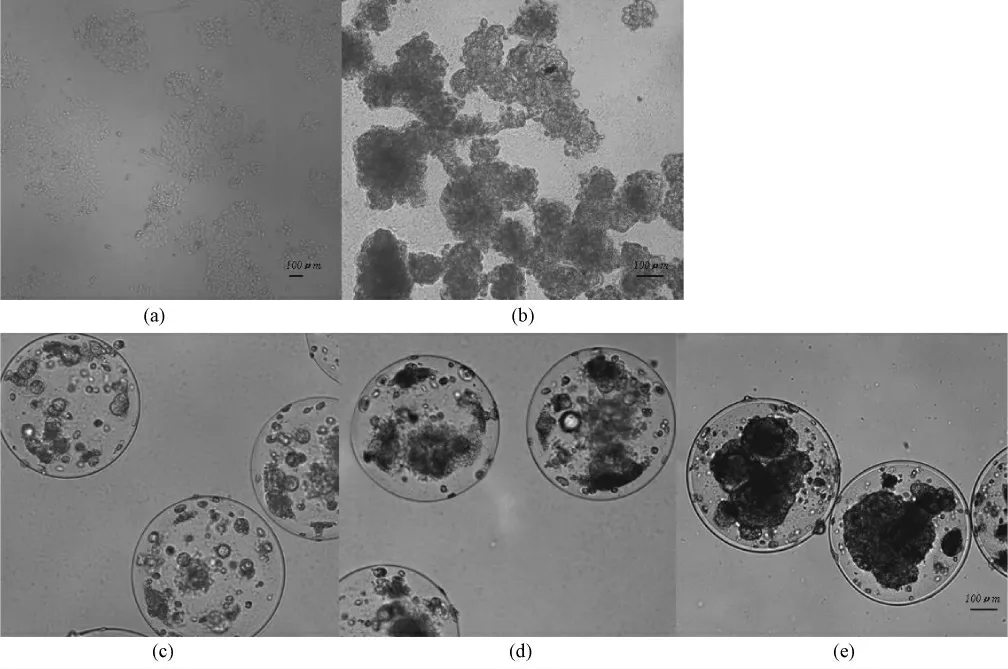
图1 不同培养方式下HepG2 细胞:(a)平面细胞;(b)多细胞球;(c)微囊化细胞培养第6 d;(d)微囊化细胞培养第16 d;(e)微囊化细胞培养第28 dFig. 1 The growth profile of HepG2 cells.(a)Monolayer cells;(b)Cell shperoid;(c)Microencapsulated cells Day 6;(d)Microencapsulated cells Day 16;(e)Microencapsulated cells D28
2.2 不同培养条件对渗透压基因表达影响
有学者研究认为,微囊内部可能存在高渗环境,影响囊内细胞生长行为和功能代谢[4,6-7],因此通过比较平面细胞、多细胞球以及微囊化细胞,考察二维培养、普通三维和微囊三维培养对细胞渗透压调节相关基因SMIT 和TAUT 表达影响,以了解微囊微环境是否是造成细胞生长代谢变化的原因。
对SMIT 基因,结果如图2 所示,同在培养第6 d 时,3 种不同培养方式下,SMIT 基因表达无显著差异,虽然微囊化细胞,随着培养时间延长,SMIT 的表达水平略有上升,但差异并无显著性(P >0. 05)。和SMIT 不同是,同样是渗透压调节基因的TAUT 的表达却出现了明显改变。如图3(a)所示,在培养第6 d,不同培养方式间TAUT 的表达量变化如下:微囊化细胞:多细胞球:平面细胞=4.3:2.6:1(P <0.01),微囊中该基因表达明显上调,但对于不同培养时间的微囊化细胞,TAUT 的表达水平并无显著差异(P >0.05),如图3(b)所示。
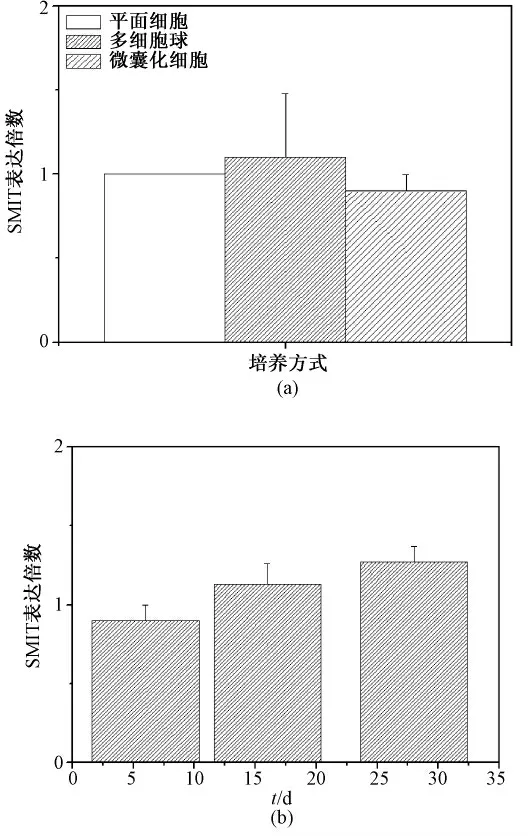
图2 对钠/肌醇转运蛋白基因表达影响。(a)不同培养方式;(b)微囊化细胞不同培养时间Fig. 2 Influence on the SMIT mRNA expression level.(a)Different culture model;(b)Microencapsulated cell at different time
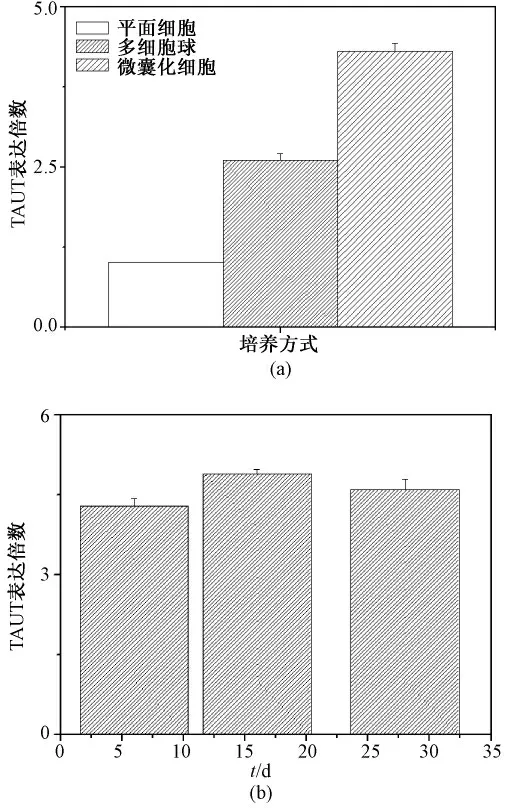
图3 对牛磺酸转运蛋白基因表达影响。(a)不同培养方式;(b)微囊化细胞不同培养时间Fig. 3 Influence on the TAUT mRNA expression level. (a)Different culture model;(b)Microencapsulated cell at different time
2.3 牛磺酸和海藻糖对不同培养方式下HepG2 活性及白蛋白分泌的影响
针对以上实验结果,向培养液中分别添加牛磺酸和海藻糖,以考察不同抗渗透压物质对细胞生长及HepG2 细胞功能产物白蛋白分泌的影响。
添加牛磺酸结果如图4 所示,对平面细胞而言[见图4(a)],牛磺酸在0.5 ~1.5 mM 的浓度范围内对细胞活性并无显著提升,而当牛磺酸浓度为2 mM 时,和对照相比细胞活性下降了20% ~35%,反而对细胞产生抑制效果(P <0.05);而图4(b)则表明,对于微囊化细胞,牛磺酸浓度在1 ~1.5 mM 时均使细胞活性出现增高,从第5 d 开始,细胞活性上升了15% ~30%(P <0.05)。与此结果类似,由图5(a)可见,未发现牛磺酸干预对平面细胞白蛋白水平的显著影响。但图5(b)结果显示,在微囊中1 ~1.5 mM 牛磺酸均使白蛋白水平增加约15%(P <0.05),且随着培养时间延长,趋势更为明显。
海藻糖是由两个葡萄糖分子以α,α,1,1-糖苷键构成的非还原性糖,能稳定生物膜维持渗透压平衡,对干、冷、高渗环境下的细胞具有良好保护作用。本实验中利用海藻糖的抗渗透压特性考察其对微囊化细胞的保护作用。结果如图6,当海藻糖浓度高于0.1 mM 时,自第3 d 开始,平面细胞活性出现减退,第4 d 起降低约30% (P <0. 05);而在0.1 mM 海藻糖作用下,微囊化细胞在培养第3 d 和第7 d 细胞活性分别增加20%和30%(P <0.05),但海藻糖浓度的继续增加(0.2 mM)并不会使细胞活性有更进一步提高。
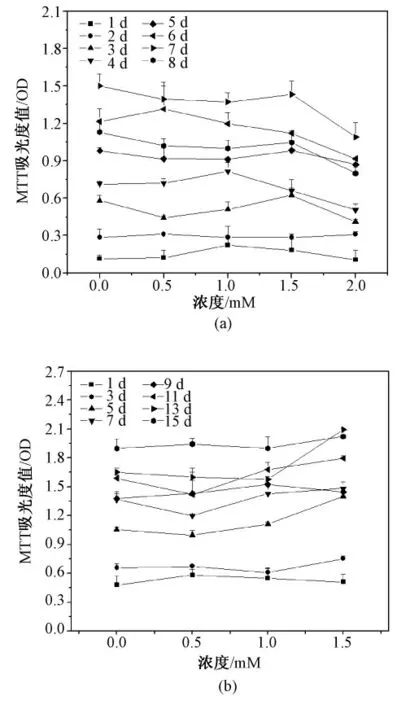
图4 牛磺酸浓度对HepG2 细胞生长影响。(a)平面细胞;(b)微囊化细胞Fig.4 Effect of taurine on HepG2 cell proliferation.(a)Monolayer cells;(b)Microencapsualted cells
虽然海藻糖在一定浓度对微囊化细胞活性具有改善效果,但从图7 结果可见,无论是平面细胞或微囊化细胞中都未发现海藻糖对白蛋白分泌水平的影响。
2.4 牛磺酸和海藻糖对微囊化细胞TAUT 基因表达影响
在分别添加了1.5 mM 牛磺酸和0.1 mM 海藻糖后,虽然微囊内的细胞活性和功能蛋白的分泌量出现了一定程度的改善,但并未对渗透压基因TAUT 的表达产生影响,结果如图8 所示。
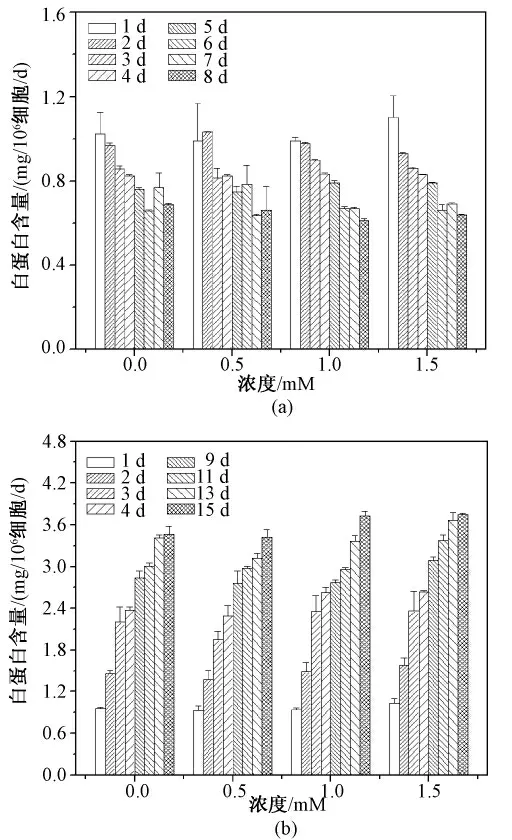
图5 牛磺酸对HepG2 细胞白蛋白分泌影响。(a)平面细胞;(b)微囊化细胞Fig. 5 Effect of taurine on albumin level. (a)Monolayer cells;(b)Microencapsualted cells.
3 讨论
随着对生物技术和膜技术研究不断深入,微胶囊已在固定化培养、药物控释筛选、人工器官及基因运载工具等领域广泛应用。但微囊微环境对囊内细胞的影响及作用机制尚不完全清楚,因此制约了生物微胶囊的技术改进和应用。
近年来的研究发现,微囊内细胞存在生长延迟期增加、代谢通量改变、细胞组分和胞内大分子含量变化等现象[8],并推测与环境扰动时的细胞应激反应有关[9-10]。研究者通过对渗透压敏感的酵母细胞观察发现,微囊内部存在一定胁迫因素,可能是造成细胞行为异常的原因,其中包括高渗透压应激[4]。对渗透压敏感的动物细胞而言,这种高渗环境的存在可能激发一系列细胞信号表达传递,对整体细胞行为产生影响,如有研究发现微囊化HepG2细胞出现热通量和脂代谢通量改变,线粒体功能和蛋白合成功能减退等现象,就很可能是微囊内部高渗环境导致的结果[4-7],但其具体作用机制尚未阐明。
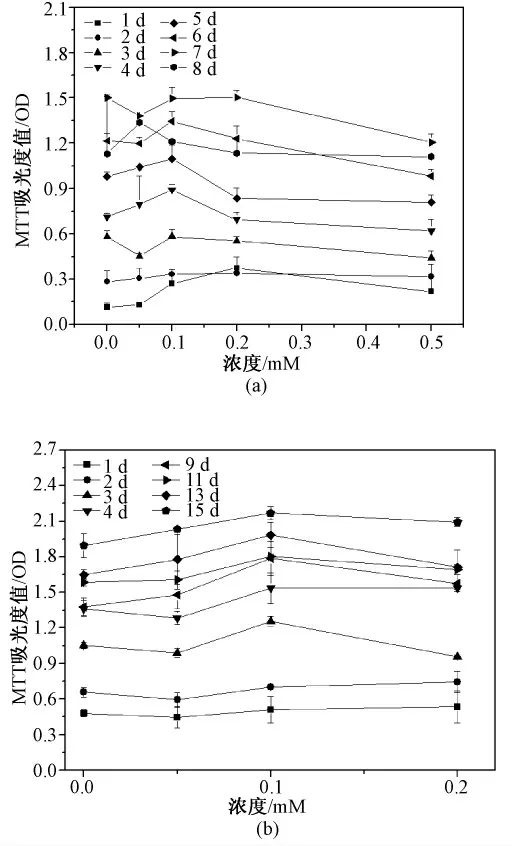
图6 海藻糖对HepG2 细胞生长的影响。(a)平面细胞;(b)微囊化细胞Fig 6 Effect of trehalose on HepG2 cell proliferation.(a)Monolayer cells;(b)Microencapsualted cells
动物细胞内的渗透压调节机制非常复杂,目前认为是通过影响细胞活化核因子5/弹性增强结合蛋白(nuclear factor of activated T cells 5/ tonicity enhancer binding protein,NFAT5/TonEBPT)的表达和核定位,对其下游物质转运基因进行调节,来达到渗透压调控的目的[11-12]。这是因为细胞在遭遇水合状态变化时,通常选择改变胞内大分子物质含量来维持状态稳定[13]。肌醇和牛磺酸是动物细胞中主要的抗渗透压物质,在不同组织和细胞中填充细胞内容,具有化学性分子伴侣的作用。相应的转运载体基因TAUT 和SMIT 启动子区中有NFAT5/TonEBPT 的结合位点,在高渗环境中受NFAT5/TonEBPT 信号调节出现表达上调[13]。在肾脏、肝脏、大脑等不同组织来源细胞(例如MDCK、Caco-2、HepG2 等)中,都发现高渗环境对SMIT 和TAUT 的表达存在不同程度的影响[14]。NHK 细胞暴露于渗透压为405 mOsmol/L 的NaCl 溶液中后,SMIT 和TAUT 的表达水平增加3 -5 倍[15]。Hideo 等也发现,甘露糖高渗溶液中牛磺酸对细胞活性的恢复和受TonEBP 调控的TAUT 表达增高有关[16]。因此细胞当中SMIT 和TAUT 的表达水平变化可以直接反映所处环境的渗透压改变。
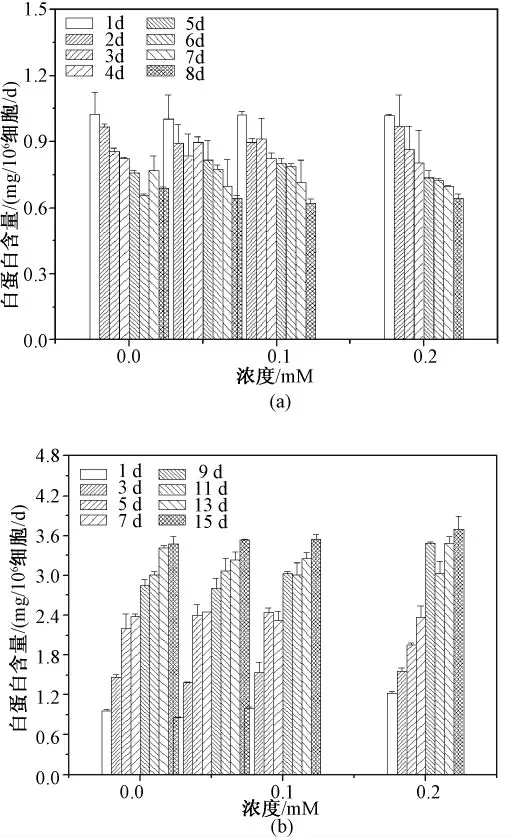
图7 海藻糖对细胞白蛋白水平的影响。(a)平面细胞;(b)微囊化细胞Fig 7 Effect of trehalose on albumin level. (a)Monolayer cells;(b)Microencapsualted cells.
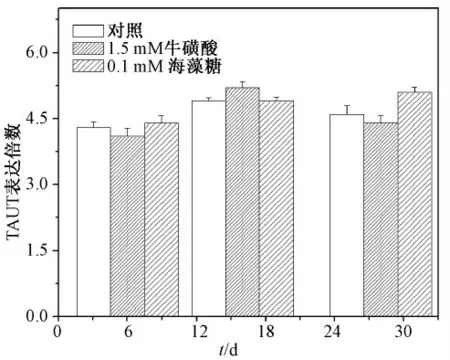
图8 牛磺酸和海藻糖对TAUT 基因表达影响Fig.8 Effects of taurine and trehalose on the TAUT mRNA expression level.
因此,本研究以HepG2 细胞为模型,考察微囊化细胞渗透压相关基因表达变化,探讨微囊中高渗应激的原因,究竟是来源于细胞三维生长所引起基因表达变化,还是单纯微囊微环境作用的结果。
首先,实验中未发现SMIT 在不同培养条件下的显著变化,这可能与不同组织来源的细胞所选择的抗渗透压物质不同有关,例如眼和脑细胞主要通过增加胞内肌醇和牛磺酸来调节渗透压,而肾脏来源的细胞则优先选择山梨醇[17]。有研究发现高渗条件下,肝脏来源细胞不采用转运肌醇方式来抵抗高渗,因此SMIT 表达不受影响[16],这解释了本次实验中未发现SMIT 表达变化的原因。在随后的实验中,需要选择其他组织来源细胞进行比较,以确定对该基因的影响
其次,实验中发现了与培养方式及培养时间有关的TAUT 的表达改变。第一:TAUT 表达水平在微囊化细胞>多细胞球>平面细胞,这一趋势说明TAUT 表达变化不但与三维生长方式有关,同时也和囊特殊环境有关,因此在囊内该基因的高表达,是三维立体组织和微囊内部环境综合作用的结果;第二:TAUT 在微囊化细胞中的持续稳定高表达说明,这种特殊环境因素长期存在。推测其产生的来源,认为和微囊核心中海藻酸钠材料有关。微囊包封所使用的海藻酸钠溶液是一种具有粘弹性的天然多糖培养基质。Li 等检测发现海藻酸钠溶液渗透压为330.6 ~338.5 mOsmol/Kg,略高于细胞耐受[2]。Sun 等则发现,海藻酸钠溶液中酵母细胞高渗透压胁迫耐受能力大大提高[4]。因此认为,微囊化培养中长期存在的海藻酸钠溶液高渗环境可能是造成TAUT 表达增高的原因。
针对以上结果,选用两种不同抗渗透压物质牛磺酸和海藻糖对微囊化培养进行干预[18]。结果显示,牛磺酸对平面细胞的活性和蛋白合成均无影响,高浓度下反而抑制细胞生长;但在微囊化细胞中,牛磺酸起到了明显改善细胞活性和功能的作用。这可能因为平面细胞中不存在高渗因素,同时细胞本身具有合成牛磺酸的能力,因此当胞外牛磺酸浓度增高超过胞内需求时,反而会抑制相关代谢通路,造成细胞活性抑制[14]。但对于微囊化细胞,由于海藻酸钠高渗环境的存在,外源性牛磺酸弥补了内源性合成不足的需求,因此表现出了对细胞生长的促进作用。而对于海藻糖,由于其主要通过稳定细胞膜来达到对细胞活性的改善,浓度增高时反而会造成膜结构僵化,且海藻糖不能自由进入细胞,不主动参与胞内合成通路,因而对蛋白合成功能无显著效益[19],这也是为何在实验中发现,海藻糖的加入只在一定程度上起到了改善微囊化细胞活性的作用,而对白蛋白分泌无显著影响。另外,加入牛磺酸和海藻糖后,虽然微囊化细胞的生长代谢都有所改善,但TAUT 的表达并未受到影响,这说明其发挥作用的方式可能与转运蛋白调控表达无关,其中可能涉及其他代谢通路的联合作用,有必要在以后的实验中探讨。
4 结论
微囊内存在高渗应激因素,能诱导渗透压调节基因TAUT 表达增高;牛磺酸和海藻糖能在一定程度上缓解此类高渗环境对细胞活性的抑制作用,但仅牛磺酸具有增加白蛋白合成的效果。以上实验结果,将有助于了解微囊微环境对细胞生长代谢影响的具体机制,为微囊化技术改进和实际应用提供实验依据。
[1] Li Yuanqiu,Wang Jian,Wen Xinyu,et al. Transplantation of co-microencapsulated hepatocytes and HUVECs for treatment of fulminant hepatic failure[J]. Int J Artif Organs,2012,35(6):458 -465.
[2] Li Shuangyue,Sun Zhijie,Lv Guojun,et al. Microencapsulated umbilical cord blood cells repair mouse hepatic injury by intraperitoneal transplantation[J]. Cytotherapy,2010,11(8):1032 -1040.
[3] Addo RT, Siddig A, Siwale R, et al. Formulation,characterization and testing of tetracaine hydrochloride-loaded albumin-chitosan microparticles for ocular drug delivery [J]. J Microencapsul,2010,27(2):95 -104.
[4] Sun Zhijie,Lv Guojun,Li Shuangyue,et al. Probing the role of microenvironment for microencapsulated Sacchromyces cerevisiae under osmotic stress[J]. J Biotechnol,2007,128(1):150 -161.
[5] Ning Xiaojuan,Sun Zhijie,Zhong Shen,et al. Growth and metabolism of osmo-sensentive yeast Y02724 and high-osmotic resistant yeast Hansel in alginate-chitosan-alginate microcapsules[J]. Sheng Wu Gong Cheng Xue Bao,2008,24(7):1274 -1278.
[6] 肖静,张英,于炜婷,等. 微囊化HepG2 细胞脂代谢变化对线粒体功能和蛋白合成能力的影响[J]. 中国组织工程研究与临床康复,2010,14(38):7082 -7086.
[7] Walker J, Martin C, Callaghan R. et al. Inhibition of Pglycoproteinfunction by XR9576 in a solid tumour model can restore anti cancer drug efficacy[J]. Eur J Cancer,2004,40(4):594 - 605.
[8] Hilge RB,Rehm HJ. Comparison of fermentation properties and speci-fic enzyme activities of free and calcium-alginate-entrapped Saccharomyces cerevisiae [J]. Appl Microbiol Biotechnol,1990,33(7):54 -58.
[9] Norton S, Amore DT. Physiological effects of yeast cell immobilization:applications for brewing [J]. Enzyme Microb Technol,1994,16(1):365 -375.
[10] Palkova Z,Janderova B,Gabriel J,et al. Ammonia mediates communication between yeast colonies[J]. Nature,1997,390(2):532 -536.
[11] Maurice BB,Joan DF,Natallaid ID,et al. Cellular Response to Hyperosmotic Stresses[J]. Physiol Rev,2007,87(1):1441 -1474.
[12] Steffann HO. Intracellular water homeostasis and the mammalian cellular osmotic stress response [J]. J Cell Phy,2006,206(1):9 -15.
[13] Akinlzhanov A,Krenacs L,Schlegel T,et al. Epigenetic changes and suppression of the nuclear factor of activated T cell(NFATCl) promoter in human lymphomas with defects in immunoreceptor signaling[J].Am J Pathol,2008,172(1):215-224.
[14] Takashi I,Yasushi F,Mayo H,et al. Expression of taurine transporter is regulated through the TonE (tonicity responsive element )/TonEBP (TonE binding protein ) pathway and contributes to cytoprotection in HepG2 cells [J]. Biochem J,2004,382(Pt 1):177 -182.
[15] Warskulat U,Reinen A,Grether BS,et al. The osmolyte strategy of normal human keratinocytes in maintaining cell homeostasis[J]. J Invest Dermatol,2004,123(3):516 -521.
[16] Hideo S,Eriko T,Yu HK,et al. Functional characterization and regulation of the taurine transporter and cysteine dioxygenase in human hepatoblastoma HepG2 cells[J]. Biochem J,2003,375(Pt 2):441 -447.
[17] Hijab S,Havalad S,Snyder AK. The role of organic osmolytes in the response of cultured astrocytes to hyperosmolarity[J]. Am J Ther,2011,18(5):366 -370.
[18] Wikström J,Elomaa M,Nevala L,et al. Viability of freeze dried microencapsulated human retinal pigment epithelial cells [J].Eur J Pharm Sci,2012,47(2):520 -526.
[19] Sukit L, Yifei W,Amadeu K, et al. Experimental and computational studies investigating trehalose protection of HepG2 cells from palmitate-induced toxicity[J]. Biophys J,2008,94(7):2869 -2883.

