新型全肝脏去细胞化流程对细胞外基质及细胞组分残留量影响的研究
汪 洋 刘 赞 叶海林 符竣惠 徐启纲 曾其强 吴建波 张启瑜*(温州医学院附属第一医院肝胆外科,温州 35000)
2(温州医学院附属第一医院内科实验室,温州 325000)
引言
以往的研究表明,同种甚至异种的细胞外基质(extracellular matrix,ECM)可对成体细胞的生长及干细胞的分化起重要作用[1]。不仅仅局限在皮肤[2]、膀胱[3]、心血管瓣膜[4]等组织,在组织工程应用中,以ECM 来源的去细胞化支架,于体外重建体积较大、较复杂的器官组织如肺[5]、心脏[6]等也已经可以实现,但仍有如回填细胞来源缺乏,器官功能重建不完善等诸多问题[7]。其中之一就是细胞组分残留与ECM 组分保护的矛盾问题。各类去细胞化技术在去除细胞的同时,对ECM 成分和结构有着不同程度的损害,但在目前一些已经临床应用的去细胞化支架中,存在很多因去细胞不完全而让患者体内产生免疫排斥及细胞毒性反应的事例。因此,建立一个完善的去细胞化效果评价体系十分重要[8-10]。在肝脏组织工程研究中,我们结合国内外各种去细胞化方法,以大鼠肝脏为研究对象,采用一种新的全肝脏去细胞化流程来制作去细胞化支架,并检测其形态结构,ECM 各组分含量,供体细胞组分残留量,完善评价其去细胞化效果。通过三维循环培养系统与支架的结合,探讨一种去细胞化支架在干细胞培养及肝脏疾病治疗中的新的应用模式。
1 材料与方法
1.1 材料
成年Sprague Dawley 大鼠(体重250 ~350 g;中国科学院上海实验动物中心);去细胞化试剂有胰蛋白酶(Gibco 公司,中国)、TritonX-100(Sigma 公司,中国)、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA;Sigma 公司,中国)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS;Sigma 公司,中国)、苯甲基磺酰(phenylmethanesulfonyl fluoride,PMSF;Sigma 公司,中国)、过氧乙酸(上海化学试剂厂,中国)、乙醇(上海化学试剂厂,中国)、青霉素/链霉素双抗(Gibco 公司,美国)、两性霉素B(Sigma 公司,美国)、兔抗大鼠层粘连蛋白抗体(Bioworld 公司,美国)、兔抗大鼠I 型胶原蛋白抗体(Bioworld 公司,美国)、兔抗大鼠纤粘连蛋白抗体(Bioworld 公司,美国)、氨基聚糖检测试剂盒(Biocolor 公司,英国)、大鼠肝细胞生长因子酶联免疫吸附测定试剂盒(hepatocyte growth factor,HGF;enzyme linked immunosorbent assay,ELISA;R&D 公司,美国)、大鼠血管内皮细胞生长因子酶联免疫吸附测定试剂盒(vascular endothelial growth factor,VEGF;R&D 公司,美国)、组织酸水解法羟脯氨酸测定试剂盒(南京建成生物工程研究所,中国)、组织DNA 抽提试剂盒(QIAGEN 公司,美国)、兔抗大鼠甘油醛-3-磷酸脱氢 酶 抗 体 (glyceraldehyde-3-phosphate dehydrogenase,GAPDH;Bioworld 公司,美国)、兔抗大鼠高迁移率族蛋白1 抗体(high mobility group,box-1 protein,HMGB1;Santa cruz 公司,美国)、鼠抗鼠主要组织相容性复合体I 抗体(major histocompatibility complex I,MHC-I;Cell Signaling 公司,美国);细胞培养材料有DMEM(Gibco 公司,中国)、胎牛血清(Gibco 公司,古巴),丁酸钠(Sigma 公司,美国);山羊抗大鼠白蛋白抗体(Santa Cruz 公司,美国)。
所有关于实验动物相关操作,均在温州医学院实验动物伦理委员会监督指导下进行。
1.2 方法
1.2.1 新型大鼠全肝脏去细胞化支架的制作
成年雄性SD 大鼠取腹部正中十字切口,暴露出肝下下腔静脉和门脉系统区域并全身肝素化(肝素100 U/mL,1 ~2 mL),标记腹腔干,结扎胆总管。切开膈肌,切断食管、肝上及肝下下腔静脉,门静脉置8F 塑料管并双重结扎固定,完整取下肝脏浸没于0.1 mM PBS 液内放置于-80℃下24 h 后室温下解冻(物理法)。0.02% 胰酶/0.05% EDTA 溶液37℃下流速8 mL/min 灌洗肝脏2 h(酶学法),后以去离子水和0.2 mM PBS 溶液各冲洗15 min 洗去残留胰酶。3% Triton-X100/0.05% EDTA/0.1% PMSF溶液灌洗肝脏16 ~18 h,以0.1% SDS 溶液再灌洗肝脏1 h(化学离子去污剂法)。此后以去离子水和0.2 mM PBS 溶液各冲洗肝脏15 min,重复一次,接着再以去离子水和0.2 mM PBS 溶液各冲洗30 min(高低渗溶液法)洗去残留的化学去污剂。0.01%过氧乙酸/4%乙醇溶液灌洗肝脏1 h(消毒及去除残留DNA),再以青霉素/链霉素/两性霉素B 溶液灌洗肝脏24 h 以上。以上过程中流速均为室温下8 mL/min,严格注意无菌操作。
1.2.2 组织形态学分析
1.2.2.1 大体组织形态学
分别观察不同去细胞阶段肝脏的大体形态,支架浸泡于4%多聚甲醛中固定,常规石蜡包埋,切片后H&E 染色,光镜下观察组织的结构,并与正常肝脏组织进行对比。
1.2.2.2 Ⅰ型胶原、层粘连蛋白、纤粘连蛋白的分布
去细胞支架及新鲜正常肝脏组织4%多聚甲醛固定,包埋切片,3% 牛血清蛋白封闭后,分批加入1:200 稀释的兔抗大鼠层粘连蛋白抗体、兔抗大鼠I型胶原蛋白抗体、兔抗大鼠纤粘连蛋白抗体室温孵育2 h,滴加生物素化二抗(山羊抗兔)室温孵育20 min,再滴加辣根酶标记链酶卵白素工作液,0.1 mM PBS 冲洗后加入DAB 显色,光镜下观察I 型胶原蛋白、纤粘连蛋白及层粘连蛋白的分布及含量。
1.2.2.3 扫描电镜检测
去细胞化支架及正常肝脏组织经过体积分数2.5%戊二醛固定,梯度酒精逐级脱水,置换,临界点干燥后喷金,扫描电镜观察组织内的血管及各种细微结构。
1.2.3 细胞外基质成分含量检测
1.2.3.1 氨基聚糖的检测
采用氨基聚糖含量检测试剂盒。分别称取50~100 mg 新鲜肝脏组织和去细胞化支架,65℃木瓜蛋白酶消化3 h,设置空白对照、标准品及待测样本,分别加入GAG 染料,常温震荡30 min 后12 000 r/min 离心10 min。干燥后加入解离剂,10 min 后酶标仪656 nm 波长下测吸光度值,计算标准曲线及组织内GAG 的含量。
1.2.3.2 总胶原蛋白检测
组织酸水解法羟脯氨酸测定试剂盒检测。准确称取25 ~50 mg 新鲜正常肝脏组织及去细胞化支架,加6 mol/L HCL 沸水浴水解5 h 后调pH 至6.0~6.8,离心取上清后,设置空白管、标准管,分别按顺序加入试剂1、试剂2、试剂3,60℃水浴15 min 后离心,上清于550 nm 波长处测吸光度值。羟脯氨酸含量的计算公式为:

组织总胶原蛋白含量按羟脯氨酸的含量占总胶原蛋白含量的14%来估算。
1.2.3.3 细胞因子HGF 及VEGF 含量的检测
大鼠HGF ELISA 试剂盒、大鼠VEGF ELISA 试剂盒检测。分别称取25 ~50 mg 新鲜肝脏组织和去细胞化支架,匀浆取上清,设置好空白对照、标准品、样品组,按顺序加入抗IGFBP-3 抗体、链霉亲和素-HRP,37℃温育60 min 后,洗板,加入显色剂A、B,37℃避光孵育10 min 后加终止液,酶标仪450 nm波长测各孔吸光度值,计算标准曲线及对应的组织内HGF 和VEGF 含量。
1.2.4 细胞组分残留检测
为正确评价新型去细胞化流程(n =5)在去除细胞残留组分的效果,将其设为A 组,在与正常肝脏组织(n =5)C 组比较的同时,参照文献[7]法制作的支架(n =8)作为B 组进行对比,观察以下组分含量的大小。
1.2.4.1 DNA 残留量检测
组织DNA 抽提试剂盒检测。分别称取25 ~50 mg 的A、B、C 组组织,蛋白酶k 在55℃下消化组织3 h,具体步骤按试剂盒内说明书要求操作,以酶标仪260 nm 波长处检测抽提出样本的DNA 吸光度值,组织DNA 的含量(μg/mg)按5 倍的吸光度值计算。
1.2.4.2 GAPDH、MHC-I 及HMGB1 蛋白残留量的检测
采用 Western-blotting 法,分别称取25 ~50 mgA、B、C 组组织匀浆,提总蛋白,BCA 法测定蛋白浓度。为了比较单位组织内各组间蛋白残留量的差别,每孔统一稀释至20 μg 组织所含蛋白后上样,电泳、转膜,孵一、二抗,曝光。Quantity One 软件分析灰度值比较各蛋白残留量大小。
1.2.5 与三维培养系统结合诱导培养WBF-344细胞
去细胞后的支架连入自行设计组装的三维双腔循环培养系统内,以分时多次法注入数目为107的WBF-344 卵圆细胞,含10% 胎牛血清及3.75 mmol/mL 丁酸钠的DMEM 培养液诱导培养,H&E染色及白蛋白免疫荧光观察细胞状态。
1.2.6 统计学方法
测量结果通过SPSS15.0 软件包处理,实验数据均以平均数±标准差表示,采用Student t 检验判断两个样本均数之间有无差别,细胞组分残留量的比较采用多样本方差分析法,P <0.05 具有统计学意义。

图1 三维循环培养系统(1 - 储液氧合腔;2 - 支架灌流腔;3 -蠕动泵;4 -去气泡装置;5 -鼓泡式氧合口)Fig.1 Three dimensional perfusion culture system (1 -Reservoirs;2 - Perfusion chamber;3 - Peristaltic pump;4 - Bubble trapper;5 - Bubble oxygenator)
2 结果
2.1 组织形态学分析
2.1.1 大体组织学观察
整个去细胞化过程共用时72 h,期间肝脏逐渐变白并透明化,内部可见管脉系统完整。H&E 染色结果显示去细胞化后未见明显供体细胞成分及DNA 残留,血管网系统尚完整(见图2)。
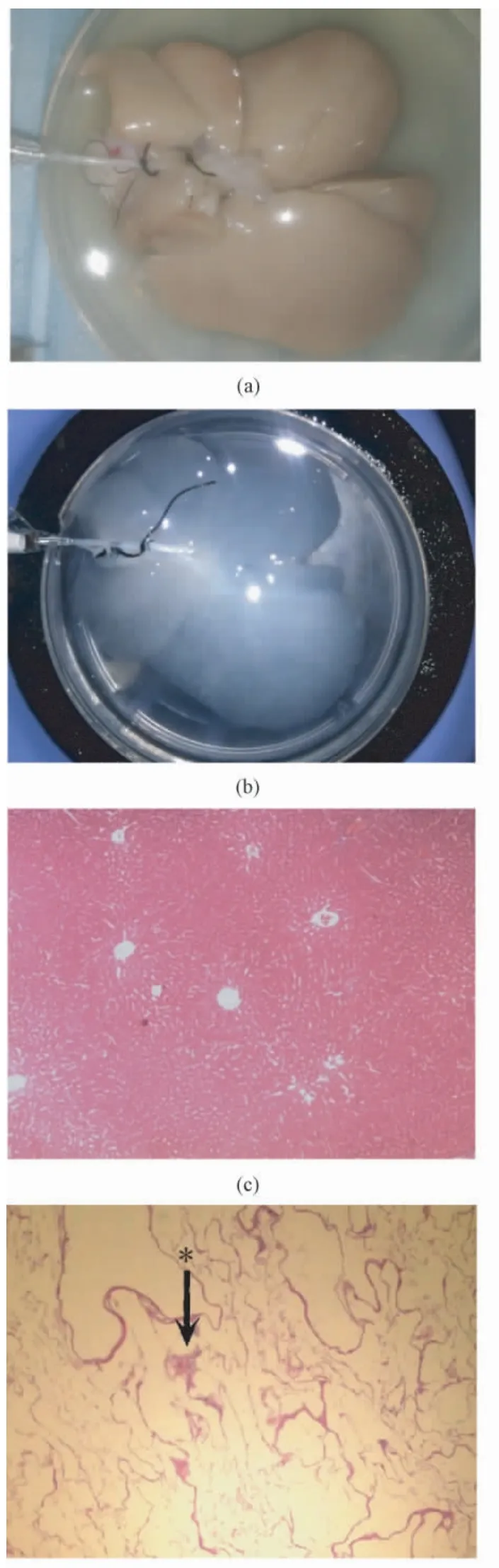
图2 大体组织学观察。(a)正常肝脏;(b)去细胞化完成后肝脏;(c)正常肝脏组织H&E 染色(200 ×);(d)去细胞化支架H&E 染色(200×,* :门静脉)Fig. 2 Morphological and histological observation. (a ) Normal liver; (b )Decellularized liver;(c)Hematoxylin and eosin staining of normal liver (200 × );(d )Hematoxylin and eosin staining of decellularized liver (200 ×,* :the portal vein)
2.1.2 I 型胶原蛋白、层粘连蛋白、纤粘连蛋白的分布
样本经免疫组化染色后,与正常组织比较,去细胞化支架内仍保留有大量的I 型胶原蛋白、层粘连蛋白、纤粘连蛋白等细胞外基质主要成分(见图3)。
2.1.3 扫描电镜检测
扫描电镜观察显示,在去除细胞后,未见明显细胞残留成分,细胞外基质形态保持完好,三维结构未遭破坏(见图4)。
2.2 细胞外基质成分含量检测
2.2.1 氨基聚糖的检测两两比较
对组织中GAG 含量的检测结果显示:正常组织的含量(79.88 ±3.48)μg/g,去细胞化支架组织的含量为(71.06 ±1.92)μg/g。与正常组织比较,P <0.05,在去细胞化后,GAG 有一定的损失(见图5)。
2.2.2 总胶原蛋白含量检测
通过检测羟脯氨酸的含量,估算出总胶原蛋白含量为:正常组织(83.76 ± 6.37)μg/g,去细胞支架(87.45 ±4.46)μg/g。两组数据比较,P >0.05,说明去细胞化过程未对总胶原蛋白含量有影响(见图6)。
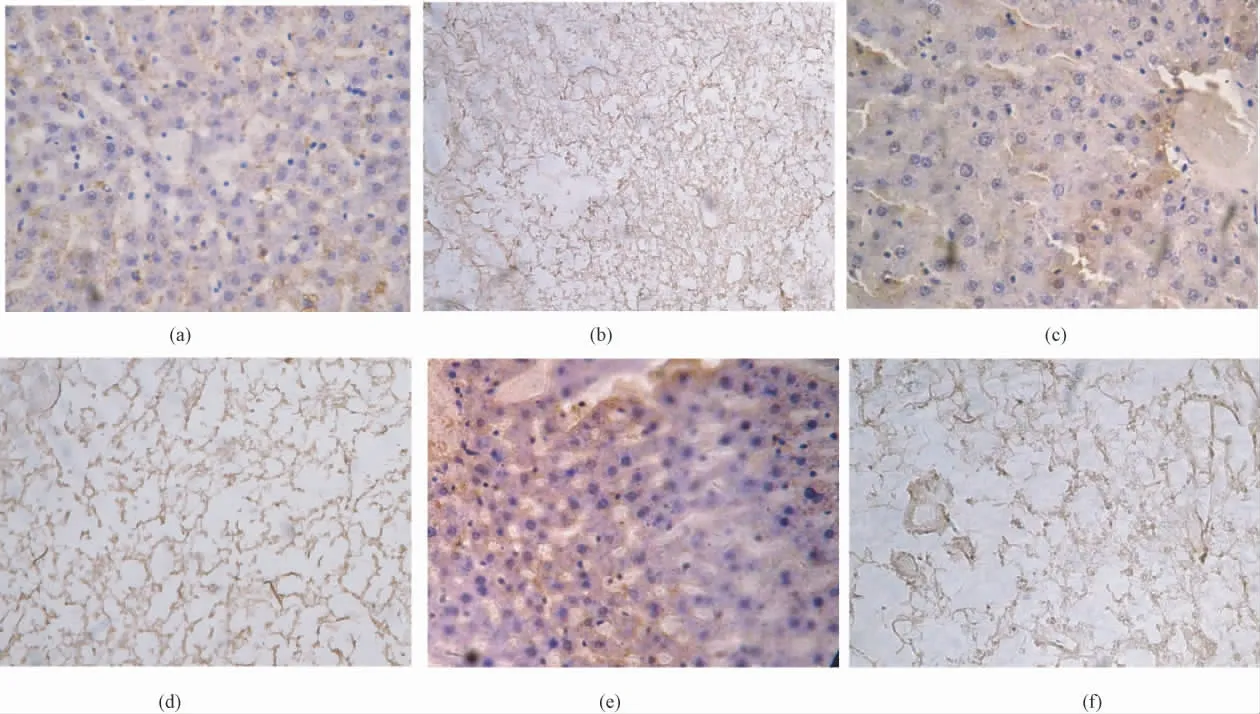
图3 免疫组化结果(400 ×)。(a)正常肝脏组织I 型胶原蛋白;(b)去细胞化支架I 型胶原蛋白;(c)正常肝脏组织层粘连蛋白;(d)去细胞化支架层粘连蛋白;(e)正常肝脏组织纤粘连蛋白;(f)去细胞化支架纤粘连蛋白Fig. 3 The results of immunohistochemistry. (400 × )(a)Collagen I of normal liver;(b)Collagen I of decellularized liver;(c)Laminin of normal liver;(d)Laminin of decellularized liver;(e)Fibronectin of normal liver;(f)Fibronectin of decellularized liver
2.2.3 细胞因子HGF 及VEGF 含量的检测
ELISA 法检测结果为:正常组织含HGF (44.46±4.64)ng/g,VEGF (34.78 ±3.23)ng/g;去细胞化支架含HGF (19.68 ±1.49)ng/g,VEGF (13.44 ±1.94)ng/g。P <0.05,去细胞化支架内仍保留有一定量的细胞因子HGF 和VEGF(见图7)。
2.3 细胞组分残留检测
2.3.1 DNA 残留量检测
各组DNA 含量分别为A 组(新型去细胞化流程组):(0.66 ±0.15)μg/g;B 组(文献[7]法组):(0.90 ±0.21)μg/g;C 组(正常组织组):(17.73 ±2.20)μg/g。与正常肝脏组织C 组比较,P <0.05,差别具有统计学意义,说明A、B 两组去细胞方法均能达到目前公认对去细胞支架DNA 含量的要求。A、B 两组间比较,P >0.05,差别不具备统计学意义,可见A、B 两组去细胞化过程中对DNA 的去除效果相当(见图8)。
2.3.2 GAPDH、MHC-I 及HMGB1 蛋白残留量的检测
Quantity One 软件分析灰度值后各蛋白残留量如图9 所示,与C 组比较,P <0.05,A、B 两组中GAPDH、MCH-I、HMGB-1 的残留量都有所下降。同样,A、B 两组比较,P <0.05,表明相较B 组的去细胞流程,A 组能更完全的去除残留的细胞组分。
2.4 三维培养系统结合培养WBF -344 细胞
WBF-344 卵圆细胞注入培养系统后的第3 d 及第7 d,H&E 染色和白蛋白免疫荧光显示(见图10)细胞生长状况良好,能较好的贴附于支架上,白蛋白表达量随着诱导培养时间的延长而提高。
3 讨论和结论
近些年来,随着国内外对于使用酶学法、物理法、化学试剂、渗透压法等不同去细胞方法处理不同组织过程的深入研究,证明了不同的去细胞化方法,以不同的流程组合处理同样的组织其效果不尽相同。学界公认以DNA 残留量为去细胞化是否成功的最低要求,一般支架内DNA 含量应小于5 μg/g的上限,并且H&E 染色观察无明显DNA 成分残留,才能称为完成去细胞化[11]。

图4 扫描电镜(1200 ×)。(a)正常肝脏组织;(b)去细胞化支架Fig. 4 The results of scanning electron microscope(1200 × ). (a)Normal liver;(b)Decellularized liver
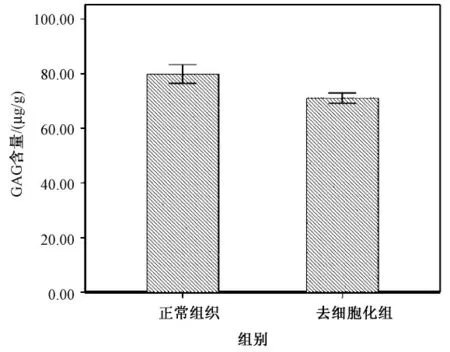
图5 GAG 含量Fig.5 GAG content
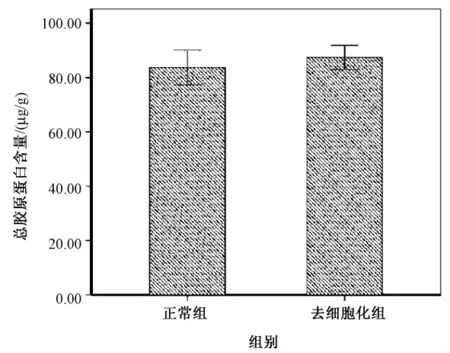
图6 总胶原含量Fig.6 Total collagen content
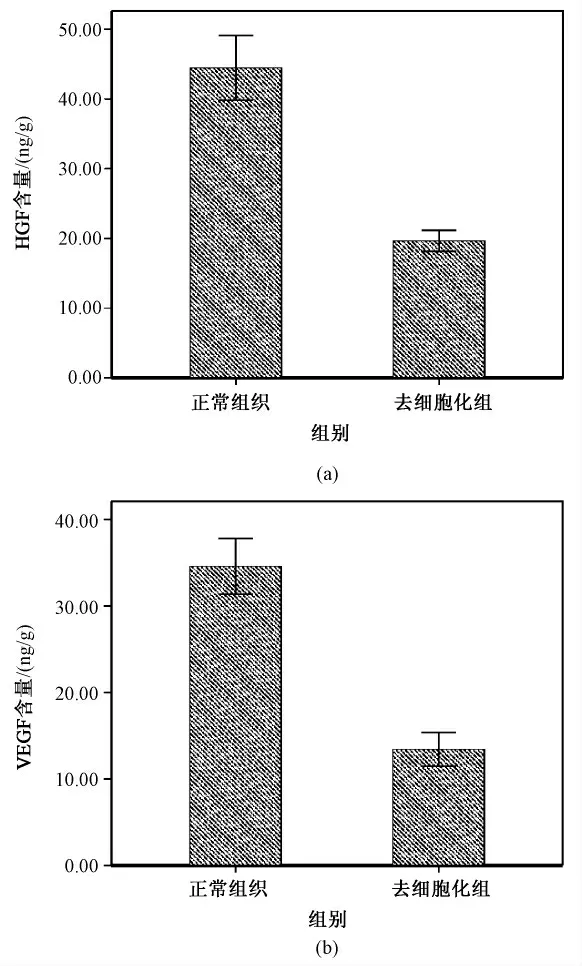
图7 ELISA 结果。(a)HGF 含量;(b)VEGF 含量Fig. 7 ELISA results. (a)HGF content;(b)VEGF content
肝脏作为一个体积较厚、含有大量细胞成分的复杂器官,其去细胞化一直是研究热点。Uygun 等最早应用不同浓度梯度的SDS 经血管灌洗,成功去除了肝脏细胞获得了大鼠全肝脏支架,并进行了原代肝脏细胞回填培养,但去细胞化用时较长,达5 d,且SDS 做为一种离子型去污剂有着较好的去细胞化效果的同时,对ECM 结构的破坏也相当大,其中GAG 的丢失达50%以上[12]。国内胡鹏蕴等也同样进行了以不同浓度SDS 处理为主的去细胞化支架制作,但未对支架做完善的评价[13]。此后Soto-Gutierrez 等提出了以浓度3%的TritonX-100 为主要方法的去细胞流程,结果表明TritonX-100 作为一种较温和的非离子型去污剂在达到与SDS 相近的去细胞效果同时,也相应的减少了对ECM 的破坏,通过酶学、渗透压等多种方法的合理结合,时间上更是大大缩短至3 d[14],Baptista 等在以tritonX-100 为主的肝脏去细胞化处理后,其支架所含GAG 相比正常组几乎没有损失[15]。深入研究证明,对于去细胞化残留物的评价上,单一的DNA 残留量还是不够的。Böer 等研究了规范化流程对马颈动脉的去细胞化过程,在DNA 残留量达到标准后,仍有大量的细胞残留成分,如细胞质、细胞膜、细胞器碎片等[8]。另外Keane 等对目前很多常见的临床去细胞化支架产品的研究表明,很多产品由于未去除残留细胞组分而导致严重的巨噬细胞吞噬反应[10]。因此,一个完善的去细胞化效果评价是此类技术能否成功应用于临床实践的关键。
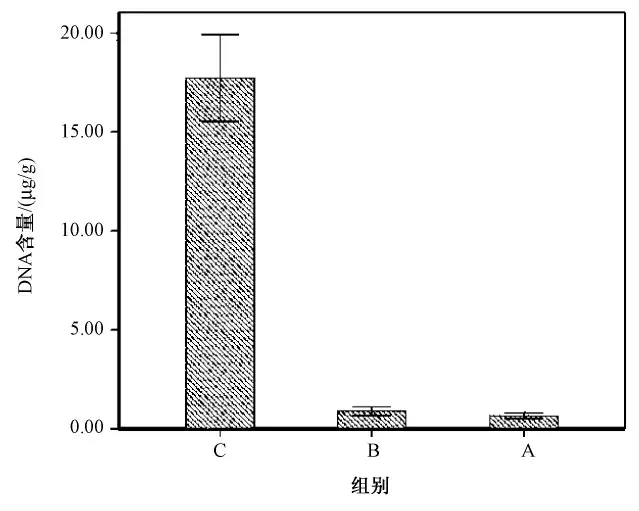
图8 DNA 含量Fig.8 DNA content
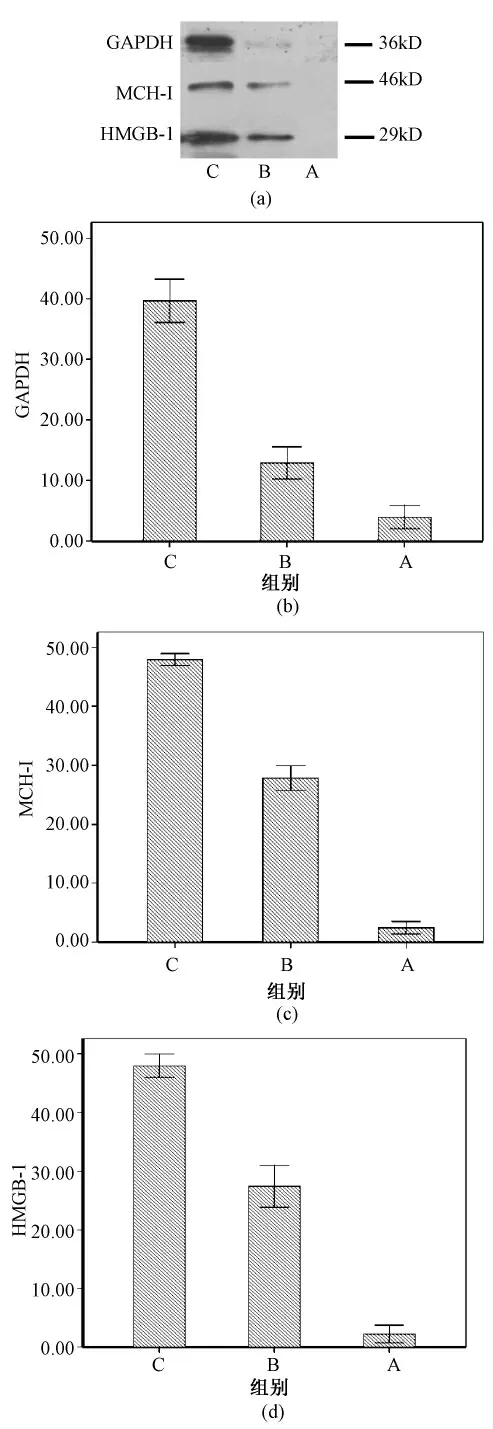
图9 细胞组分残留量。(a)WB 条带;(b)GAPDH含量;(c)MCH-I 含量;(d)HMGB-1 含量Fig.9 The residual content of cell components. (a)WB band pattern;(b)GAPDH content;(c)MCH-I content;(d)HMGB-1 content
本研究在去细胞化流程设计上,通过结合与改进Uygun 等及Soto-Gutierrez 等两种不同的大鼠全肝脏去细胞化流程,以温和的非离子型去污剂TritonX-100 为主要方法,减少对ECM 的破坏。在去细胞过程前期加入蛋白酶抑制剂PMSF,减少蛋白的降解;在后期辅助以去细胞能力较强的离子型去污剂SDS,以求能完全去除细胞残留成分。SDS 的浓度控制在0.1%,既能较好的发挥其解离洗脱蛋白的作用,也不会对ECM 造成严重破坏。评价体系上我们从细胞外基质组分和供体细胞组分残留两个角度入手,结果显示:与正常组织比较,新型去细胞化流程制作出来的支架内满足DNA 残留量的要求,保留了血管网等三维支架组织,胶原蛋白、层粘连蛋白、纤粘连蛋白等ECM 主要成分在支架内丰富存在,它们与部分保存住了的细胞因子HGF 和VEGF 一起能更好的模拟体内细胞生长环境,有利于细胞的生长和干细胞的分化。结果中还发现,Soto-Gutierrez 等的流程在达到DNA 残留量的标准的同时,仍有部分细胞组分如GAPDH、HMGB-1、MCH-I 残留。GAPDH 作为细胞内部恒量表达的蛋白,其残留量对细胞骨架蛋白总残留有着很好的代表性。HMGB -1 作为细胞生长的毒性物质,其存在对细胞生长有着很大的影响[16]。而MCH-I 作为免疫排斥反应的主要激动蛋白,为了满足移植的需求,同样不应在支架内残留。本研究开发出的新型去细胞化流程虽然可能在加入SDS 后导致GAG 含量上减少了20%左右,但几乎完全消除了以上供体细胞残留的蛋白,在保护基质与去除细胞残留物的矛盾中寻找到了平衡点,评价体系较之此前的工作更加完善与科学。
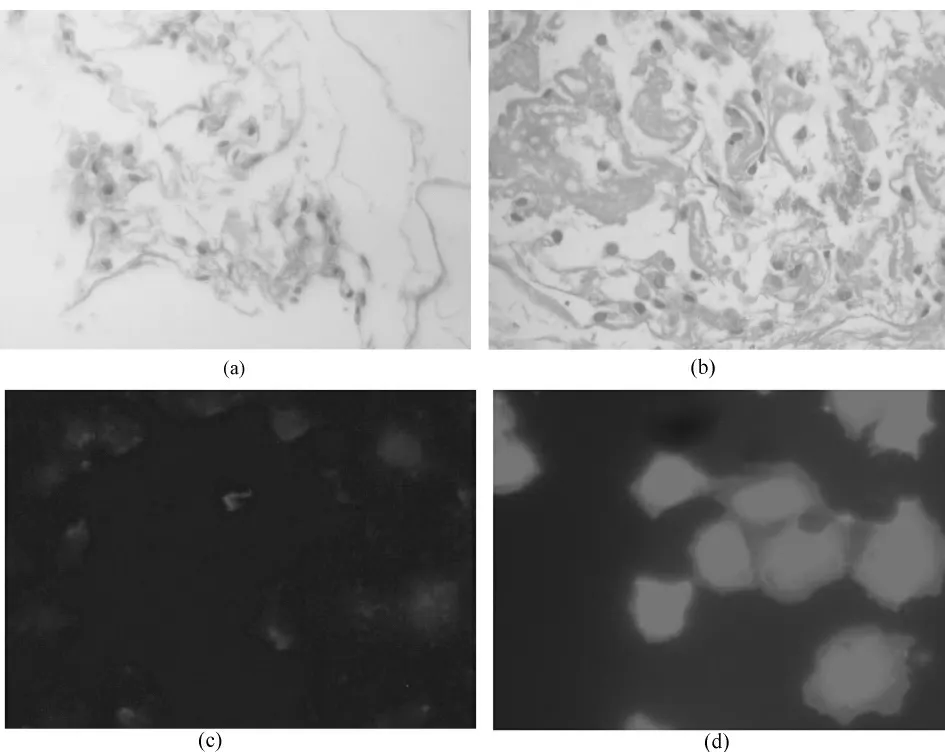
图10 WBF-344 细胞诱导培养结果。(a)和(b):培养第3 d 和第7 d 细胞H&E 染色(400 ×);(c)和(d):培养第3 d 和第7 d 细胞白蛋白免疫荧光检测(800 ×)Fig.10 WBF-344 cells induced culture results.(a)&(b):H&E staining in day 3 and day 7(400 ×);(c)&(d):The immunofluorescence of albumin in day 3 and day 7(800 ×)
此外,本研究中设计的三维循环培养系统的特点是生物反应器与去细胞支架结合,提出“双腔”培养概念。内腔容积小,用于盛放支架及制造灌流循环;外腔容积大,用于氧合、酸碱度维持及养分供给。此概念将传统意义上的储液池和生物反应器结合在一起,以内腔壁上的细胞筛网口相通,防止内腔游离的细胞流向外腔,从而提高了内腔循环的细胞密度,利于细胞尽快贴附于支架上支架内。诱导培养WBF -344 卵圆细胞的结果,在进一步证明本研究中去细胞化流程制作出来的支架功能良好的同时,也说明了在体外通过类似体内环境的三维ECM 培养系统对干细胞进行分化扩增、大量获得功能良好的肝细胞是可能的。
总之,外科手术移植目前仍是治疗终末期肝病比如门脉高压性肝硬化等的最常用手段,但肝源缺乏和免疫排斥反应仍然是制约肝移植发展的主要因素。通过对供体器官进行去细胞化而得到的天然ECM 支架,以患者自体干细胞为种子细胞进行重填培养并使之分化为目的细胞的技术,可以作为肝移植之外治疗终末期肝病的新选择之一,有着广阔的应用前景。整个系统可与人工肝脏的概念结合,用于等待肝脏或者肝细胞移植患者的全身白蛋白的增加及替代病肝的解毒作用缓解门静脉压力等,并可培养患者用于自体移植的肝脏细胞。最终随着其他相关技术的发展,于体外形成新的器官,移植回病人体内,以此来替代异体器官移植达到最终治疗的目的。
[1] Vorotnikova E,McIntosh D,Dewilde A,et al. Extracellular matrix-derived products modulate endothelial and progenitor cell migration and proliferation in vitro and stimulate regenerative healing in vivo[J]. Matrix Biology,2010,29(8):690 -700.
[2] Chen RN,Ho HO,Tsai YT,et al. Process development of an acellular dermal matrix (ADM)for biomedical applications[J].Biomaterials,2004,25(13):2679 -2686.
[3] Bolland F,Korossis S,Wilshaw SP,et al. Development and characterisation of a full-thickness acellular porcine bladder matrix for tissue engineering[J]. Biomaterials,2007,28(6):1061 -1070.
[4] Bader A,Schilling T,Teebken OE,et al. Tissue engineering of heart valves-human endothelial cell seeding of detergent acellularized porcine valves[J]. Eur J Cardiothorac Surg,1998,14(3):279 -284.
[5] Petersen TH,Calle EA,Zhao L,et al. Tissue-Engineered Lungs for in vivo Implantation[J]. Science,2010,329(5991):538-541.
[6] Ott HC,Matthiesen TS,Goh SK,et al. Perfusion-decellularized matrix:using nature's platform to engineer a bioartificial heart[J]. Nat Med,2008,14(2):213 -221.
[7] Badylak SF,Weiss DJ,Caplan A,et al. Engineered whole organs and complex tissues [J]. The Lancet,2012,379(9819):943 -952.
[8] B öer U,Lohrenz A,Klingenberg M,et al. The effect of detergent-based decellularization procedures on cellular proteins and immunogenicity in equine carotid artery grafts [J].Biomaterials,2011,32(36):9730 -9737.
[9] Daly KA,Liu S,Agrawal V,et al. The host response to endotoxin-contaminated dermal matrix [J]. Tissue Engineering Part A,2012,18(11 -12):1293 -1303.
[10] Keane TJ,Londono R,Turner NJ,et al. Consequences of ineffective decellularization of biologic scaffolds on the host response[J]. Biomaterials,2012,33(6):1771 -1781.
[11] Crapo PM,Gilbert TW,Badylak SF. An overview of tissue and whole organ decellularization processes[J]. Biomaterials,2011,32(12):3233 -3243.
[12] Uygun BE, Soto-Gutierrez A, Yagi H, et al. Organ reengineering through development of a transplantable recellularized liver graft using decellularized liver matrix [J].Nature Medicine,2010,16(7):814 -820.
[13] 胡鹏蕴,程远,汪艳,等. 去细胞化全肝生物支架循环灌注培养条件下体外细胞再植[J]. 中国组织工程研究,2012,16(18):3231 -3235.
[14] Soto-Gutierrez A,Zhang L,Medberry C,et al. A whole-organ regenerative medicine approach for liver replacement[J]. Tissue Engineering Part C:Methods,2011,17(6):677 -686.
[15] Baptista PM,Siddiqui MM,Lozier G,et al. The use of whole organ decellularization for the generation of a vascularized liver organoid[J]. Hepatology,2011,53(2):604 -617.
[16] Daly KA,Liu S,Agrawal V,et al. Damage associated molecular patterns within xenogeneic biologic scaffolds and their effects on host remodeling[J]. Biomaterials,2012,33(1):91 -101.

