Notch1miRNA干扰质粒构建及功能鉴定*
周学亮,万 力,刘季春
(南昌大学第一附属医院心脏外科,江西南昌330006)
Notch信号通路于90年前经摩根首次发现,其特点为该通路的受体Notch活性受糖基化、胞内运输差异和泛素化降解调控,而不依赖于第二信使的放大[1]。在多种生物的心脏发育期,Notch信号参与了心肌细胞分化、房室沟分界、瓣膜发育、流出道重塑、心室小梁形成等诸多过程[2-4];心脏发育成熟后,Notch的作用可控制心血管系统对缺血缺氧损伤的反应,抑制心肌细胞纤维化,增强受损后心肌细胞活力[5-7]。本研究拟采用微小干扰核糖核酸(miRNA)技术,通过设计针对大鼠Notch1基因干扰序列,构建能在真核细胞中表达miRNA序列的载体,并转染H9c2心肌细胞,筛选干扰大鼠Notch1基因最佳的miRNA,为进一步观察Notch信号通路在心肌细胞的作用奠定实验基础。
1 材料与方法
1.1 材料
1.1.1 细胞及菌株 H9c2心肌样细胞购自中科院上海生命科学院细胞库,Top10化学感受态细胞购自Invitrogen公司。
1.1.2 干扰质粒 BLOCK-iTTMPolⅡ miR RNAi Expres-sion Vector Kits购自Invitrogen公司。
1.1.3 主要试剂 T4DNA Ligase购自TaKaRa公司,质粒小提试剂盒购自OMEGA公司,LipofectamineTM2000购自Invitrogen公司,RIPA裂解液、BCA蛋白浓度测定试剂盒购自碧云天生物技术研究所,兔Cleaved Notch1单克隆抗体购自abcam公司,小鼠甘油醛-3-磷酸脱氢酶(GAPDH)单克隆抗体、辣根过氧化物酶标记山羊抗兔、山羊抗小鼠IgG均购自北京中杉金桥公司,化学发光试剂盒(SuperSignal West Pico Chemiluminescent Substrate)购自美国Pierce公司。
1.2 方法
1.2.1 干扰片段设计与合成 针对GeneBank中的大鼠Notchl基因编码序列(NCBI Reference Sequence:NM_001105721.1),在Invitrogen网站分别在线设计3对pre-miRNA序列(表1),交Invitrogen公司合成,规格为2OD。
1.2.2 靶向Notch1miRNA干扰质粒的构建 将3对Oligonucleotide各自用TE Buffer溶解成200μmol/L,互补单链经退火形成双链,反应体系:200μmol/L Top Strand Oligonucle-otide 5μL,200μmol/L Bottom Strand Oligonucleotide 5μL,10×Oligo Annialing Buffer 2μL,dddH2O 8μL;退火条件:95℃,1min→85 ℃,1min→75 ℃,1min→65 ℃,1min→55℃,1min→45℃,1min→35℃,1min→25℃,1min→25℃,10min;形成的double strand Oligonucleotide分别用dddH2O稀释到100μmol/L。然后用载体构建试剂盒BLOCK-iTTMPolⅡmiR RNAi Expression Vector Kits进行重组克隆,将双链的miRNA Oligo利用T4DNA Ligase各自连接到miRNA表达载体pcDNATM6.2-GW/EmGFP-miR Vector中,以构建Notch1miRNA质粒。

表1 Notch1- 寡核苷酸序列
1.2.3 干扰质粒转化与测序分析 将3组连接产物转化Top10化学感受态细胞,接种于Spe+(大观霉素)的Luria-Bertani(LB)培养基平板,次日随机挑选阳性单克隆菌落,于Spe+LB液态琼脂培养基摇菌过夜,隔日小提质粒,送北京诺赛基因组研究中心有限公司基因测序,序列无误后分别命名为miRNA1281、miRNA4072、miRNA6637。
1.2.4 细胞培养及转染 Dulbecco′s Modified Eagle′s Medium(DMEM)+10%Fetal bovine serum(FBS)培养 H9c2心肌样细胞,铺12孔板,细胞生长至90%融合度时,按LipofectamineTM2000方法,分4组进行转染:Mock组(无效对照miRNA干扰质粒转染)、miRNA1281组(转染miRNA1281)、miRNA4072组 (转 染 miRNA4072)、miRNA6637 组 (转 染miRNA6637)。
1.2.5 靶向Notch1miRNA干扰质粒的筛选 4组H9c2心肌样细胞转染48h后,分别加90μL RIPA裂解细胞,4℃、12 000g离心提取总蛋白,二喹啉甲酸(bicinchoninic acid,BCA)测定蛋白水平。加等量十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)蛋白上样缓冲液(2×),沸水煮10min各上样30μg,行8%SDS-PAGE蛋白电泳,湿转法将蛋白质转移至硝酸纤维素膜上,5%脱脂奶粉封闭后,分别用稀释的一抗[Cleaved Notch1(1∶500)、GAPDH(1∶200)]4℃孵育过夜,次日辣根过氧化物酶标记山羊抗兔IgG(1∶5 000)、山羊抗小鼠IgG(1∶5 000)常温孵育1h,结束后采用增强化学发光法曝光,检测Notch1胞内结构域(N1ICD)的表达。
2 结 果
2.1 靶向Notch1miRNA干扰质粒成功构建 将双链的miRNA Oligo与pcDNATM6.2-GW/EmGFP-miR Vector各自连接后,转化Top10化学感受态细胞,小提质粒,送北京诺赛基因组研究中心有限公司基因测序,序列无误,见图1。
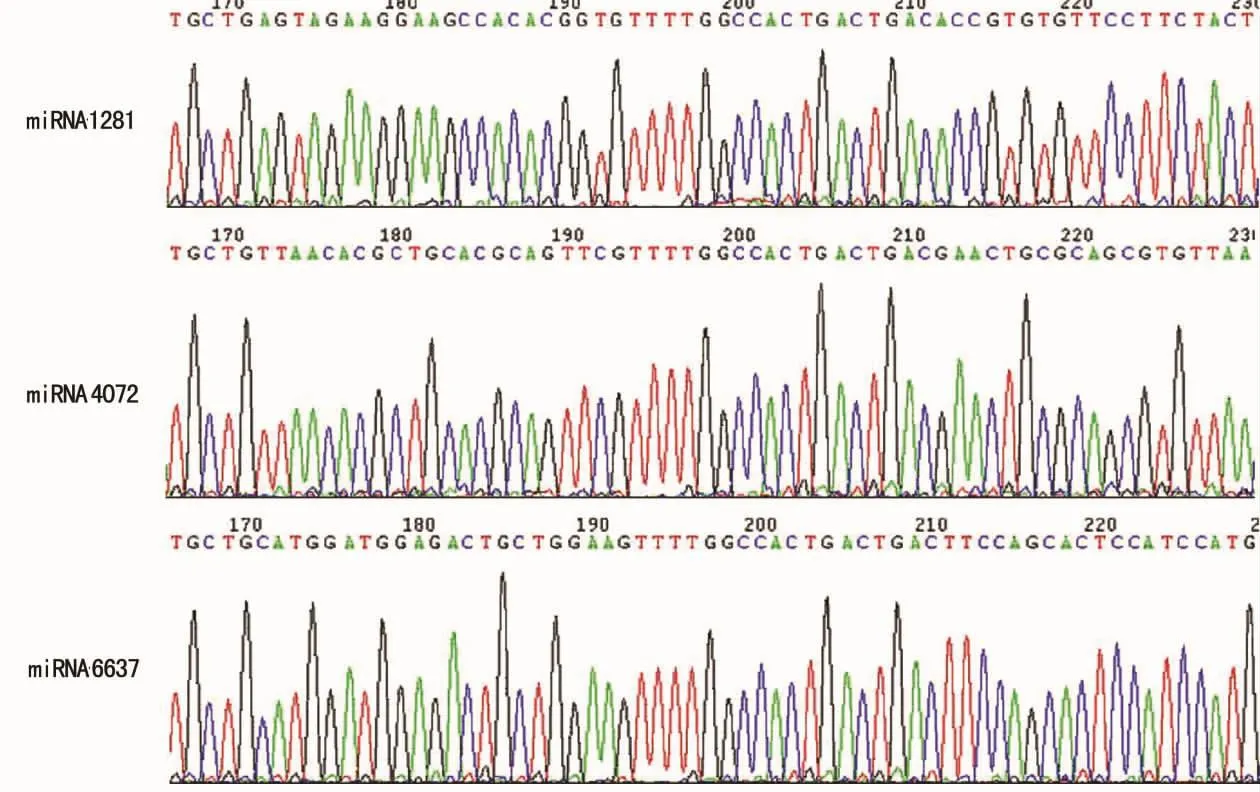
图1 靶向Notch1miRNA干扰质粒基因测序图
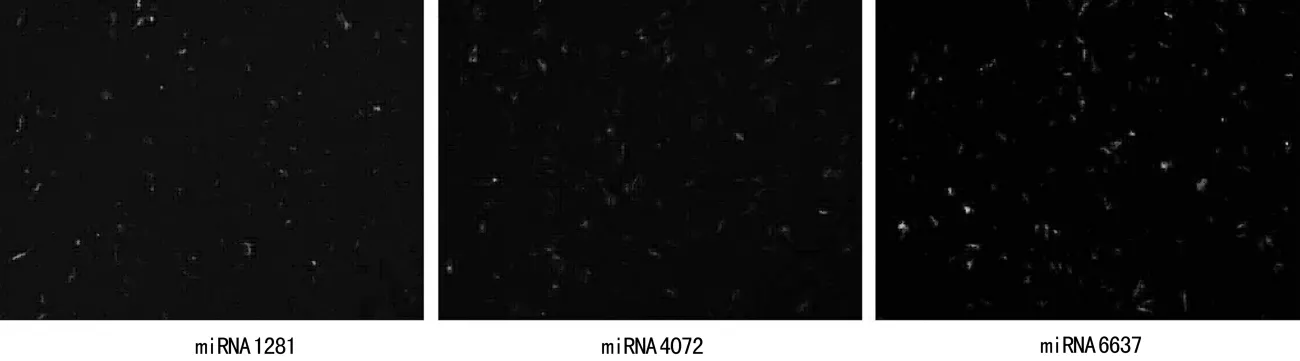
图2 荧光显微镜观察H9c2心肌样细胞Notch1miRNA的转染效率
2.2 靶向Notch1miRNA干扰质粒顺利筛选 利用LipofectamineTM2000将构建成功的miRNA1281、miRNA4072、miRNA6637干扰质粒转染H9c2心肌样细胞,荧光显微镜观察转染效率(图2),48h后提总蛋白,Western blot显示N1ICD在 Mock组、miRNA1281组、miRNA4072组、miRNA6637组表达逐渐降低,以miRNA6637组表达最低,约为Mock组的90%,说明3组miRNA均可靶向干扰Notch1基因,以miRNA6637效果最佳,根据沉默效果筛选理想的Notch1miRNA:Western blot检测H9c2心肌样细胞miRNA转染后N1ICD的表达(图3);各组N1ICD灰度值比较见图4。
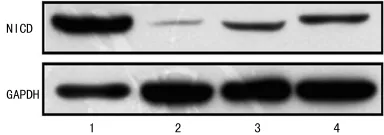
图3 H9c2心肌样细胞miRNA转染后N1ICD的表达
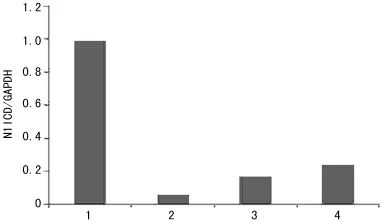
图4 各组N1ICD灰度值比较
3 讨 论
深入研究发现miRNA是一类存在于生物体内,长度约19~25个核苷酸的非编码小RNA,通过与mRNA的互补配对,使mRNA发生降解或翻译受抑,负性调控靶基因的表达[8-9]。在哺乳动物中,大约50%的蛋白受miRNA调控,研究显示miRNA几乎参与了迄今为止所有细胞之间的调控,在细胞发育、分化、凋亡、增殖中发挥重要作用,其表达的改变与人类多种疾病着密切相关[10]。目前研究表明miRNA对靶基因的干扰效果是小干扰RNA(siRNA)的10倍[11]。因此,采用miRNA干扰技术将会有更理想的干扰效应。本研究通过设计合成 miRNA,成功转入pcDNATM6.2-GW/EmGFP-miR Vector中,基因测序无误后,脂质体法瞬时转染H9c2心肌样细胞,荧光显微镜观察到各组miRNA转染效率约为80%左右,通过Western blot检验3组miRNA转染后N1ICD的表达差异,结果显示3组N1ICD表达均降低,以miRNA6637组最为明显,约为Mock组的90%,可见miRNA6637对Notch1的干扰效果最佳。
Notch配体在果蝇内为Serrate家族,在哺乳动物为Jagged/Delta家族,与配体结合后,Notch受体获得活性发生构象改变,经 TNF-α转化酶(TNF-αconverting enzyme,TACE)、γsecretase的二次裂解,形成NICD进入细胞核,与重组信号的免疫球蛋白结合蛋白Jκ(Recombination signal binding protein for immunoglobulin Jκ,RBP-Jκ)结合,启动多毛和分裂增强子1(Hairy and enhancer of split 1,Hes1)、多毛相关转录因子(Hairy-related transcription,HRT)等靶基因的转录[12]。有研究发现Notch1信号通路可刺激缺血心肌细胞增生,产生良好的心肌保护效应[13]。国内文献报道,应用Notch信号通路阻断剂-3,5-二氟苯乙酰-L-丙氨酰-S苯基甘氨酸t-丁酯(DAPT)能抑制原代乳鼠心肌细胞增殖,促使心肌细胞发生凋亡[14]。最新研究发现,Notch1信号通路的激活可加快心肌梗死后期心功能的恢复,对于缺血性心脏病的治疗具有积极的临床意义[15]。本研究成功构建并顺利筛选靶向Notch1miRNA的有效干扰质粒,为Notch信号通路对缺血心肌细胞保护作用的机制研究奠定了实验基础。
[1]Tien AC,Rajan A,Bellen HJ.A notch updated[J].J Cell Biol,2009,184(5):621-629.
[2]Niessen K,Karsan A.Notch signaling in cardiac development[J].Circ Res,2008,102(10):1169-1181.
[3]Niessen K,Karsan A.Notch signaling in the developing cardiovascular system[J].Am J Physiol Cell Physiol,2007,293(1):C1-11.
[4]Nemir M,Pedrazzini T.Functional role of Notch signaling in the developing and postnatal heart[J].J Mol Cell Cardiol,2008,45(4):495-504.
[5]Al Haj Zen A,Madeddu P.Notch signalling in ischaemiainduced angiogenesis[J].Biochem Soc Trans,2009,37(Pt 6):1221-1227.
[6]Croquelois A,Domenighetti AA,Nemir M,et al.Control of the adaptive response of the heart to stress via the Notch1receptor pathway[J].J Exp Med,2008,205(13):3173-3185.
[7]Urbanek K,Cabral-da-Silva MC,Ide-Iwata N,et al.Inhibition of notch1-dependent cardiomyogenesis leads to a dilated myopathy in the neonatal heart[J].Circ Res,2010,107(3):429-441.
[8]Bartel DP.MicroRNAs:target recognition and regulatory functions[J].Cell,2009,136(2):215-233.
[9]Carthew RW,Sontheimer EJ.Origins and mechanisms of miRNAs and siRNAs[J].Cell,2009,136(4):642-655.
[10]Krol J,Loedige I,Filipowicz W.The widespread regulation of microRNA biogenesis,function and decay[J].Nat Rev Genet,2010,11(9):597-610.
[11]Gregory RI,Chendrimada TP,Cooch N,et al.Human RISC couples microRNA biogenesis and posttranscriptional gene silencing[J].Cell,2005,123(4):631-640.
[12]Wang MM.Notch signaling and Notch signaling modifi-ers[J].Int J Biochem Cell Biol,2011,43(11):1550-1562.
[13]Gude NA,Emmanuel G,Wu W,et al.Activation of notchmediated protective signaling in the myocardium[J].Circ Res,2008,102(9):1025-1035.
[14]杨阳,段维勋,周京军,等.γ-分泌酶抑制剂对正常乳鼠心肌细胞的影响[J].中国体外循环杂志,2011,9(2):89-92.
[15]Li Y,Hiroi Y,Ngoy S,et al.Notch1in bone marrow-derived cells mediates cardiac repair after myocardial infarction[J].Circulation,2011,123(8):866-876.

