DUSP9真核表达载体的构建及其在Hepa1-6肝细胞中的表达*
杨 艳,向加林,欧阳旭红△,尹 玲,于国辉
(1.遵义医学院附属医院医学检验科,贵州遵义563000;2.遵义医学院医学检验系2006级本科,贵州遵义563003)
DUSP9基因是近年研究发现具有双重专一性的磷酸酶家族(Dual specificity protein phosphtases,DUSPs)成员之一。DUSPs可逆转应激通路中丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)的活性,因此,也称作 MAPK磷酸 酶 家 族 (mitogen-activated protein kinase phosphatases,MKPs)。该家族属于酪氨酸蛋白磷酸酶超家族,可通过去磷酸化、钝化MAPK关键的酪氨酸和苏氨酸残基,调控MAPK的功能[1-2]。其家族成员因对MAPKs家族表现出独特的底物特异性,故分为DUSP1(又名 MKP1)、DUSP4(又名 MKP2)、DUSP6(又名 MKP3)、DUSP9(又名 MKP4)、DUSP10(又名MKP5)。研究发现,人源与小鼠DUSP9同源性为83%,在胎盘、肝、肾脏中高表达,且在发育进程中是可调型表达[3-4],对胰岛素作用存在争议[2,5],但其在胰岛素抵抗进程中的作用机制及分子靶点尚未清楚。本研究通过构建DUSP9真核表达载体,并在小鼠Hepa1-6肝细胞中过表达DUSP9,为进一步研究DUSP9生理功能及其在糖脂代谢、胰岛素抵抗进程中的作用奠定坚实的基础。
1 材料与方法
1.1 材料 Hepa1-6肝细胞购自中科院上海细胞库;pEGFPN1载体购于GENECHEM公司;DH5α购于大连宝生物公司。主要试剂:DMEM高糖培养基、胎牛血清、Opti-MEM培养基购自GIBICO公司;LipofectamineTM2000购自Invitrogen公司;RNA提取试剂、DNA聚合酶PrimeSTARTMHS DNA Polymerase、dNTP Mixture、SYBR®Premix Ex TaqTMⅡ、Prime-ScriptTMRT reagent、引物、限制性内切酶、T4DNA ligase等购自TAKARA公司;去内毒素质粒小抽试剂盒、PCR产物纯化试剂盒、胶回收试剂盒均购自OMEGA公司;兔抗小鼠β-actin一抗、HRP标记的羊抗兔IgG二抗购自北京中杉金桥公司;兔抗鼠DUSP9购自Abnova公司。
1.2 方法
1.2.1 目的基因的获取及扩增 以健康C57小鼠肝组织总RNA为模板,进行逆转录反应,反应条件为:37℃15min,85℃5s,将得到的cDNA溶液应用于PCR扩增。根据pubmed-GenBank中NM_029352DUSP9mRNA序列,扩增小鼠DUSP9基因全编码区cDNA片段,所用引物即上游:5′-CCG GAA TTC TAT GGA GAG TCT GAG TCG G-3′(含ECORI酶切位点);下游:5′-CGG GTA CCG GTA GTG TGG GGT CCA GCT CAA AG-3′(含 AgeI酶切位点),PCR扩增反应条件:98℃预变性4min;98℃变性12s,64℃退火17s,72℃延伸1min,共35个循环;72℃加长延伸6min,并纯化PCR产物。
1.2.2 重组真核表达载体的构建 分别用ECORI和AgeI双酶切pEGFP-N1载体及目的基因片段并胶回收,T4DNA ligase 16℃连接过夜,第2天取10uL连接产物转化感受态细胞DH5α并将其涂布于含kanr的LB选择性平板进行筛选,挑取阳性单克隆,置于含kanr的LB液体培养基中,37℃振摇培养过夜,质粒抽提,双酶切鉴定并送大连宝生物公司测序。
1.2.3 Hepa1-6肝细胞的培养及转染 (1)细胞培养:将 Hepa1-6肝细胞接种于6孔板,细胞密度确保第2天每孔能汇合80%,DMEM+10%FBS培养(无双抗),CO2细胞培养箱(5%CO2,37℃)孵育细胞。(2)细胞分组及转染:将 Hepa1-6肝细胞分为3组,即阴性对照组(仅加入相对应量的脂质体和PBS的细胞,negative control group,NC组)、空载组(转染空载体pEGFP-N1的细胞,blank control group,BC组)、转染组(转染pEGFP-DUSP9的细胞,transfection group,TG组),每组设平行实验复孔(3孔),重复实验2次。将质粒和脂质体按1∶2.5与Opti-MEM混合进行转染,转染方法按LipofectamineTM2000说明书。
1.2.4 DUSP9mRNA表达水平的检测 转染48h后,分别提取各组细胞总RNA,逆转录合成cDNA。采用SYBR GreenⅠ荧光染料实时定量PCR法检测DUSP9mRNA的表达。以β-actin基因作为内参,用2-△△CT值表示基因相对表达量。所用引物即 DUSP9上游:5′-GCT TCA GTG GTC GTG CC G-3′,DUSP9下游5′-GGA GGG GAT GTG GTG TTC-3′;小鼠β-actin上游引物:5′-GCT GTC CCT GTA TGC CTC T-3′,下游:5′-GAT GTC ACG CAC GAT TTC C-3′。
1.2.5 DUSP9蛋白表达水平的检测 采用 Western blot法检测各组细胞DUSP9蛋白表达水平。提取各组细胞总蛋白,按每泳道加80ug蛋白进行聚丙烯酰胺凝胶(SDS-PAGE)电泳,半干转至聚偏二氟乙烯膜(PVDF膜)(0.45μm),室温封闭3h,一抗(内参β-actin 1∶250,DUSP9 1∶200稀释)4℃孵育过夜,二抗(1∶5 000稀释)孵育1h并洗脱,将PVDF膜置于化学发光板,加入发光试剂,室温反应2min后置化学发光成像系统成像。
1.3 统计学处理 采用SPSS13.0软件进行统计学分析,数据以±s表示,组间数据比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 pEGFP-DUSP9重组真核表达质粒酶切、测序鉴定结果
pEGFP-DUSP9质粒经ECORⅠ、AgeⅠ双酶切,切出约4 700、1 359bp的片段,分别代表质粒pEGFP-N1和插入目的片段DUSP9,与预期结果完全一致,说明DUSP9基因已正确克隆到pEGFP-N1表达载体。测序结果(部分见图1)显示与目的基因序列(NM_029352)CDS区完全一致。
2.2 pEGFP-DUSP9转染的验证 倒置荧光显微镜下可见重组质粒转染Hepa1-6细胞发绿色荧光,见图2。
图1 重组质粒DNA测序结果部分彩图(红色划线部分表示克隆序列的起始位)

图2 Hepa1-6细胞培养及pEGFP-DUSP9转染图
2.3 DUSP9过表达的验证 RT-QPCR、Western blot检测结果显示,TG组肝细胞中,DUSP9mRNA表达量明显上调,是NC组61.82倍(ΔCt值:11.18±0.35 vs 17.13±0.22,P<0.01),其蛋白水平也呈高表达,NC、BC组中DUSP9蛋白表达较低,提示DUSP9质粒成功转染Hepa1-6肝细胞且高表达,见图3。
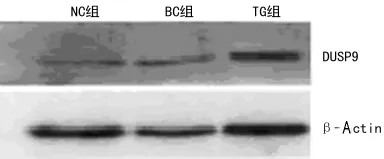
图3 Western blot检测各实验组Hepa1-6细胞中DUSP9的表达
3 讨 论
胰岛素抵抗(IR)是2型糖尿病(T2DM)发病的一个关键因素,其产生是遗传和环境因素共同作用的结果。近年来随着国内外对IR的深入研究,氧化应激学说、炎症病因学说、内质网应激学说相继提出且成为IR的研究热点,其相关信号通路的调节子等研究更为深入。
MAPK及应激活化蛋白激酶(stress-activated protein kinases,SAPK,)在IR发展进程中起着重要作用[6],二者的作用靶点之一为胰岛素传导关键分子-胰岛素受体底物1(insulin receptor substrate-1,IRS-1),均能使IRS-1丝氨酸残基磷酸化[7],降低IRS-1酪氨酸磷酸化水平,进而阻碍了它与胰岛素信号传导系统下游元件的相互作用[8],导致IR的发生。有趣的是MAPK及SAPK的激活是一个可逆的过程,阻断这些应激激酶可能阻止IR的发展。
DUSP9作为可逆转应激通路中MAPK活性的双重专一性磷酸酶家族成员,可钝化细胞外调节蛋白激酶(extracellularregulatedproteinkinases,ERK)及p38MAPK 的活性,但对SAPK的作用尚无定论,最新研究发现在恶性肾肿瘤透明细胞下调DUSP9的表达与疾病的预后不良有关联[9]。其在IR进程中的作用也尚未明确。有研究认为,在3T3-F442A脂肪细胞中过表达DUSP9,可封闭胰岛素诱导的脂质形成及糖摄取,负向调节胰岛素信号,可能促使了IR的发生[4]。然而,最新研究发现,在3T3-L1细胞中过表达DUSP9,抑制ERK及JNK/SAPK的磷酸化以及在较小程度上抑制了p38MAPK磷酸化[2]。茴香霉素诱导的IRS-1丝氨酸磷酸化被终止,IRS-1酪氨酸磷酸化的信号路径得以恢复,从而恢复了胰岛素的敏感性,并且能逆转肿瘤坏死因子-a(TNF-α)抑制的胰岛素信号。
此外,有研究发现在小鼠白色脂肪可检测到DUSP9的表达;肥胖小鼠体内DUSP9在胰岛素敏感组织特异性上调表达;3T3-F442A前脂肪细胞中DUSP9成低表达,在脂肪形成期表达上调[9],说明DUSP9可能参与了促成熟脂肪细胞形成,或与脂质形成相关。但其在代谢组学如对糖脂代谢、脂肪细胞因子的作用尚未见进一步研究报道。
因此,本实验欲通过克隆DUSP9真核表达载体,并在胰岛素敏感组织-肝细胞(Hepa1-6)中过表达DUSP9蛋白,为进一步探讨DUSP9对糖脂代谢、脂肪细胞因子可能的作用及机制奠定研究基础。本实验中,利用pEGFP-N1质粒(带绿色荧光蛋白的报告载体)、采取双酶切定向克隆的方式(避免自连和反向连接)构建DUSP9重组真核表达载体。pEGFP-N1包含增强型绿色荧光蛋白基因EGFP,使得其在哺乳动物细胞中有较高的表达及较强的荧光得到最佳化,并为可应用流式细胞筛选或其他方式对瞬时转染哺乳动物细胞表达EGFP及目的蛋白的有效率提供一个依据;含有高效的功能强大的启动子SV40和PCMV,可以使目的基因在增殖的细胞中稳定表达;结构上,该质粒具有很强的复制能力,可以满足随宿主细胞分裂时跟随细胞质遗传给新生的子细胞,这是保证目的基因稳定表达的因素之一;具有新霉素抗性(neo)基因,可以采用G418来筛选已成功转染了该载体的靶细胞。此外,采用含Kanr的LB选择性培养基筛选含Kanr转化子的质粒,并经双酶切初步鉴定克隆正确,最后经DNA测序分析确定所插入的目的基因片段的正确性。
本实验成功构建重组质粒pEGFP-DUSP9,并在Hepa1-6肝细胞中高效表达DUSP9蛋白,有望成为IR发生的分子生物学治疗靶点,同时也为T2DM的治疗提供新的思路。
[1]Teng CH,Huang WN,Meng TC.Several dual specificity phosphatases coordinate to control the magnitude and duration of JNK activation in signaling response to oxidative stress[J].J Biol Chem,2007,282(39):28395-28407.
[2]Emanuelli B,EberléD,Suzuki R,et al.Overexpression of the dual-specificity phosphatase MKP-4/DUSP-9protects against stress-induced insulin resistance[J].Proc Natl Acad Sci U S A,2008,105(9):3545-3550.
[3]Christie GR,Williams DJ,Macisaac F,et al.The dual-specificity protein phosphatase DUSP9/MKP-4is essential for placental function but is not required for normal embryonic development[J].Mol Cell Biol,2005,25(18):8323-8333.
[4]Dickinson RJ,Williams DJ,Slack DN,et al.Characterization of a murine gene encoding a developmentally regulated cytoplasmic dual-specificity mitogen-activated protein kinase phosphatase[J].J Biol Chem,2002,364(Pt 1):145-155.
[5]Xu H,Dembski M,Yang Q,et al.Dual specificity mitogen-activated protein(MAP)kinase phosphatase-4plays a potential role in insulin resistance[J].J Biol Chem,2003,278(32):30187-30192.
[6]Hirosumi J,Tuncman G,Chang L,et al.A central role for JNK in obesity and insulin resistance[J].Nature,2002,420(6913):333-336.
[7]Aguirre V,Uchida T,Yenush L,et al.The c-Jun NH(2)-terminal kinase promotes insulin resistance during association with insulin receptor substrate-1and phosphorylation of Ser(307)[J].J Biol Chem,2000,275(12):9047-9054.
[8]Aguirre V,Werner ED,Giraud J,et al.Phosphorylation of Ser307in insulin receptor substrate-1blocks interactions with the insulin receptor and inhibits insulin action[J].J Biol Chem,2002,277(2):1531-1537.
[9]Wu S,Wang Y,Sun L,et al.Decreased expression of dualspecificity phosphatase 9is associated with poor prognosis in clear cell renal cell carcinoma[J].BMC Cancer,2011,11(413):413.

