不同佐剂和激发方式对哮喘小鼠肺部炎性反应的影响
钟文清,谭建新
(广东医学院附属医院儿童医学中心,广东湛江524023)
支气管哮喘(简称哮喘)是一种常见的呼吸系统疾病,临床表现主要为喘息、气急、胸闷或咳嗽等,肺部病理改变一般为炎性反应细胞浸润和气道慢性炎性反应等。小鼠是最常用于构建哮喘模型的动物,国内外的学者所用的佐剂和激发方式各异。较常用的佐剂为氢氧化铝和十二水硫酸铝钾,激发方式常用的有雾化和滴鼻。建立稳定的哮喘模型是研究哮喘发病及其治疗的基础。本研究通过比较不同佐剂和激发方式对哮喘模型的影响,观察小鼠肺组织中气管和血管周围的炎性反应,进一步观察在停止雾化10d后肺部炎性反应的消退情况。
1 材料与方法
1.1 实验动物 38只无特定病原体(SPF)级小鼠购于广西医科大学实验动物中心,所有小鼠均为6~8周雌性。
1.2 主要试剂和材料 鸡卵清蛋白(OVA)、氢氧化铝,均购自美国Sigma公司;十二水硫酸铝钾购自上海阿拉丁公司;KYWH1004型雾化器(雾化颗粒小于5μm)由佛山凯亚医疗科技有限公司生产;红细胞裂解液由北京康为世纪公司生产;快速瑞氏染液由南京建成科技有限公司生产。
1.3 方法
1.3.1 致敏液与激发液配制 致敏液分3种:哮喘组每只小鼠注射200μL致敏液Ⅰ(100μg OVA和2mg十二水硫酸铝钾溶于200μL生理盐水)或致敏液Ⅱ(100μg OVA和2mg氢氧化铝溶于200μL生理盐水);对照组用生理盐水代替致敏液致敏。激发液分3种:1%OVA(1g OVA溶于100mL生理盐水中)、滴鼻液(100μg OVA溶于30μL生理盐水中)、生理盐水(对照组用生理盐水作为激发液)。
1.3.2 动物分组与激发方法 采用随机数表法将小鼠随机分成A~F 6组,除D组8只外其余每组6只,先取3组进行实验:分别为A组(对照作用,用生理盐水致敏,生理盐水雾化7 d)、B组(用致敏液Ⅱ致敏,1%OVA雾化7d)、C组(用致敏液Ⅰ致敏,1%OVA雾化7d);经实验发现十二水硫酸铝钾作佐剂致敏效果较好(结果见后),再取3组用致敏液Ⅰ致敏,以激发方法不同分别分为D组(用滴鼻液激发3d)、E组(用1%OVA雾化5d)、和F组(用1%OVA雾化7d,在末次雾化10 d后处死)。所有实验组均于第0、14天腹腔注射致敏,于第21天开始激发,雾化时间为每天30min。D组滴鼻激发前用1%戊巴比妥钠10mL/kg腹腔注射麻醉,然后将30μL滴鼻液缓慢交替滴入2个鼻孔。
1.3.3 支气管肺泡灌洗 于末次激发24h后(其中F组末次激发10d后)经戊巴比妥钠麻醉摘眼球放血处死,仰卧位固定,分离颈部皮肤和肌肉充分暴露气管,用血管夹夹闭左主支气管,用注射器经环状软骨做气管插管,0.5mL生理盐水对右肺进行灌洗3次后回收80%左右。肺泡灌洗液(BALF)于4℃500g离心10min,弃上清后用100μL生理盐水重悬,参照说明书裂解红细胞,沉淀再用100μL生理盐水重悬,用牛鲍计数板计白细胞总数。重悬液涂片后进行瑞氏染色,分类计数至少200个白细胞。
表1 不同佐剂及激发方式对BALF白细胞总数及分类计数(±s,%)

表1 不同佐剂及激发方式对BALF白细胞总数及分类计数(±s,%)
a:P<0.05,与 A组比较;b:P<0.05,与B组比较;c:P<0.05,与C组比较;d:P<0.05,与D组比较。
.26±3.01 B组 71.08±5.89a 40.02±2.75a 38.67±2.95a 8.37±1.93 12.94±2.62a C 组 360.83±30.69ab 46.33±7.01ab 35.27±4.03a 7.16±2.16 11.24±2.75a D 组 13.76±1.58ac 32.47±7.24abc 42.15±8.54ac 18.49±3.44abc 6.89±2.43ab E 组 316.83±28.25ad 45.28±6.89ad 25.15±6.62abcd 16.10±5.62 13.47±3.89 F组 13.71±2.08a 13.66±2.23abcd 51.72±3.36abcd 11.93±4.26 22.69±4.02 E M N L A 组 8.75±1.13 2.50±1.96 70.35±5.41 6.88±2.12 20组别 白细胞(×103)bcd
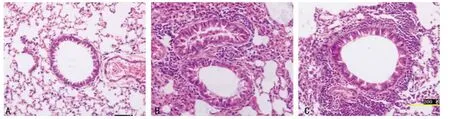
图1 各组肺组织炎性反应比较(HE×200)
1.4 肺组织苏木素-伊红(HE)染色 左肺用10%甲醛固定24h后经脱水和常规石蜡包埋,切片厚度为3μm,HE染色后镜下观察肺部炎性反应。
1.5 统计学处理 采用SPSS17.0对数据进行分析处理,所有数据以±s表示,组间比较采用ANOVA检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 激发时的表现 D组在滴鼻的过程中出现明显腹式呼吸,呼吸加深加快,有1只因为麻醉过深、滴鼻过快而死亡。除A组外,所有雾化激发哮喘小鼠在第3次雾化时均出现烦躁不安、抓鼻、大小便失禁。
2.2 BALF细胞计数 各组BALF的白细胞总数比较,见表1。C组炎性反应较B组严重(P<0.05)。与A组比较,D组白细胞轻度增高(P<0.05),B、C和 E组都显著增高(P<0.05)。C、E组与 D组比较,白细胞明显增多(P<0.05)。F组与C组比较,白细胞显著下降(P<0.05)。C组较E组白细胞多但差异无统计学意义(P=0.262)。对BALF的白细胞[包括嗜酸性粒细胞(E)、单核细胞(M)、中性粒细胞(N)和淋巴细胞(L)]进行计数和分类计数。在各组的嗜酸性粒细胞比较中:B组较C降低;与A组比较,其余各组均增高;B、C及E组均较D组增高;C组与E组无差别;F组比B、C、D及E组均明显降低,见表1。
2.3 各组肺组织炎性反应比较 气管和血管周围炎性反应比较,A组气管完整,气管周围未出现炎性反应细胞浸润的现象,肺部小动静脉周围无炎性反应细胞浸润,纹理清晰,见图1A。B组气管及血管周围炎性反应较明显,部分气管内有黏液栓形成,见图1B。C组气道周围炎性反应浸润,气管上皮细胞增厚部分脱落,杯状细胞增高,部分气道平滑肌细胞增厚,气管内有黏液栓形成,血管周围大量的炎性反应细胞浸润,见图1C,气管及血管周围炎性反应较B组重。D组局部气管出现严重的炎性反应、黏液栓形成,局部小血管周围出现大量的炎性反应细胞浸润。但仍有大部分气管及血管周围无炎性反应浸润;E组肺部炎性反应类似于C组。F组观察到气管周围炎性反应明显减轻,基本恢复正常;血管周围炎性反应细胞明显减轻但仍未恢复正常,仍能观察到少量炎性反应细胞浸润。
3 讨 论
过敏性哮喘是一种以嗜酸性粒细胞增高和气道高反应性为特点的气道炎性反应,并伴有多种细胞因子参与的过程。环境、种属、佐剂及激发方法对小鼠哮喘炎性反应均有影响[1],然而,不同激发方式对哮喘模型的影响较少报道[2]。虽然近年研究哮喘特别是难治性哮喘较多采用尘螨作为过敏原[3-5],但在研究哮喘的防治上更多的是用OVA作为过敏原[6-7],本研究亦采用OVA作为过敏原,先比较十二水硫酸铝钾和氢氧化铝佐剂对哮喘模型的影响,同样激发7d均能成功诱发哮喘,但无论从BALF中的白细胞和嗜酸性粒细胞计数,还是从肺组织中气道和血管周围炎性反应比较,以十二水硫酸铝钾为佐剂的炎性反应程度比氢氧化铝更严重,这可能与十二水硫酸铝钾佐剂的乳化效果更好有关[1]。
在研究急性哮喘模型中,急慢性模型的构建有不同的方法[8-10]。为了更好地观察肺部炎性反应表现,本实验采用5次和7次的雾化激发方式进行研究,同时也比较3次滴鼻激发的效果。对于哮喘组,在观察其激发过程的表现时发现有个别小鼠在第1次雾化时就出现抓鼻、烦躁不安和大小便失禁,第3次激发时普遍出现上述现象,这说明常用的3次雾化激发能建立较稳定的哮喘模型[11-12],激发5次和7次后能出现较明显的炎性反应表现,但两者的炎性反应表现无明显差别,7次雾化组的部分气道平滑肌细胞轻度增厚。平滑肌细胞的增生是气道重塑的重要组成部分[13-15],这说明连续激发7d后才开始出现气道重塑的病理改变,这也能解释为什么研究气道重塑应该选用慢性哮喘模型。滴鼻也能诱导哮喘的发生[2,16-17],虽然滴鼻的操作简单耗材也较少,但滴鼻激发受干扰的因素很多,主要与操作者的技术有关,麻醉得太深或滴得太快均会导致小鼠死亡,本实验有1只小鼠因此窒息死亡,观察发现在麻醉后接近苏醒的状态下滴鼻效果最好。滴鼻的过程中要不断翻动小鼠以达到OVA能均匀地进入肺部,但即使这样也不能均匀地进入肺部,肺部病理切片发现,局部的气道和血管炎性反应严重,但整个肺部炎性反应较轻,这可能与滴注OVA时局限于个别气道有关。与正常对照组比较,滴鼻组BALF中的嗜酸性粒细胞虽然明显增高,但总炎性反应细胞增高并不明显。与滴鼻比较,雾化组整体炎性反应明显,肺组织病理也能发现大部分气道和血管周围出现较明显的炎性反应细胞浸润,这有可能是引起BALF中炎性反应细胞明显增高的原因。
综上所述,建立哮喘模型与佐剂和激发方式密切相关。十二水硫酸铝钾能溶于水,乳化效果比氢氧化铝好,是较理想的佐剂。在研究肺部整体炎性反应时,传统的雾化激发方法较滴鼻好。采用5次雾化较3次滴鼻激发的方法能更有效地诱导哮喘的发生。
[1]李睿,刘恩梅,杨锡强,等.不同饲养环境、种属、佐剂及激发方法对小鼠哮喘炎症的影响[J].重庆医学,2006,35(1):43-44.
[2]沈璐,赖克方,姜华,等.不同激发方式对小鼠过敏性支气管哮喘模型的影响[J/CD].中华哮喘杂志:电子版,2009,3(6).404-408.
[3]Fredriksson K,Fielhaber JA,Lam JK,et al.Paradoxical effects of rapamycin on experimental house dust mite-induced asthma[J].PLoS One,2012,7(5):e33984.
[4]Liu T,Laidlaw TM,Feng C,et al.Prostaglandin E2deficiency uncovers a dominant role for thromboxane A2in house dust mite-induced allergic pulmonary inflammation[J].Proc Natl Acad Sci U S A,2012,109(31):12692-12697.
[5]Gregory LG,Jones CP,Walker SA,et al.IL-25drives remodelling in allergic airways disease induced by house dust mite[J].Thorax,2013,68(1):82-90.
[6]Bargut TC,Ferreira TP,Daleprane JB,et al.Fish oil has beneficial effects on allergen-induced airway inflammation and hyperreactivity in mice[J].PLoS One,2013,8(9):e75059.
[7]Jung JH,Kang IG,Kim DY,et al.The effect of Korean red ginseng on allergic inflammation in a murine model of allergic rhinitis[J].J Ginseng Res,2013,37(2):167-175.
[8]Park YN,Lee YJ,Choi JH,et al.Alleviation of OVA-induced airway inflammation by flowers of Inula japonica in a murine model of asthma[J].Biosci Biotechnol Biochem,2011,75(5):871-876.
[9]Kim SH,Kim BK,Lee YC.Effects of Corni fructus on ovalbumin-induced airway inflammation and airway hyper-responsiveness in a mouse model of allergic asthma[J].J Inflamm(Lond),2012,9(1):9.
[10]Kim MS,Cho KA,Cho YJ,et al.Effects of interleukin-9 blockade on chronic airway inflammation in murine asthma models[J].Allergy Asthma Immunol Res,2013,5(4):197-206.
[11]Zha WJ,Qian Y,Shen Y,et al.Galangin Abrogates Ovalbumin-Induced Airway Inflammation via Negative Regulation of NF-κB[J].Evid Based Complement Alternat Med,2013:767689.
[12]Gong JH,Shin D,Han SY,et al.Blockade of Airway Inflammation by Kaempferol via Disturbing Tyk-STAT Signaling in Airway Epithelial Cells and in Asthmatic Mice[J].Evid Based Complement Alternat Med,2013:250725.
[13]Manso L,Reche M,Padial MA,et al.Diagnostic tools assessing airway remodelling in asthma[J].Allergol Immunopathol(Madr),2012,40(2):108-116.
[14]Hofmann Bowman MA,Heydemann A,Gawdzik J,et al.Transgenic expression of human S100A12induces structural airway abnormalities and limited lung inflammation in a mouse model of allergic inflammation[J].Clin Exp Allergy,2011,41(6):878-889.
[15]Cho JY,Pham A,Rosenthal P,et al.Chronic OVA allergen challenged TNF p55/p75receptor deficient mice have reduced airway remodeling[J].Int Immunopharmacol,2011,11(8):1038-1044.
[16]Mo JH,Chung YJ,Hayashi T,et al.The role of plasmacytoid and myeloid dendritic cells in induction of asthma in a mouse model and the effect of a TLR9agonist on dendritic cells[J].Allergy Asthma Immunol Res,2011,3(3):199-204.
[17]Takada E,Furuhata M,Nakae S,et al.Requirement of apoptosis-inducing kinase 1for the induction of bronchial asthma following stimulation with ovalbumin[J].Int Arch Allergy Immunol,2013,162(2):104-114.

