水源地水库沉积物中生物硅的测定
李世雄,郭沛涌,明迅,韩文亮
(华侨大学 化工学院,福建 厦门361021)
生物硅(biogenic silica)是指生源无定形硅,主要由硅藻、海绵骨针和金藻等硅质浮游植物形成,它们吸收利用水中的溶解性硅酸盐硅Si(OH)4,在体内的同化作用下形成硅质细胞壁.由于人类活动,水体中两大重要营养元素N,P的输入不断增加,为水华爆发提供了物质基础,导致了硅质浮游植物生物量的增加,加速生物硅的沉积.随着水体中溶解态硅的不断消耗,将会造成硅藻生长的硅限制,从而降低硅藻在浮游植物群落中的数量,并发生非硅质有害藻华,如棕囊藻(Phaeocystissp.)、膝沟藻(Gonyaulaxsp.)、金色藻(Chrysochromulinasp.)等 .这些有毒藻类会释放出多种藻毒素,同时藻华也会造成水体缺氧,增加水体的浑浊度和过量毒性物质的产生[1],给水源及人类健康带来威胁,危害饮用水的供水安全.生物硅在沉积物中的积累,还可反映不同历史时期由于人类活动导致的水体的富营养化情况[2],也可用于表征上层水体中硅质种群的生产力状况[3-4],其产率也反映了水库区域的水质环境条件 .因此,生物硅的测定对于保证水源地水库水环境健康有重要的参考价值.但是由于缺乏标准品,对于生物硅的测定还没有一个普遍被接受的方法,各国学者所采用生物硅测定方法各不相同[5-8].生物硅的研究主要集中在海洋方面,有关水源地水库沉积物中生物硅的测定还未见报道.因此,本文在前人对海洋沉积物中的生物硅测定的研究基础上,通过实验建立一套针对水源地水库沉积物中的生物硅的Na2CO3碱液提取的测定方法.
1 材料与方法
1.1 仪器和试剂
1.1.1 仪器 UV-VIS 2550型紫外可见分光光度计(日本岛津公司),KQ3200DE型数控超声波清洗器(江苏苏州江东精密仪器有限公司),HH-4型数显恒温水浴锅(江苏金坛恒丰仪器制造有限公司),L-550型台式低速大容量离心机(湖南湘仪离心机仪器有限公司).
1.1.2 试剂 盐酸、过氧化氢、钼酸铵、硫酸、草酸、对甲氨基酚硫酸盐、硝酸、亚硫酸钠、碳酸钠、氟硅酸钠、氢氟酸(均为分析纯,上海国药集团化学试剂有限公司);超纯水(电阻率为18.2 MΩ·cm).
所有试剂均储存在聚乙烯瓶中,离心管为50 m L的聚丙烯管,使用前用硝酸-氢氟酸洗液清洗,玻璃仪器使用铬酸清洗.
1.2 分析方法
活性硅酸盐的检测采用GB 17378.4-2007《海洋监测规范》中的硅钼蓝法.使用在105℃烘干1 h的氟硅酸钠配制硅标准溶液,其标准曲线如图1所示.
1.3 生物硅样品采集
2011年5月在石兜-坂头水库石兜库区设置8个采样站位,如图2(a)所示 .图2(a)中:站位S8位于库区进水口;站位S6~S7位于库区上游;站位S4~S5位于库区中游;站位S2~S3位于库区下游;站位S1位于库区出水口(大坝前).
在石兜-坂头水库坂头库区设置7个采样站位,如图2(b)所示 .图2(b)中:站位B1位于库区进水口;站位B2~B4位于库区上游;站位B5位于库区中游;站位B6位于库区下游;站位B7位于库区出水口(大坝前).
利用彼得逊采泥器获得水库的表层沉积物样品.风干后,研磨过200目筛,用样品袋保存待测.在采集沉积物样品同时采集水库表层水,分析其总氮、总磷.
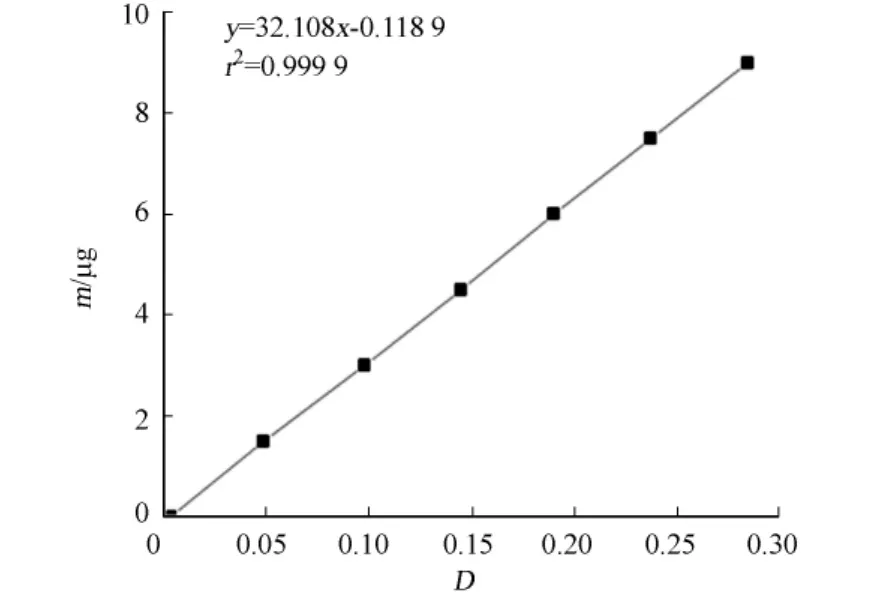
图1 硅标准曲线Fig.1 Silica standard curve
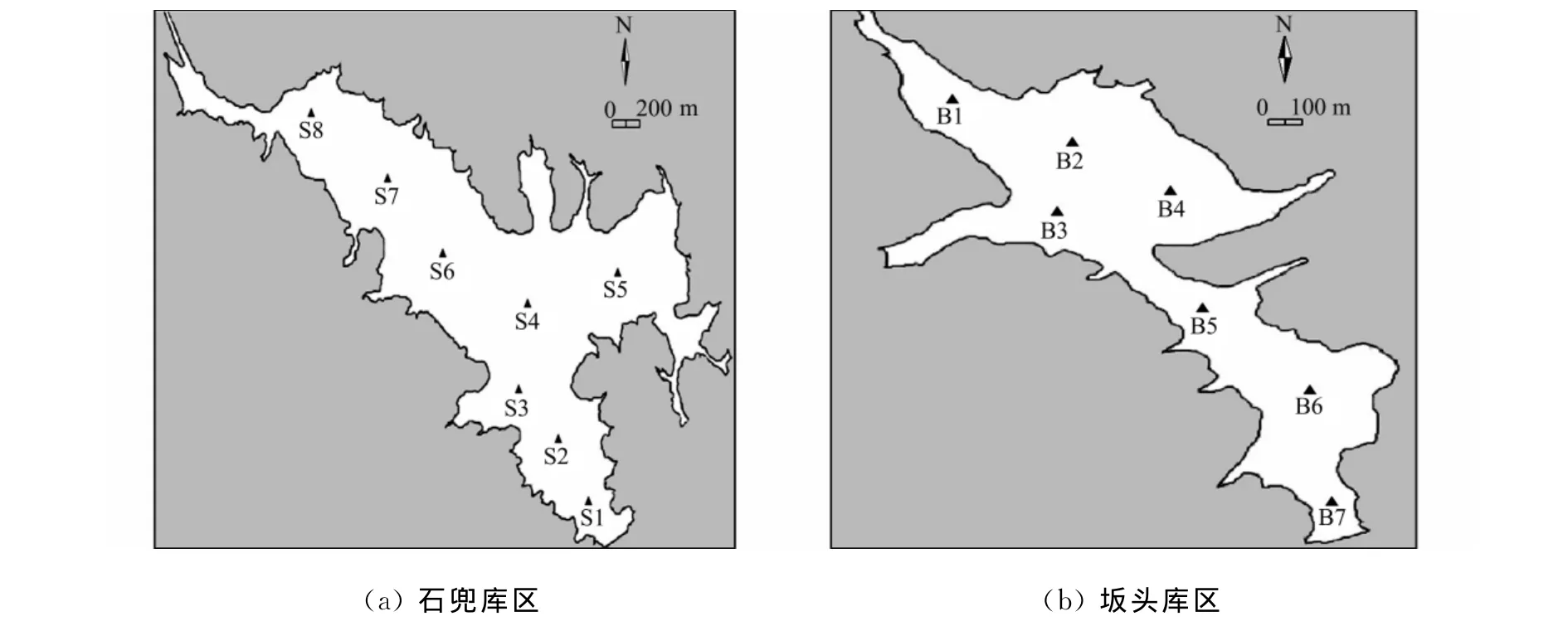
图2 采样点分布图Fig.2 Distribution diagrams of sampling sites
2 结果与讨论
2.1 样品预处理过程的优化
根据预处理过程设计了如下3组不同的流程:第1组是样品经过全部预处理;第2组是样品不经过任何预处理;第3组是样品仅经过10%的H2O2和1.0 mol·L-1的HCl处理.
全部预处理流程即使用10%的H2O2和1.0 mol·L-1的HCl去除碳酸盐和有机质等稀释相,分散沉积物使其与溶液充分接触,有利于生物硅的溶出;然后,离心并移除上清液,加入超纯水洗涤,离心移除上清液,样品放入烘箱,在60℃下烘干12 h.由于样品中仍然含有大量的粘土矿物,因此不能将样品干燥至发硬,而应保持湿润以便提取时分散样品.
实验结果发现:第1组经过全部预处理的样品测得的生物硅质量分数为(2.15±0.050)%,比第2组未进行预处理的样品质量分数为(2.29±0.026)%要低.这是因为经过12 h的烘干,样品已完全干燥,样品再次结块不利于样品的分散及生物硅的提取 .第3组仅经过H2O2和HCl处理的样品所测得的生物硅质量分数最高为(2.84±0.035)%.这是因为经过预处理,使得沉积物表面的铁、铝皮膜去除,有利于生物硅的进一步溶出,且由于没有进行烘干处理,样品在提取液中的分散性好.
经过H2O2和HCl处理有利于样品中生物硅的溶出,而烘干过程中要使得样品还保持在湿润状态,条件较难控制,会造成样品不同程度的再结块 .因此对于预处理过程,仅使用H2O2和HCl对样品进行处理,但不进行烘干处理.
2.2 提取液浓度对于生物硅提取的影响
考虑到石兜-坂头水库沉积物的沉积年龄新,且主要是硅藻为主的生物硅沉积物样品,分别考察提取液碳酸钠不同浓度(c)对生物硅提取的影响,结果如图3所示.图3中:w为生物硅的质量分数.
由图3可知:随着提取液浓度的增大,生物硅质量分数也随之逐渐增大;当提取液浓度在0.1~1.0 mol·L-1变化时,生物硅量增加的量较大;而当提取液浓度在1.0~2.0 mol·L-1变化时,生物硅质量分数几乎没有变化,曲线斜率较小,溶出的速度极慢,溶出与吸附已接近平衡.因此,使用1.0 mol·L-1的碳酸钠溶液作为提取液.
2.3 提取温度对于生物硅提取的影响
在提取液为1.0 mol·L-1碳酸钠溶液的条件下,生物硅的溶出量会随着温度的升高而不断增加,特别是在40℃以后,硅的溶出量会成倍地增加.分别考察不同提取温度(t)对生物硅提取的影响,结果如图4所示.
由图4可知:当提取温度从80℃升高到100℃时,测得的生物硅质量分数增加了74.42%.温度过低会限制生物硅的溶出,温度高会加速生物硅溶解,但与此同时也加大非生物硅的干扰程度.在碱液提取后,用显微镜观察样品,发现85℃条件下提取的沉积物样品中的微化石已经完全溶解,而90,95,100℃条件下测得的生物硅质量分数较高,主要是非生物硅组分(如粘土矿物中的硅)的溶出造成干扰所致.因此,选择85℃作为生物硅的最优提取温度.
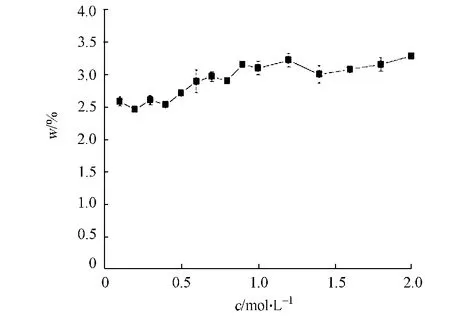
图3 提取液浓度对于生物硅提取的影响Fig.3 Influence of extracting liquid concentration on biogenic silica extraction
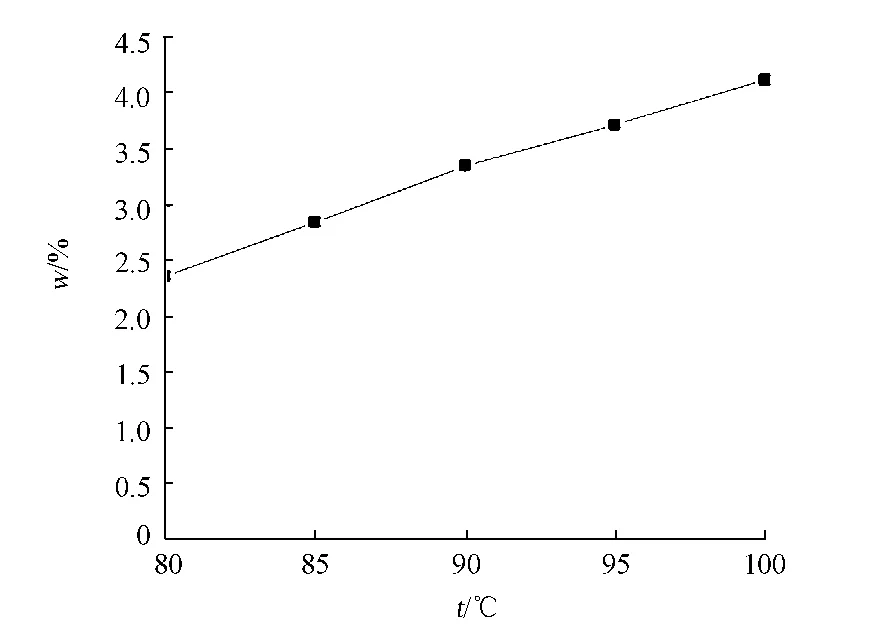
图4 提取温度对于生物硅提取的影响Fig.4 Influence of extracting temperature on biogenic silica extraction
2.4 固液比对于生物硅提取的影响
固液比变化对于生物硅测定的影响是十分明显的.在40 m L,1 mol·L-1Na2CO3提取液中,考察不同固液比(ρ)对生物硅提取的影响,结果如图5所示.
由图5可见,固液比变化对生物硅测定值的影响非常明显的.同一浓度提取液提取不同质量的样品,随着取样量增加,所提取的生物硅量逐渐减少.当取样量从20 mg增至50 mg时,测得的生物硅质量分数下降了30%左右;当增至100 mg,测得的生物硅质量分数下降了50%.
造成生物硅减小可能有两个原因 .其一是吸附损失影响.随着取样量的增加,固液比也在不断升高,样品在提取过程中溶解的硅可能会重新吸附回样品表面,溶解硅向沉积物表面的不可逆吸附引起了生物硅的损失使得测定结果偏小.其二是样品与提取液接触面积的影响.当样品取样量增大时,样品无法与提取液充分接触,因而测得生物硅值相对偏低.但固液比过小的提取液会加快沉积物中非生物硅的过度溶出,造成对实验结果的干扰.
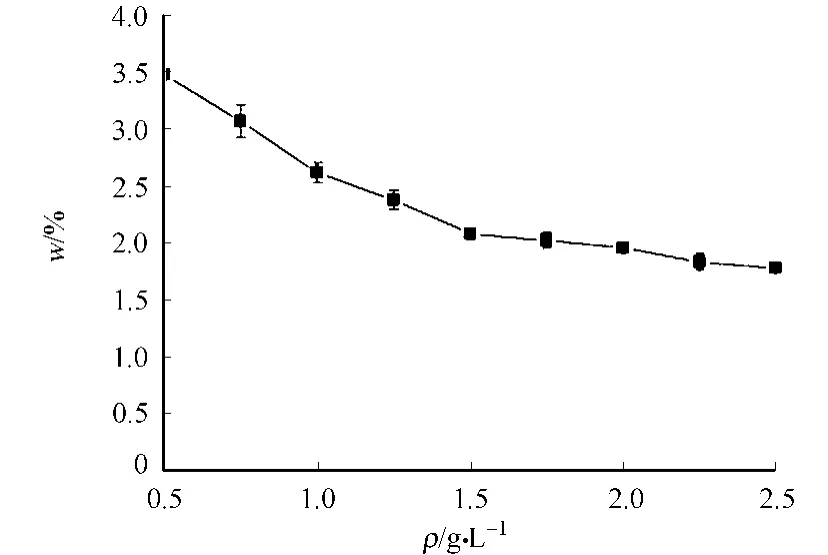
图5 固液比对于生物硅提取的影响Fig.5 Influence of solid/liquid ratio on biogenic silica extraction
因此,针对固液比对于生物硅测定的影响,可以通过使用50 m L圆底离心管增大样品与提取液的接触面积.有研究表明,当固液比在0.625~2.500 g·L-1范围内,不存在明显的吸附损失[9].镜检结果发现,固液比为0.75 g·L-1的样品中没有微化石残存 .因此,选定石兜-坂头水库沉积物生物硅测定的固液比为0.75 g·L-1,即取样量为30 mg.
2.5 正交实验
结合上述的单因素试验结果,以预处理方式(A)、提取液浓度(B)、提取温度(C)及固液比(D)为因素,选用L9(34)正交实验表(表1)设计正交实验,对生物硅的提取进行工艺优化,结果如表2所示.表1中:预处理方式的1~3分别代表样品经过全部预处理,不经过任何预处理和仅经过10%的H2O2和1.0 mol·L-1的 HCl处理 .表2中:γ为生物硅的提取率.
由表2可知:影响生物硅提取的因素的主次顺序为预处理>固液比>温度>浓度;预处理最优水平是仅经过H2O2和HCl处理的样品,固液比为0.5 g·L-1,提取温度为90℃,提取液浓度为0.8 mol·L-1.方差检验发现:在a=0.10水平上,4个因素对生物硅测定的影响都不显著 .这主要是由于误差自由度小,使检验的灵敏度降低,掩盖了考察因素的统计学意义.
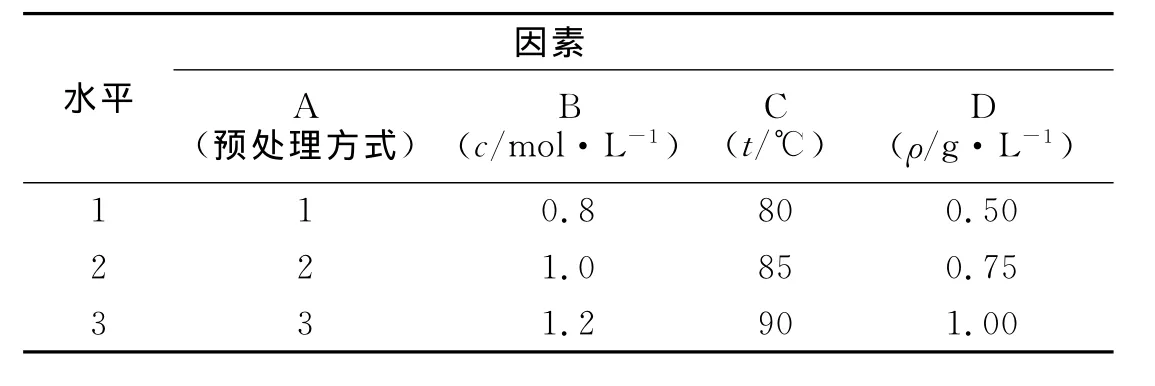
表1 正交水平因素表Tab.1 Orthogonal level factors table
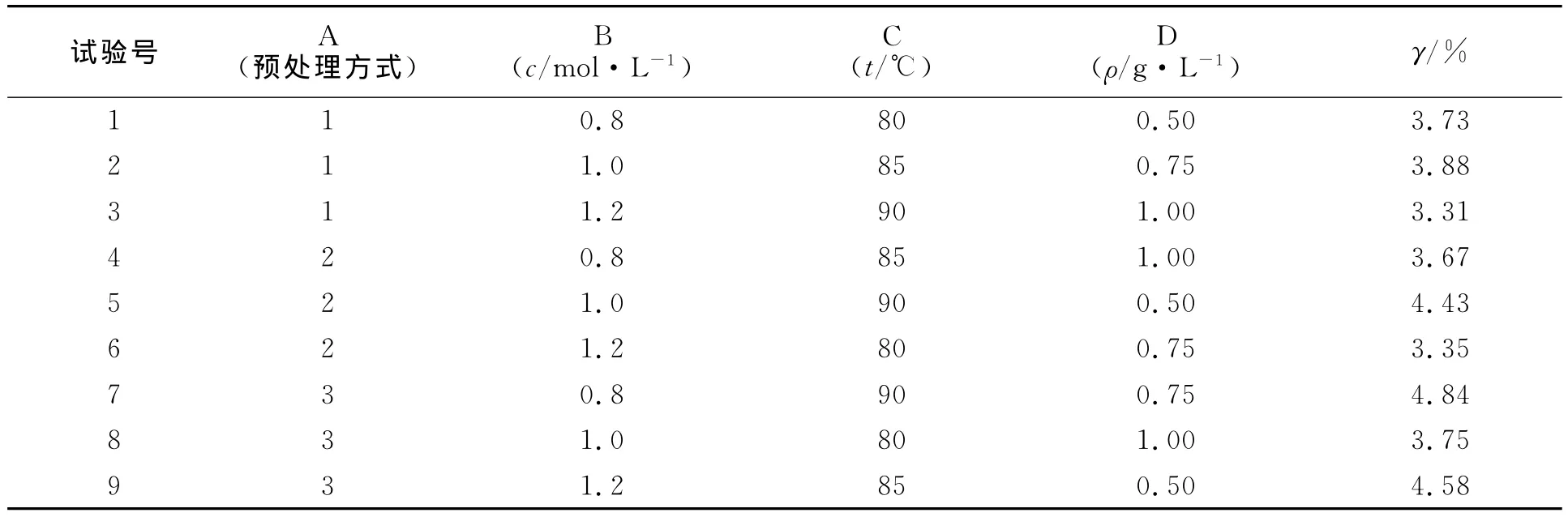
表2 正交实验结果Tab.2 Result of orthogonal text
根据正交实验的结果,可以发现提取温度、固液比对生物硅测定的影响分别随着因素水平的不断增大而增大和减小,不能作为确定该因素适宜水平的依据 .在实验范围内,提取液浓度对生物硅测定的影响最小.正交实验中,对于F检验不显著的因素,适宜的水平可以是任意的.因此,结合单因素实验和正交实验,选择最优实验条件:预处理方式为仅使用HCl和H2O2对样品进行预处理;提取液碳酸钠浓度为1 mol·L-1;提取温度为85℃;固液比为0.75 g·L-1.
根据前述分析的提取实验条件,确定了如下的水源地水库沉积物生物硅的测定方法.
1)准确称取30 mg样品,置于50 m L的聚丙烯离心管中,加入5 m L,10%的H2O2,放置30 min,再加入5 m L,1.0 mol·L-1的HCl,封盖并超声波震荡30 min;然后,在相对离心力为4 200 g条件下离心5 min,弃上清液.最后,再加入20 m L超纯水洗涤,充分摇匀,使沉积物样品分散完全,在相对离心力为4 200 g条件下,离心5 min,弃上清液,以去除残余H2O2和HCl.
2)加入40 m L碳酸钠溶液,封盖后,放置于85℃水浴锅中提取生物硅.在水浴过程中每隔1 h摇匀一次,水浴结束后立即取出聚丙烯离心管,在相对离心力为4 300 g条件下,离心5 min.然后,吸取一定的上清液进行测定.
每个采样点沉积物样品设定3个平行样,生物硅测定结果的相对标准偏差均小于10%.
3 水源地水库生物硅的测定
水库表层沉积物中的生物硅主要来源于硅藻,通过硅藻可以指示硅藻生物量的空间分布情况,从而推断出水库营养盐的变动过程以及初级生产力的水平分布情况.为了检验该方法的适用性,对福建厦门市一级水源保护地石兜-坂头水库的沉积物样品进行采样分析,库区生物硅质量分数分布如图6所示.采样站点的布设如图2所示.
由图6可知:石兜-坂头水库的石兜库区的生物硅质量分数为(3.44±0.12)%~(6.25±0.04)%,平均值为4.48%;坂头库区的生物硅质量分数为(3.06±0.02)%~(7.30±0.48)%,平均值为4.73%.两个库区出水口区域(石兜1~3号采样站点,坂头6,7号采样站点)生物硅质量分数较高,这主要是因为随着过水面积增大,水流流速从库尾到坝前逐渐减缓,泥沙与硅质类浮游生物不断沉积;入水口区域(石兜6~8号采样站点,坂头1,2号采样站点)都是水库的入流区域,水体浅且水流流速大,水库底部受到强烈的冲刷,沉积物多为侵蚀残留的物质;石兜库区3号采样站点生物硅质量分数高,主要是由于3号采样站点处于一支流的入库并流区域,该支流流域的山坡地、耕地种植水果、茶叶及农作物等,受到农业面源污染较为严重,硅藻类浮游植物生长迅速并且沉积到水库底部.
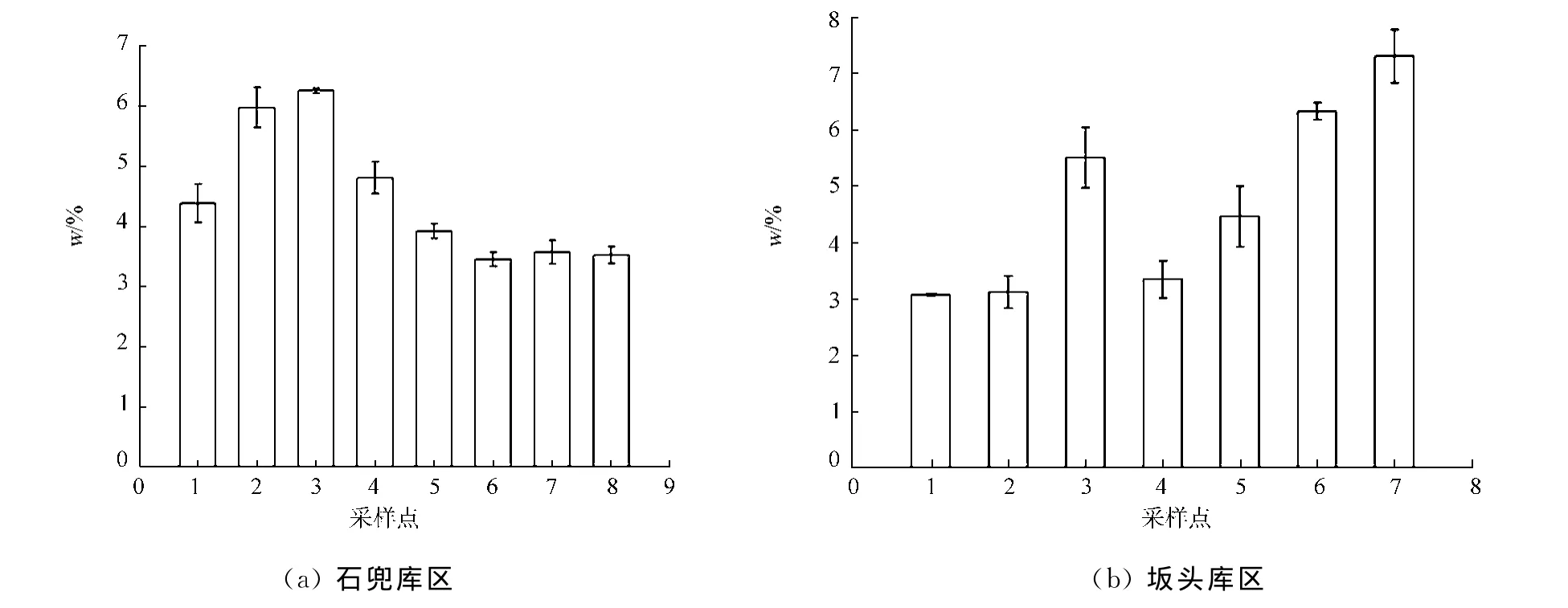
图6 库区生物硅质量分数分布Fig.6 Content distribution of biogenic silica in reservoir
与长江口[10]、胶州湾[11]等相比,石兜-坂头水库沉积物中的生物硅质量分数较高,这主要是由于湖内的硅藻类浮游植物的大量增长,使得生物硅在沉积物中的积累增加.生物硅质量分数可以作为硅藻生产力的一个指标,进而代表全部浮游植物的生产力水平 .石兜-坂头水库沉积物中相对较高的生物硅质量分数,说明该水库拥有较高的初级生产力水平.石兜库区表层水中的总磷和总氮的平均质量浓度为0.037 mg·L-1和0.233 mg·L-1,坂头库区表层水的总磷和总氮的平均质量浓度为0.043 mg·L-1和0.256 mg·L-1.由此可以发现,上层水体中的氮、磷营养盐质量分数相对较少,这主要是由于高生产力消耗了水体中的营养盐.春季的石兜-坂头水库处于低温,低强度光照和高浊度,高营养盐浓度的状态,这种条件十分适合硅藻的生长,大量硅藻的生长消耗了水库水体中大量的营养盐.综合可知,水源地水库沉积物中的生物硅质量分数与水库的初级生产力是相对应的,并且这一对对应关系可以通过氮、磷营养盐的状况体现出来.
4 结束语
针对水源地水库沉积物中的生物硅的测定建立了一套测定方法:使用HCl和H2O2对样品进行预处理,然后利用1 mol·L-1的碳酸钠溶液在85℃水浴条件下进行单点提取,固液比为0.75 g·L-1.该方法优化了样品的预处理过程,使得测定过程更加简便、准确.通过对厦门一级水源保护地石兜-坂头水库的沉积物样品的测定,证明了该方法的适用性,可以应用于其他类似水源地水库沉积物中生物硅的测定,为水库的营养盐变动和初级生产力分布的监测,防治水源水体富营养化提供了科学工具.
[1] STRUYF E,SMIS A,DAMME S V,et al.The global biogeochemical silicon cycle[J].Silicon,2009,1(4):207-213.
[2] WESSELS M,MOHAUPT K,KÜMMERLIN R,et al.Reconstructing past eutrophication trends from diatoms and biogenic silica in the sediment and the pelagic zone of Lake Constance,Germany[J].Journal of Paleolimnology,1999,21(2):171-192.
[3] PENSA M A,CHAMBERS R M.Trophic transition in a lake on the virginnia coastal plain[J].Journal of Enviromental Quality,2004,33(2):576-580.
[4] KRAUSE J W,NELSON D M,BRZEZINSKI M A.Biogenic silica production and the diatom contribution to primary production and nitrate uptake in the eastern equatorial Pacific Ocean[J].Deep Sea Research PartⅡ:Topical Studies in Oceanography,2010,58(3/4):434-448.
[5] CONLEY D J.An interlaboratory comparison for the maesurement of biogenic silica in sediments[J].Marine Chemistry,1998,63(1/2):39-48.
[6] OHLENDORF C,STUR M M.A modified method for biogenic silica determination[J].Journal of Paleolimnol,2008,39(1):137-142.
[7] SCHLÜTER M,SAUTER E.Biogenic silica cycle in surface sediments of the Greenland Sea[J].Journal of Marine Systems,2000,23(4):333-342.
[8] KHALIL K,RABOUILLE C,GALLINARI M,et al.Constraining biogenic silica dissolution in marine sediments:A comparison between diagenetic models models and experimental dissolution rates[J].Marine Chemistry,2007,106:223-238.
[9] GEHLEN M,RAAPHORST W.Early diagenesis of silica in sandy North Sea sediment:Quantification of the solid phase[J].Marine Chemistry,1993,42(2):71-83.
[10] 侯立军,刘敏,闫惠敏,等.长江口潮滩沉积物生物硅的分布及其影响因素[J].中国环境科学,2007,27(5):665-669.
[11] 李学刚,宋金明,袁华茂,等.胶州湾沉积物中高生源硅含量的发现:胶州湾浮游植物生长硅限制的证据[J].海洋与湖沼,2005,36(6):572-579.

